✓ Вспомните реакции между классами изученных соединений, в результате которых образуются соли. Как классифицируют эти вещества, как образуются их названия и какими общими свойствами они обладают?
Оксиды делятся на основные и кислотные.
Их названия образуются по схеме: оксид + название элемента + валентность, если она переменная.
Основные оксиды реагируют с кислотами, водой и кислотными оксидами. Кислотные оксиды реагируют со щелочами, водой и основными оксидами.
Основания делятся на растворимые (щелочи) и нерастворимые.
Их названия образуются по схеме: гидроксид + название элемента + валентность, если она переменная.
Щелочи реагируют с кислотными оксидами, кислотами и солями. Нерастворимые основания разлагаются под действием температуры и вступают в реакцию с кислотами.
Кислоты можно классифицировать по следующим признакам:
1. Наличие кислорода: кислородосодержащие и бескислородные.
2. Основность: одноосновные, двухосновные, трехосновные.
ХУДШЕЕ УДОБРЕНИЕ ДЛЯ ПЕРЦА! Не подкармливайте рассаду перца этим популярным фосфорным удобрением
3. Растворимость: растворимые и нерастворимые.
4. Летучесть: летучие и нелетучие.
5. Стабильность: стабильные и нестабильные.
Рассмотрим общий способ образования названий кислот.
Бескислородные кислоты: неметалл−о−водородная кислота
Например: HCl − хлороводородная кислота; $H_$S − сероводородная кислота
Кислородсодержащие кислоты: неметалл−ист(н)−ая кислота
Например: $HNO_$ − азотистая кислота; $HNO_$ − азотная кислота.
Кислый вкус, действие на индикаторы, взаимодействие с металлами, основными оксидами, основаниями и солями − все эти свойства являются общими для кислот. Общие свойства кислот определяются наличием в составе их молекул атомов водорода.
Лабораторный опыт 24
1. Ознакомьтесь с коллекцией выданных вам образцов солей. Запишите их формулы, охарактеризуйте физические свойства, в том числе и растворимость в воде. Рассчитайте относительную молекулярную массу одной из выданных вам солей. Рассчитайте массовые доли элементов для этой же соли.
Дано:
$ZnCl_$
$Na_$ $SO_$
$KNO_$
Найти:
Mr ($KNO_$) − ?
ω (K) − ?
ω (N) − ?
ω (O) − ?
Решение:
$ZnCl_$ − соль белого цвета, растворимая в воде.
$Na_$ $SO_$ − соль белого цвета, растворимая в воде.
$KNO_$ − соль белого цвета, растворимая в воде.
Mr ($KNO_$) = 39 + 14 + 3 * 16 = 101
ω = n * Ar : Mr * 100%
ω (K) = 1 * 39 : 101 * 100% = 38,6%
ω (N) = 1 * 14 : 101 * 100% = 13,9%
ω (O) = 3 * 16 : 101 * 100% = 47,5 %
Ответ: Mr ($KNO_$) = 101; ω (K) = 38,6%; ω (N) = 13,9%; ω (O) = 47,5 %
Лабораторный опыт 25
1. Налейте в пробирку 2−3 мл раствора сульфата меди(II) и опустите в него стальную кнопку или скрепку. Что наблюдаете?
Сульфат меди(II) − $CuSO_$
Сталь − Fe
Запишем уравнение реакции:
$CuSO_$ + Fe = $FeSO_$ + Cu
Наблюдается образование красного налета (меди) на скрепке.
Лабораторный опыт 26
1. В три пробирки с растворами хлорида, фосфата и иодида натрия добавьте по нескольку капель раствора нитрата серебра. Что наблюдаете? Запишите уравнения реакций.
9 класс. Урок 8. Соли фосфорной кислоты.
Хлорид натрия − NaCl
Фосфат натрия − $Na_$ $PO_$
Йодид натрия − NaI
Нитрат серебра − $AgNO_$
Запишем уравнения реакций:
1) NaCl + $AgNO_$ = AgCl + $NaNO_$
Наблюдается образование белого творожистого осадка − хлорида серебра.
2) $Na_$ $PO_$ + 3$AgNO_$ = $Ag_$ $PO_$ + 3$NaNO_$
Наблюдается образование ярко−желтого осадка − фосфата серебра.
3) NaI + $AgNO_$ = Agl + $NaNO_$
Наблюдается образование желтого осадка − йодида серебра.
Проверьте свои знания
1. Дайте определение солям, исходя из состава этих соединений. Для каких солей это определение справедливо?
Соли − сложные вещества, состоящие из металла и кислотного остатка.
Это определение солей справедливо только для средних или нормальных солей.
Средние соли, или нормальные соли − это продукты полного замещения атомов водорода в молекуле кислоты атомами металла.
2. Как классифицируют соли? Каковы различия между основными и кислыми солями? В чём их сходство?
В начале XIX в. шведский химик Й. Я. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями или соединений, полученных замещением атомов водорода в кислоте на металл. По этому признаку различают соли средние, кислые и основные.
Основные соли − продукты неполного замещения гидроксогрупп в основании на кислотный остаток.
Пример: $(CuOH)_$ $CO_$
Кислые соли − продукты неполного замещения атомов водорода в кислоте на металл.
Пример: $NaHCO_$
Сходство солей в том, что они состоят из метала, кислотного остатка.
3. Охарактеризуйте растворимость солей в воде.
Растворимость солей в воде приведена в таблице растворимости: Р − растворимые, Н − нерастворимые, М − малорастворимые. Для решения вопроса о растворимости солей можно руководствоваться следующей памяткой:
1) растворимы в воде все соли натрия и калия, а также все нитраты;
2) нерастворимы все фосфаты, карбонаты, силикаты и сульфиды (исключение составляют соединения натрия, калия и аммония);
3) растворимы все хлориды, за исключением AgCl (нерастворим) и $PbCl_$ (малорастворим);
4) растворимы большинство сульфатов, кроме сульфата бария $BaSO_$ (нерастворим), сульфата свинца(II) $PbSO_$ (нерастворим), сульфата кальция $CaSO_$ (малорастворим), сульфата серебра $Ag_$ $SO_$ (малорастворим).
4. Из предложенного перечня выберите формулы солей: $NiCl_$, LiOH, $POCl_$, $SiH_$, $Pb(NO_$ $)_$, $Fe_$ $(SO_$ $)_$, $SCl_$, $CaSO_$, $Ba_$ $(PO_$ $)_$, $CuSO_$, $Sn(NO_$ $)_$ − и дайте им названия. Укажите, какие из них растворимы, малорастворимы или нерастворимы в воде.
Соли:
1) $NiCl_$ − хлорид никеля(II), растворимая соль
2) $Pb(NO_$ $)_ $ − нитрат свинца(II), растворимая соль
3) $Fe_$ $(SO_$ $)_ $ − сульфат железа(III), растворимая соль
4) $CaSO_$ − сульфат кальция, малорастворимая соль
5) $Ba_$ $(PO_$ $)_ $ − фосфат бария, нерастворимая соль
6) $CuSO_$ − сульфат меди(II), растворимая соль
7) $Sn(NO_$ $)_$ − нитрат олова(II), растворимая соль
Примените свои знания
5. Запишите уравнения всех возможных реакций, с помощью которых можно получить сульфат цинка.
Запишем уравнения реакций, с помощью которых можно получить сульфат цинка:
1) ZnO + $H_$ $SO_$ = $ZnSO_$ + $H_$O
2) Zn + $H_$ $SO_$ = $ZnSO_$ + $H_$
3) $Zn(OH)_$ + $H_$ $SO_$ = $ZnSO_$ + 2$H_$O
4) $ZnCl_$ + $H_$ $SO_$ = $ZnSO_$ + 2HCl
6. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
C → $CO_$ → $MgCO_$ → MgO → $Mg(NO_$ $)_$ → $Mg(OH)_$ → MgO
C → $CO_$ → $MgCO_$ → MgO → $Mg(NO_$ $)_$ → $Mg(OH)_$ → MgO
1) C + $O_$ → $CO_$
2) $CO_$ + MgO → $MgCO_$
3) $MgCO_$ → $CO_$ + MgO
4) MgO + 2$HNO_$ → $Mg(NO_$ $)_$ + $H_$O
5) $Mg(NO_$ $)_$ + 2NaOH → $Mg(OH)_$ + 2$NaNO_$
6) $Mg(OH)_$ → MgO + $H_$O
7. Какая масса гидрокарбоната натрия (рыхлителя теста) потребуется для получения 9л газов (н. у.), включая водяные пары?
Дано:
V(газов) = 9 л
Найти: m($NaHCO_$) − ?
Решение:
2$NaHCO_$ = $Na_$ $CO_$ + $CO_$ + $H_$O
n(газов) = V : Vm = 9 л : 22,4 л/моль = 0,4 моль
n($NaHCO_$) = n(газов) = 0,4 моль
m($NaHCO_$) = n * M = 0,4 моль * 84 г/моль = 33,6 г
Ответ: потребуется 33,6 г гидрокарбоната натрия.
Используйте дополнительную информацию
8. Подготовьте сообщение на тему «Значение соды в народном хозяйстве и история содового производства».
Значение соды в народном хозяйстве и история содового производства
В настоящее время сода является ценным сырьем для стекольной, мыловаренной, текстильной, пищевой и других отраслей промышленности. Сода − это первое вещество, которое было получено искусственным путем. Ее производство дало толчок развитию целого ряда отраслей химической промышленности (получению серной кислоты, хлора, некоторых неорганических солей, минеральных удобрений и т. д.).
Сода представляет собой белую, легко растворимую соль. В своем составе она содержит воду, которая испаряется при нагревании или выветривании на воздухе. Такая, полностью потерявшая воду сода называется кальцинированной и является основным сырьем для производства других содовых продуктов.
- Вы здесь:
- 8 класс
- Химия
- ГДЗ ответы к учебнику химия 8 класс, Габриелян, Остроумов, Сладков
- ГДЗ ответы к рабочей тетради по химии 8 класс, Габриелян, Сладков, Остроумов
- ГДЗ ответы к рабочей тетради химия 8 класс, Габриелян, Сладков
- ГДЗ ответы к учебнику химия 8 класс, Рудзитис, Фельдман
- ГДЗ ответы к учебнику химия 8 класс, Габриелян
Источник: gdzotvet.ru
Составьте формулы солей: хлорида кальция, карбонат калия, сульфата магния, фосфата меди (II) нитрат серебра сульфид серебра
Найди верный ответ на вопрос ✅ «Составьте формулы солей: хлорида кальция, карбонат калия, сульфата магния, фосфата меди (II) нитрат серебра сульфид серебра . » по предмету Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Новые вопросы по химии
Что произойдёт с железом при взаимодействии с водой? 3 класс.
C8h18 формула глюкозы
1. Цинк растворили в концентрированной азотной кислоте. Полученный газ растворили в горячей воде. В ходе этого взаимодействия образовался бесцветный газ. Он легко окисляется кислородом воздуха до образования бурого газа.
Закончите формулы. H2+CuO= Na+HCl =
Что такое макроэлементы и ультромикроэлементы?
Главная » Химия » Составьте формулы солей: хлорида кальция, карбонат калия, сульфата магния, фосфата меди (II) нитрат серебра сульфид серебра
Источник: urokam.net
Фосфат серебра это соль или кислота
Ключевые слова конспекта: ортофосфорная кислота, фосфаты
Высшими гидроксидами фосфора являются фосфорные кислоты: ортофосфорная H3РO4, метафосфорная НРО3 и дифосфорная Н4Р2O7.
Ортофосфорная кислота – вещество молекулярного строения. В безводном состоянии образует бесцветные гигроскопичные легкоплавкие (t°пл = 42 °С) кристаллы. Смешивается с водой в любых соотношениях.
Ортофосфорная кислота – слабый электролит, диссоциирует ступенчато:
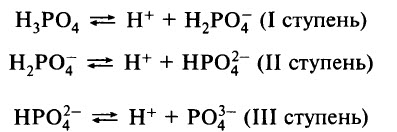
Ортофосфорная кислота проявляет общие свойства кислот. Она взаимодействует:
- а) с основаниями:

- б) с основными и амфотерными оксидами:

- в) с солями более слабых и летучих кислот:

В отличие от азотной кислоты, ортофосфорная может образовать кислые соли:
2КОН + H3РO4 = К2НРO4 + 2H2O
или
КОН + H3РO4 = КH2РO4 + H2O

Окислительные свойства осуществляются только за счёт иона водорода. Однако реакции со многими металлами замедляются из-за образования нерастворимых фосфатов. Например, магний реагирует с фосфорной кислотой, но скорость реакции постепенно уменьшается вследствие образования нерастворимого фосфата на поверхности магния:
При нагревании ортофосфорная кислота теряет воду, превращаясь в дифосфорную кислоту, а затем в полифосфорные кислоты:
2H3РO4 = Н4Р2O7 + H2O
ФОСФАТЫ
Ортофосфорная кислота – трёхосновная, образует три ряда солей: средние – фосфаты Xn(PO4)m (X – катион металла), кислые – гидроортофосфаты Xn(HPO4)m (X – катион металла или NH4 + ) и дигидроортофосфаты Х(H2РO4)n (X – катион металла или NH4 + , n = 1; 2).
Фосфаты – вещества с ионным типом кристаллических решёток, при обычных условиях – твёрдые кристаллические вещества. Фосфаты могут быть окрашены только за счёт катионов металлов. Средние фосфаты плохо растворимы в воде (растворимы только фосфаты Na, К, Rb, Cs), гидрофосфаты и особенно дигидрофосфаты гораздо лучше растворимы в воде. Средние ортофосфаты плавятся без разложения при нагревании при достаточно высоких температурах.
В водных растворах средних фосфатов обязательно происходит гидролиз:

Поэтому водные растворы средних фосфатов имеют щелочную реакцию.
Для фосфатов, в отличие от нитратов, не характерны окислительные свойства, несмотря на то что фосфор находится в высшей степени окисления. Этому способствует симметричная тетраэдрическая структура иона РО4 3– .
Однако восстановление фосфора в высшей степени окисления +5 возможно. Примером такой реакции может служить промышленное получение фосфора:

Одной из качественных реакций на фосфаты является образование жёлтого осадка при взаимодействии с растворимыми солями серебра:

Конспект урока химии «Ортофосфорная кислота. Фосфаты».
Источник: uchitel.pro