Фторид бериллия (бериллий фтористый, дифторид бериллия) — в чистом виде бесцветное кристаллическое вещество.
- 1 История получения
- 2 Физические свойства
- 3 Химические свойства
- 4 Получение
- 5 Применение
- 6 См. также
- 7 Литература
История получения [ править | править код ]
Физические свойства [ править | править код ]
- Растворимость (хол. вод)
- Растворимость (гор. вод)
Химические свойства [ править | править код ]
Получение [ править | править код ]
Применение [ править | править код ]
См. также [ править | править код ]
- Бериллий
- Галогениды бериллия
Источник: traditio.wiki
Фторид бериллия
Фторид бериллия — бинарное химическое соединение с химической формулой BeF2.Бесцветные кристаллы.В воде растворяется, образует кристаллогидрат. Ядовит.
Яд в твоей зубной пасте
1S/Be.2FH/h;2*1H/q+2;;/p-2
JZKFIPKXQBZXMW-UHFFFAOYSA-L
Получение
- Непосредственно из элементов:
- Действием газообразного фтористого водорода на оксид, гидроксид или карбонат бериллия:
- Разложением (NH4)2[BeF4]:
- Безводный фторид бериллия получают нагреванием кристаллогидрата в токе фтористого водорода:
Применение
- В производстве металлического бериллия.
- Компонент специальных стекол.
- В солевой смеси ядерных реакторов на расплавленных солях.
Похожие материалы

Соединения бериллия 0
Ацетат бериллия — неорганическое соединение, соль металла бериллия и уксусной кислоты с формулой Be(CH3COO)2,

Соединения бериллия 0
Ацетилацетонат бериллия — хелатное соединение бериллия и ацетилацетонас формулой Be(C5H7O2)2, бесцветные кристаллы. Ацетилацетонат бериллия

Соединения бериллия 0
Бериллийорганические соединения — соединения, в которых атом бериллия соединён непосредственно с атомом углерода органических функциональных

Соединения бериллия 0
Бериллий — химический элемент второй группы, второго периода периодической системы с атомным номером 4. Как

Бериллий. Очень легкий и дорогой металл!
Соединения бериллия 0
Бериллиды — интерметаллические соединения бериллия с другими металлами. Бериллиды представляют собой очень твердые вещества с

Соединения бериллия 0
Бериллаты — химические соединения, представляющие собой соли амфотерного гидроксида бериллия Be(OH)2, который диссоциирует преимущественно
Подкатегории
- Соединения азота
- Соединения актиния
- Соединения алюминия
- Соединения америция
- Соединения аргона
- Соединения астата
- Соединения бария
- Соединения бериллия
- Соединения берклия
- Соединения бора
- Соединения брома
- Соединения ванадия
- Соединения висмута
- Соединения вольфрама
- Соединения гадолиния
- Соединения галлия
- Соединения гафния
- Соединения германия
- Соединения гольмия
- Соединения диспрозия
- Соединения европия
- Соединения железа
- Соединения золота
- Соединения индия
- Соединения иода
- Соединения иридия
- Соединения иттербия
- Соединения иттрия
- Соединения кадмия
- Соединения калия
- Соединения кальция
- Соединения кислорода
- Соединения кобальта
- Соединения кремния
- Соединения криптона
- Соединения ксенона
- Соединения кюрия
- Соединения лантана
- Соединения лития
- Соединения лютеция
- Соединения марганца
- Соединения меди
- Соединения молибдена
- Соединения мышьяка
- Соединения натрия
- Соединения неодима
- Соединения нептуния
- Соединения никеля
- Соединения ниобия
- Соединения олова
- Соединения осмия
- Соединения палладия
- Соединения платины
- Соединения плутония
- Соединения полония
- Соединения празеодима
- Соединения прометия
- Соединения протактиния
- Соединения радия
- Соединения рения
- Соединения родия
- Соединения ртути
- Соединения рубидия
- Соединения рутения
- Соединения самария
- Соединения свинца
- Соединения селена
- Соединения серебра
- Соединения серы
- Соединения скандия
- Соединения стронция
- Соединения сурьмы
- Соединения таллия
- Соединения тантала
- Соединения теллура
- Соединения тербия
- Соединения технеция
- Соединения титана
- Соединения тория
- Соединения тулия
- Соединения углерода
- Соединения урана
- Соединения фосфора
- Соединения фтора
- Соединения хлора
- Соединения хрома
- Соединения цезия
- Соединения церия
- Соединения цинка
- Соединения циркония
- Соединения эрбия
- Все соединения
- Все предприятия
- Все элементы и определения
- ГОСТы
- Таблица Менделеева
Источник: chemicalportal.ru
главная > справочник > химическая энциклопедия:
БЕРИЛЛИЯ ФТОРИД BeF2, кристаллич. или аморфное вещество. До 220°С устойчива модификация с гексаген, решеткой типа 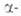 кварца (а = 0,4750 нм, с = 0,5186 нм, z = 3); плотн. 1,97 г/см 3 ; С°р 51,84 Дж/(моль*К);
кварца (а = 0,4750 нм, с = 0,5186 нм, z = 3); плотн. 1,97 г/см 3 ; С°р 51,84 Дж/(моль*К); 
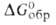 -979,9 кДж/моль; 5 o 298 53,3
-979,9 кДж/моль; 5 o 298 53,3
Дж/(молъ*К). Эта модификация при нагр. переходит в гексагональную типа 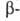 кварца с т. пл. 550°С и
кварца с т. пл. 550°С и 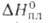 4,77 кДж/моль. Известна также тетрагон. модификация (типа
4,77 кДж/моль. Известна также тетрагон. модификация (типа 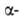 кристобалита), которая при 130°С переходит в кубическую типа
кристобалита), которая при 130°С переходит в кубическую типа 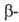
Т. кип. 1175 С С, 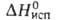 200 кДж/моль. бериллия фторид гигроскопичен, раств. в воде (846 г/л при 25 °С), не раств. в этаноле. Гидролизуется растворами щелочей и водой при нагревании, взаимод. с H2SO4. Получают BeF2 разложением (NH4)2BeF4 при 800-1100°С, значительно реже — взаимод.
200 кДж/моль. бериллия фторид гигроскопичен, раств. в воде (846 г/л при 25 °С), не раств. в этаноле. Гидролизуется растворами щелочей и водой при нагревании, взаимод. с H2SO4. Получают BeF2 разложением (NH4)2BeF4 при 800-1100°С, значительно реже — взаимод.
ВеО с газообразным HF. Магниетермич. восстановлением BeF2 получают металлич. Be. бериллия фторид — компонент фторобериллатных стекол и солевой смеси ядерных реакторов на расплавл. солях. бериллия фторид токсичен; ПДК 0,001 мг/м 3 .
С фторидами щелочных металлов и аммония BeF2 образует фторобериллаты. Тетрафторобериллат аммония (NH4)2BeF4-кристаллы; при нагр. разлагается последовательно до NH4BeF3 и BeF2; C°p 211 Дж/(моль*К); 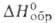
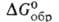 — 1728 кДж/моль; S o 298 250 Дж/(моль*К); раств. в йоде (32,2% по массе при 25°С) и растворах NH4F. Получают: взаимод. ВеО с водными растворами HF или NH4HF2 с послед, добавлением NH3 и выпариванием. реакцией ВеО или Ве(ОН)2 с безводным NH4HF2 при 100-200 °С.
— 1728 кДж/моль; S o 298 250 Дж/(моль*К); раств. в йоде (32,2% по массе при 25°С) и растворах NH4F. Получают: взаимод. ВеО с водными растворами HF или NH4HF2 с послед, добавлением NH3 и выпариванием. реакцией ВеО или Ве(ОН)2 с безводным NH4HF2 при 100-200 °С.
Тетрафторобеоиллат лития Li2BeF4 — кристаллы. т. пл. 459,1 °С; 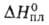
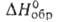 -2272 кДж/моль,
-2272 кДж/моль, 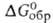 -2170 кДж/моль; S o 298 130 Дж/(моль*К); умеренно раств. в воде; растворяет UF4, ThF4, ZrF4 и др. фториды. Получают сплавлением BeF2 с LiF. Используют как компонент солевой смеси ядерных реакторов на расплавл. солях.
-2170 кДж/моль; S o 298 130 Дж/(моль*К); умеренно раств. в воде; растворяет UF4, ThF4, ZrF4 и др. фториды. Получают сплавлением BeF2 с LiF. Используют как компонент солевой смеси ядерных реакторов на расплавл. солях.
Тетрафторобериллат натрия Na2BeF4 — кристаллы. т. пл. ок. 590°С; раств. в воде (1,37% по массе при 20°С). Получают спеканием бериллиевых концентратов с Na2SiF6 и Na,CO3 при 750-800°С или сплавлением BeF2 с NaF; в лаб. — взаимод. Ве(ОН)2 с фтористоводородной кислотой и Na2CO3. Промежут. продукт в произ-ве Ве(ОН)2 и др. соединений Be.
Лит. см. при ст. Бериллий. Э. Г. Раков.
Источник: www.chemport.ru