Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Общее число найденных записей: 1. Показано записей: 1.
Фторид серебра(I)
Брутто-формула: AgF CAS# 7775-41-9
PubChem CID: 62656 | ChemSpider ID: 56407 | CHEBI:30340
Фторид серебра(I) [Wiki] монофторид серебра соль плавиковой кислоты и серебра
Argentousfluoride Caswell No. 736 EINECS:231-895-8 Silber(1+)fluorid (IUPAC) Silver fluoride Silver fluoride (AgF) Silver monofluoride Silver(1+) fluoride Silver(I) fluoride [Wiki] Silver(I)fluoride fluorosilver (IUPAC)
Источник: charchem.org
Большая Энциклопедия Нефти и Газа
Среди фторидов серебра имеется соединение, формулу которого обычно записывают как Ag2 F. На основании этих сведений установите, чем же компенсируется отсутствие второго иона: F — в Ag2p, составьте уточненную формулу соединения и назовите его. [19]
Химия | седьмая группа | хлор | 6 | фториды хлора
Катализатором служит фторид серебра , нанесенный на медь; в результате взаимодействия серебра со фтором образуется как AgF, так и AgF2; последний продукт, вероятно, и является фторирующим веществом. [20]
Катализатором служит фторид серебра , нанесенный на медь; в результате взаимодействия серебра со фтором образуется как AgF, так и AgF2; последний продукт-вероятно, и является фторирующим веществом. [21]
В суспензию фторида серебра в бензоле пропускают трифторид бора до тех пор, пока почти все твердое вещество не растворится. [22]
Водный раствор фторида серебра служит для дезинфекции питьевой воды. [23]
Как известно, фторид серебра , в отличие от хлорида серебра; растворим в воде. Следовательно, осадок, образовавшийся в результате взаимодействия нитрата серебра с хлоридом и фторидом натрия, содержит только одну соль — хлорид серебра. [24]
В этой лаборатории фторид серебра и тетрахлорэти-лен кипятили в колбе с обратным холодильником в течение нескольких часов при атмосферном давлении, причем не наблюдалось образования какого-либо газа. Точно так же 150 г безводного фторида серебра, приготовленного, как описано Муассаном [13], и 50 г С2С14 нагревали в небольшой закрытой стальной бомбе при 155 в течение 7 час. Эксперимент был повторен при 240 в течение 3 5 час. [25]
Известно, что фторид серебра содержит 91 9 % Ag. Какой вид имеет его простейшая формула. [26]
Известны два других фторида серебра — субфторид и ди-фторид. Субфторид Ag2p получают электролитическим восстановлением62 2 8 раствора фтористого серебра и фтористого аммония в 40 % — ной плавиковой кислоте при 50 С. Этот фторид образует зеленовато-желтые пластинки с металлическим отливом. Соединение диамагнитно219 и в твердом виде обнаруживает металлическую электропроводность220; есть указание, что его структура относится к типу йодистого кадмия221 222, однако необходимо повторное исследование. [27]
Неорганика: нерастворимые в кислотах соли | Химия ЕГЭ УМСКУЛ
Очень высокая растворимость фторидов серебра и одновалентного таллия должна способствовать устойчивости растворов ацидофторокомплексов этих катионов. [28]
Наиболее важные реакции фторида серебра основаны на легкости, с которой он теряет фтор. При нагревании, например, с иодом или серой он образует пентафторид иода или низшие фториды серы. Кремний и бор также легко реагируют с ним, а водород восстанавливает его при температуре красного каления до металлического серебра.
Так же реагируют с фторидом одновалентного серебра галогенные соединения неметаллов. Они могут быть получены также при растворении AgF — 2H20 в спирте, насыщенном аммиаком. Интересны также две нижеследующие реакции: образование комплекса AgF — AgJ — 2H20, структура которого неизвестна [78], и образование соединения AgBrF4 при растворении фторида в трифториде брома с последующим удалением избытка последнего выпариванием. Аналогичные соединения образуются также и фторидом калия. [29]
Известны два других фторида серебра — субфторид и ди-фторнд. Субфторид AggF получают электролитическим восстановлением62 2 8 раствора фтористого серебра и фтористого аммония в 40 % — ной плавиковой кислоте при 50 С. Этот фторид образует зеленовато-желтые пластинки с металлическим отливом. Соединение диамагнитно219 и в твердом виде обнаруживает металлическую электропроводность220; есть указание, что его структура относится к типу йодистого кадмия221 — 222, однако необходимо повторное исследование. [30]
Источник: www.ngpedia.ru
Соединения галогенов

В данном видеофрагменте рассматриваются такие соединения галогенов, как галогеноводороды и соответствующие им кислоты. Подробно и наглядно демонстрируются их физические и химические свойства, способы их получения. Кроме этого, описаны все качественные реакции на хлорид, бромид, йодид и фторид-ионы.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет.
Получите невероятные возможности

1. Откройте доступ ко всем видеоурокам комплекта.

2. Раздавайте видеоуроки в личные кабинеты ученикам.

3. Смотрите статистику просмотра видеоуроков учениками.
Получить доступ
Конспект урока «Соединения галогенов»
Соединения галогенов
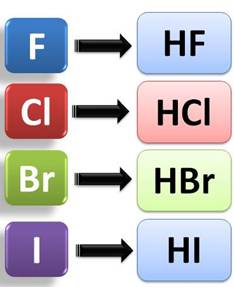
Среди соединений галогенов следует выделить галогеноводороды. Само название говорит о том, что в состав этих соединений входят атомы водорода и галогена.
Галогеноводороды представляют собой бесцветные газы, с резким запахом, они токсичны, очень хорошо растворяются в воде с образование соответствующих кислот.
Если растворить хлороводород в воде с лакмусом, то лакмус изменит свою окраску с фиолетовой на красную.

Галогеноводороды дымятся во влажном воздухе, потому что притягивают к себе водяные пары, находящиеся в воздухе, образуя, при это, туманное облако.
Растворы галогеноводородов в воде являются кислотами. Так, HF – фтороводородная, или плавиковая кислота, HCl – хлороводородная, или соляная кислота, HBr – бромоводородная кислота, а HI – йодоводородная кислота.
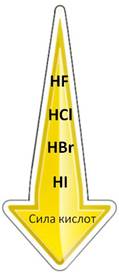
В ряду от плавиковой до йодоводородной кислоты сила кислот увеличивается, так как увеличивается их способность к электролитической диссоциации с образованием ионов водорода. Самая слабая из этих кислот плавиковая, а самая сильная – йодоводородная. В HF расстояние между ядрами атомов маленькое, радиус атома фтора тоже, поэтому прочность связи высокая, поэтому и способность к диссоциации небольшая, а у HI радиусы атомов большие, расстояние между ядрами атомов тоже, поэтому эта кислота легко диссоциирует на ионы.
Наибольшее значение имеет хлороводород и соляная кислота. В промышленности хлороводород получают синтезом водорода и хлора.
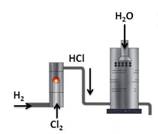
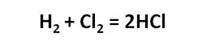
А в лаборатории хлороводород получают действием концентрированной серной кислоты на кристаллический хлорид натрия.

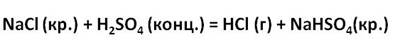
Соляная кислота – это бесцветная жидкость, дымящаяся на воздухе. Тяжелее воды. В химических реакциях она проявляет свойства типичных кислот.
Соляная кислота реагирует с металлами, стоящими в ряду напряжений металлов до водорода. В реакции соляной кислоты с цинком образуется соль – хлорид цинка и газ – водород.
Это окислительно-восстановительная реакция, в которой атом цинка повышает свою степень окисления с 0 до +2, поэтому цинк – восстановитель, водород понижает свою степень окисления с +1 до 0, поэтому водород – окислитель.
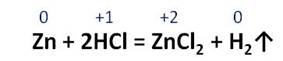
Соляная кислота взаимодействует с основными оксидами. Так, в реакции оксида магния с соляной кислотой образуется соль – хлорид магния и вода.
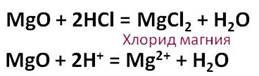
Соляная кислота реагирует с основаниями. В этих реакциях образуется соль и вода.
В результате взаимодействия гидроксида натрия с соляной кислотой образуется соль – хлорид натрия и вода.
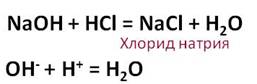
Соляная кислота реагирует с солями слабых кислот. Так в реакции соляной кислоты с карбонатом кальция образуется новая соль – хлорид кальция и слабая кислота – угольная, которая распадается на углекислый газ и воду.
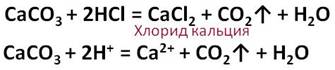
Соляная кислота имеет большое значение. Её применяют для очистки поверхности металлов, при паянии, получении солей, в производстве пластмасс и других синтетических материалов, в получении лекарственных препаратов и красок.

Галогеноводородные кислоты образуют соли: фториды, хлориды, бромиды и йодиды. Хлориды, бромиды и йодиды многих металлов хорошо растворимы в воде. Для определения в растворе хлорид-, бромид- и йодид-ионов используют нитрат серебра. В результате взаимодействия иона серебра и хлорид-иона выпадает белый творожистый осадок хлорида серебра.

В результате взаимодействия иона серебра с бромид-ионом образуется осадок светло-жёлтого цвета.

В реакции иона серебра с йодид-ионом образуется осадок жёлтого цвета.

Для распознавания фторид-иона используют ионы кальция, потому что фторид серебра – это растворимая в воде соль. В результате этой реакции выпадает осадок – фторид кальция – белого цвета.

Плавиковая кислота обладает уникальным свойством: при взаимодействии с оксидом кремния (IV), который входит в состав стекла, она плавит его.
SiO2 + 4HF = SiF4↑ + 2H2O
Эту реакцию используют для изготовления надписей и рисунков на стекле. На стекло наносят тонкий слой парафина, по которому процарапывают рисунок, а затем изделие погружают в раствор плавиковой кислоты. Некоторые художники это свойство используют при написании своих картин.






Галогены в природе существуют только в связанном виде. Наиболее распространены хлор и фтор. Важнейшее природное соединение хлора – галит – NaCl. Кроме галита, встречается и природный хлорид калия – KCl. Он входит в состав минерала сильвина и сильвинита.


Фтор входит в состав природного минерала – флюорита или плавикового шпата – CaF2.

Бром и йод своих минералов не образуют, они сконцентрированы в водах океанов и морей, в водорослях.
Источник: videouroki.net