1. Выберите два высказывания, в которых говорится о галлии как о химическом элементе.
1) Галлий похож на графит тем, что оставляет след на бумаге.
2) Содержание галлия в земной коре составляет 1,5 . 10–3 % по массе.
3) Галлий остаётся жидкостью в большом интервале температур от 30 до 2230 °С, причём летучесть его паров минимальна.
4) Искусственный изотоп галлия 72Ga (с периодом полураспада 14,2 часа) применяется для диагностики рака костей.
5) Способность галлия хорошо смачивать твёрдые поверхности используют в диффузионных вакуумных насосах.
Первое задание традиционно связано с умением отличать химический элемент от простого вещества. Тут нужно понять вот что: простое вещество обладает химическими и физическими свойствами, а химический элемент — это отдельно взятый атом. Даже если вы никогда не встречали галлия в учебнике и не знаете, как пишется его химический знак, вы сможете точно сказать, что отдельно взятый атом галлия не может быть похожим на графит, не может быть жидкостью и не смачивает твёрдые поверхности. Поэтому выбираем ответы 2 и 4.
ТОП лайфхаков на ОГЭ по химии | Умскул
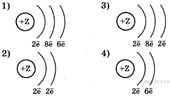
2. На приведённом рисунке изображена модель атома химического элемента. Запишите в таблицу величину заряда ядра (Х) атома химического элемента, модель которого изображена на рисунке, и номер группы (Y), в которой этот элемент расположен в Периодической системе. (Самой картинки, к сожалению, нету.)
С этим заданием обычно ученики легко справляются, достаточно один раз объяснить смысл циферок в клеточке элемента. Заряд ядра равен количеству протонов в ядре и количеству электронов в атоме. А номер группы — это количество электронов на внешнем электронном слое.
3. Расположите химические элементы
1) мышьяк 2) бром 3) кальций
в порядке увеличения их электроотрицательности.
Запишите номера элементов в соответствующем порядке.
Мои ученики знают, как часто я обращаюсь к понятию электроотрицательности, ведь зная, что это такое, можно объяснить всё. Или почти всё. Поэтому располагаем: кальций, мышьяк, бром.
4. Установите соответствие между формулой соединения и степенью окисления хрома в этом соединении: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) Cr2O3; Б) Na2СrO4; В) K2Cr2O7
1) +3; 2) +6; 3) –6; 4) –3
Со степенью окисления тоже обычно не возникает проблем. Даже если никогда не видел формулы бихромата калия, можно сделать расчёт, причём несколькими способами. Поэтому выбираем по порядку: +3, +6, +6.
5. Из предложенного перечня выберите два вещества с ковалентной полярной связью.
1) CaCl2; 2) SiH4; 3) Al; 4) CH3Cl; 5) K2O
Пятое задание иногда бывает коварным, но не в этот раз. Конечно, №2 и №4.
1 задание: химический элемент и простое вещество | Химия ОГЭ
6. Какие два утверждения верны для характеристики как фтора, так и иода?
1) Соответствующее простое вещество существует в виде двухатомных молекул.
2) Химический элемент не образует летучие водородные соединения.
3) Электроны в атоме расположены на двух электронных слоях.
4) Формула высшего оксида R2O5.
5) Одинаковое количество электронов во внешнем электронном слое.
Для того, чтобы правильно сравнить два элемента, нужно их найти в таблице Д.И.Менделеева. Как правило, это задание у моих учеников проблем не вызывает. Точно выбираем №1 и №5.
7. Из предложенного перечня веществ выберите щёлочь и среднюю соль.
1) КОН; 2) Zn(OH)2; 3) Al2(SO4)3; 4) Н2O2; 5) NaHCO3
На этот раз 7-е задание — без затей. Конечно №1 и №3.
8. Какие два вещества из предложенного перечня вступают в реакцию с оксидом лития?
1) H2SO4; 2) CаO; 3) Н2О; 4) O2; 5) КOH
Для того, чтобы справиться с 8-м заданием, нужно чётко знать, какой характер имеет оксид лития. Правильно, это типичный основный оксид щелочного металла. Поэтому отметаем заведомо неподходящие варианты и отвечаем: №1 и №3.
9. Установите соответствие между реагирующими веществами и продуктами(-ом) их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Тут, к сожалению, в источнике я не нашла вариантов ответов, обозначенных цифрами. Понятно, что задание требует знания логических связей неорганической химии. Для А) — должна образоваться кислая соль сернистой кислоты, если взят только 1 моль КОН и средняя соль, если взято 2 моль КОН; Б) — классическая реакция образования серной кислоты; В) — гидросульфат или сульфат калия в зависимости от того, сколько моль КОН взято для реакции.
10. Установите соответствие между формулой вещества и реагентами, с которыми это вещество может вступать в реакцию: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) Ca; Б) SiO2; В) Ba(OH)2
1) водород, аргон; 2) кислород, серная кислота; 3) оксид калия, карбонат натрия; 4) сульфат натрия, хлорид кальция
Задание на знание химических свойств, на мой взгляд, одно из самых, так сказать ценных из всего теста. Подумав, выбираем: А=2, Б=3, В=4.
11. Из предложенного перечня выберите вещества, с которыми оксид меди(II) вступает в реакцию замещения.
1) водород; 2) кислород; 3) алюминий; 4) соляная кислота; 5) углекислый газ
Реакция замещения для оксида меди — это способ восстановить медь до металлического состояния. В предложенном перечне есть два кандидата — восстановителя — водород и алюминий. Алюмотермия — это известный способ восстанавливать металлы, поэтому выбираем №1 и №3.
12. Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА: А) Zn и NaOH(изб.); Б) H2SO4 и Na2SO3; В) BaI2 и AgNO3
ПРИЗНАК РЕАКЦИИ: 1) выделение газа без запаха; 2) выделение газа с неприятным запахом; 3) выпадение белого осадка; 4) выпадение жёлтого осадка
Чтобы справиться с этим заданием, нужно написать уравнения всех реакций и тогда ответы будут неизбежно правильными. Здесь: А=1, Б=2, В=4.
Zn + 2 NaOH + 2 H2O → Na2[Zn(OH)4] + H2
H2SO4 + Na2SO3 = Na2SO4 + SO2 + H2O
BaI2 + AgNO3 = Ba(NO3)2 + AgI2
13. При полной диссоциации 1 моль каких двух из представленных веществ образуется 2 моль катионов?
1) хлорид кальция; 2) нитрат алюминия; 3) сульфат натрия; 4) карбонат аммония; 5) фосфат калия
14. Выберите два вещества, взаимодействие которых описывается сокращённым ионным уравнением. Zn2+ + S2– = ZnS↓
1) Zn(OH)2; 2) ZnSO4; 3) Zn; 4) (NH4)2S; 5) H2S; 6) Ag2S
15. Установите соответствие между схемой процесса и названием процесса, происходящего в окислительно-восстановительной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Это очень простое задание. А и Б — восстановление, В — окисление.
16. Из перечисленных суждений о способах разделения смесей выберите верное(-ые) суждение(-я).
1) Отделить от сахара примесь речного песка можно растворением, последующим фильтрованием смеси и выпариванием.
2) Хлорид калия можно выделить из водного раствора выпариванием.
3) Медные опилки из смеси можно выделить магнитом.
4) Две несмешивающиеся жидкости можно разделить с помощью делительной воронки.
Задание на простые приёмы лабораторных работ, которые были изучены ещё в 8-м классе. Конечно, 1, 2 и 4.
17. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Вещества: А) ZnSO4 и ZnCl2; Б) Na2SO4 и Na2SO3; В) K3PO4 и KCl
Реактивы: 1) NaOH; 2) KNO3; 3) HCl; 4) Ba(NO3)2
На мой взгляд, 17-е задание — самое трудоёмкое из всего теста. Чтобы с ним разобраться, надо владеть Таблицей растворимости, знать признаки протекания реакций и, возможно, перебирать варианты. Тут важна насмотренность и количество написанных на бумаге химических реакций. Для этого задания А=4, Б=3, В=4. И предлагаю вам самим проработать задание и понять, почему.
18. Аммошенит ((NH4)2SO4⋅MgSO4⋅6H2O) – двойная соль сульфата аммония и сульфата магния. Используется как азотно-магниевое удобрение. Вычислите в процентах массовую долю магния в аммошените. Запишите число с точностью до сотых.
В расчётах примите Ar(Mg) = 24.
19. Внесение магниевых удобрений повышает урожайность зерновых культур, улучшает их качество. Под озимые зерновые культуры, в почву вносится 4 г магния на 1 м2 . Для подкормки участка потребовалось 12 кг аммошенита, других удобрений не применялось. Вычислите площадь участка в м2 . Запишите число с точностью до целых.
18-я и 19-я задачи логично решаются вместе. И если первая — из самого начала 8-го класса, то над второй, возможно, придётся подумать.
Надеюсь, все помнят, как найти массовую долю элемента в соединении? И да, кристаллизационную воду тоже считаем:
w(Mg) = 1*Ar(Mg) *100% / Mr((NH4)2SO4⋅MgSO4⋅6H2O) = 6,67%
Рассчитаем, сколько граммов магния содержится в 12 кг аммошенита: m(Mg) = 0,0667 * 12000 г = 800 г. А далее простое рассуждение и простая пропорция: если 4 г соответствуют 1 м2, то 800 г соответствуют 200 м2. Вот и всё.
20. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой HNO3 + H2S → H2SO4 + NO2 + H2O Определите окислитель и восстановитель.
Задание несложное, но надо его правильно оформить. Сначала расставим степени окисления всех элементов, посмотрим, какие элементы меняют свои степени окисления. Азот, в степени окисления +5 — высшей — является типичным окислителем, восстанавливается до степени окисления +4. Сера, в степени окисления -2 — низшей — является типичным восстановителем, окисляется до степени окисления +6. Уравнения электронного баланса дадут нам необходимые коэффициенты:
8 HNO3 + H2S → H2SO4 + 8 NO2 + 4 H2O
Обратите внимание в этом задании, как правильно указатель окислитель и восстановитель: N^+5 (HNO3) — окислитель; S^-2 (H2S) — восстановитель.
21. Дана схема превращений: ZnO → ZnCl2 → X → Na2[Zn(OH)4] Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращенное ионное уравнение реакции.
Цепочка на знание амфотерности.
ZnO + 2HCl → ZnCl2 + H2O
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl и Zn^2+ + 2 OH ^- = Zn(OH)2
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
22. Через раствор гидроксида натрия пропустили 4,48 л сернистого газа (н. у.). Образовалось 126 г раствора сульфита натрия. Вычислите массовую долю соли в полученном растворе.
Запишем уравнение реакции: 2NaOH + SO2 = Na2SO3 + H2O
Найдём количество вещества сернистого газа: 4,48л / 22,4л = 0,2 моль.
Говорим волшебные слова: По уравнению видим: 1 моль SO2 соответствует 1 моль Na2SO3, значит, 0,2 моль SO2 соответствует 0,2 моль Na2SO3.
Масса Na2SO3, образовавшегося в результате реакции = 0,2 моль * 126 г/моль = 25,2 г.
Массовая доля Na2SO3 в растворе = 25,2 г/ 126 г = 0,2 или 20%.
23. Дан раствор сульфата меди(II), а также набор следующих реактивов: оксид кремния, медь, железо, соляная кислота, раствор гидроксида калия. Используя только реактивы из приведённого перечня, запишите молекулярные уравнения двух реакций, которые характеризуют химические свойства сульфата меди(II), и укажите признаки их протекания (наличие / отсутствие запах у газа, цвет осадка или раствора).
Задача сводится к тому, чтобы доказать химические свойства сульфата меди — раствора ярко-голубого цвета. Взаимодействие здесь возможно с железом (вспоминаем ряд активности металлов) и с гидроксидом калия, при этом получится красивый голубой осадок, согласно Таблице растворимости.
CuSO4 + Fe = FeSO4 + Cu Видим, как раствор перестаёт быть голубым и становится зеленоватым, а восстановленная медь оседает в пространстве пробирки.
CuSO4 + 2KOH = K2SO4 + Cu(OH)2 Наблюдаем, как ярко-голубая окраска раствора исчезает, а на дно пробирки опускается голубой осадок нерастворимого гидроксида меди.
Осталось только провести эти эксперименты практически, выполняя 24-е задание.
24. Проведите химические реакции между сульфатом меди(II) и выбранными веществами в соответствии с составленными уравнениями реакции, соблюдая правила техники безопасности, приведённые в инструкции к заданию. Проверьте, правильно ли указаны в ответе на задание 23 признаки протекания реакций. При необходимости дополните ответ или скорректируйте его.
Источник: dzen.ru
Галлий как химический элемент таблицы Менделеева
Г Галлий является химическим элементом таблицы Менделеева с атомным номером 31 и условным обозначением Ga. Галлий представляет собой мягкий хрупкий металл серебристо-белого цвета с синеватым оттенком.
- Как был открыт Галлий;
- Где и как добывают Галлий;
- Распространенность Галлия;
- Применение Галлия;
- Интересные факты
Как был открыт Галлий

История такого химического элемента как галлий очень занимательна. Русский ученый и химик Дмитрий Иванович Менделеев в 1871 году при составлении своей элементарной таблицы предсказал наличие нового химического элемента. Он предсказал его атомную массу и некоторые свойства, и назвал его эко-алюминий. Дмитрий Иванович предсказал, что этот элемент будет обнаружен с помощью спектроскопа. Не обнаруженный на тот момент эко-алюминий не должен реагировать с воздухом и будет медленно растворяться в кислотах.
В 1875 году французский химик Поль Эмиль Лекок Буасбаудран с помощью спектроскопии открыл новый химический элемент при изучении сфалерита. Название Галлий ему было дано в честь Родины первооткрывателя. Отделил чистый элемент так же Лекок методом электролиза водного раствора гидроксида калия.
Где и как добывают Галлий

Мировое производство галлия составляет ежегодно порядка 300 тонн. Он является побочным продуктом при переработке руд других металлов, поэтому объем его добычи зависит именно от них. Основным источником при добыче галлия является боксит(руда для получения алюминия), но в гораздо меньших количествах его можно получить из сфалерита(руда для получения цинка). При переработке бокситов галлий накапливается в растворе гидроксида натрия. Из этого раствора можно извлечь элемент множеством способов.
Самый последний метод извлечения заключается в использовании ионообменной смолы. Конечная эффективность добычи зависит от того сколько галлия присутствовало в бокситной руде. Если концентрация составляла стандартное значение 50 частей на миллион, то извлечь возможно только 7.5 частей. Количество, которое можно извлечь обычно составляет около 15%.
После этого методом двойного электролиза получают очищенный элемент. После первого электролиза чистота элемента получается порядка 80%.Чистота галлия после второго электролиза при использовании этого метода составяет 99.997%. Правда на выходе чистого элемента получается гораздо меньше. Из добытых 300 тонн галлия на выходе чистого элемента получается всего 180 тонн.
Распространенность Галлия

Распространенность галлия является понятием относительным. Во Вселенной этот элемент пока не оценен, потому что это сделать пока непредставляется возможным. На нашей планете он является довольно редким элементом. В земной коре его присутствие оценивается в 19 частей на миллион. Его распространенность сопоставима с литием и свинцом.
Ученые оценивают мировые запасы галлия в 1.6 миллионов тонн. В свободном виде этот химический элемент в природе не встречается или пока он просто не был обнаружен. Сегодня его принято добывать из алюминиевых, цинковых и германиевых руд в качестве побочного продукта. Содержание галлия в этих рудах обычно очень низкое.
Применение Галлия
Применение галлия из-за его редкости является не очень широким, но его востребованность растет с каждым годом. Его применение затрагивает в той или инной степени разные сферы деятельности. Самыми важными из них является электроника, медицина, военная и ядерная промышленность.

В силу своих свойств 98% применения галлия составляют полупроводниковые элементы. Для этих нужд используется высокочистый галлий(чистота 99,999%) в соединении с другими элементами и сплавами. Самыми коммерчески важными соединениями являются арсенид, антимонид, фосфид и нитрид галлия. Чтобы было понятно, арсенид галлия представляет собой соединение с мышьяком. Антимонид в свою очередь является соединением галлия с сурьмой.
Среди вышеперечисленных материалов арсенид галлия является вторым по распространенности полупроводниковым материалом после кремния. Если брать в сравнение с кремнием арсенид галлия по некоторым свойствам значительно превосходит его. Этот материал обладает более высокой пропускной способностью. Это позволяет найти ему более широкое применение в электросфере.
Например, в мобильных электронных устройствах радиоприемные антенны изготавливаются именно из арсенида галлия, которые обеспечивают прием интернета и телефонной связи. Спрос на него с каждым годом только увеличивается с появлением технологий передачи данных 4G и 5G, за счет которого они и развиваются. Другие сплавы так же находят применение в печатных платах электронных устройств, в устройствах чтения компакт-дисков, светодиодах(испускают синий цвет) и многом другом.
В военной промышленности так же галлий находит свое применение в радиоэлектронных устройствах. В пример можно поставить исполнительные элементы связи со спутниками и марсоходами.
Так же этот элемент является компонентом исполнительных элементов солнечных батарей в качестве замены кремнию. В медицине галлий используется в медицинских термометрах(сплав галлия, олова и индия), так как использовать ртуть запретили. Радиоизотоп галлия-67 используется для обнаружения очагов воспаления таких болезней как туберкулез, остеомиелит, пневмонии и другого рода инфекции и опухолей(в том числе и раковых). В ядерной промышленности этот элемент используется в составе сплава теплообменников в ядерных реакторах.
Интересные факты

Интересных фактов связанных с галлием из-за его редкости не так уж и много, но все же они есть. Стоит начать с самого открытия. Дело в том, что Поль Эмиль Лекок Буасбаудран назвал этот элемент галлий в честь своей Родины, но на тот момент было альтернативное предположение. Научный мир предположил, что Лекок назвал этот элемент в честь себя.
Это заявление было обосновано тем, что слово «петух» на французском выглядит как «Le coq» и на латыни пишется «Gallus». В статье 1877 года французский химик опроверг это предположение.
Еще одним интересным моментом является то, что металлический галлий является сам по себе не токсичным веществом. В принципе, как и роль его в организме в качестве микроэлемента тоже пока не выяснена. Внешне он очень напоминает алюминий в твердом состоянии, но его температура плавления составляет всего 29°C. В связи с этим его свойством у химиков существует своего рода шутка.
Суть ее заключается в том, чтобы вылепить из галлия чайную ложку, заварить горячий чай своему товарищу и поместить туда эту ложку. Интересной становится реакция объекта шутки, когда металлическая ложка начинает растворяться в горячем чае при помешивании.
Источник: biobloger.ru
Галлий как химический элемент огэ

Картинками
ОГЭ-2020, вариант 1
1. Выберите два высказывания, в которых говорится о галлии как о химическом элементе:
1) Галлий — мягкий хрупкий металл серебристо-белого цвета с синеватым оттенком
2) Существование галлия было научно предсказано Д. И. Менделеевым
3) Чистый галлий плавится на руке человека
4) Галлием заполняют термометры (вместо ртути) для измерения высоких температур
5) В состав полупроводниковых материалов часто входит галлий
Запишите в поле ответа номера выбранных высказываний.