Все словари русского языка: Толковый словарь, Словарь синонимов, Словарь антонимов, Энциклопедический словарь, Академический словарь, Словарь существительных, Поговорки, Словарь русского арго, Орфографический словарь, Словарь ударений, Трудности произношения и ударения, Формы слов, Синонимы, Тезаурус русской деловой лексики, Морфемно-орфографический словарь, Этимология, Этимологический словарь, Грамматический словарь, Идеография, Пословицы и поговорки, Этимологический словарь русского языка.
Уважаемый пользователь, сайт развивается и существует только на доходы от рекламы — пожалуйста, отключите блокировщик рекламы.
металлы для чеканки монет
Энциклопедия Кольера
ПОДГРУППА IB. МЕТАЛЛЫ ДЛЯ ЧЕКАНКИ МОНЕТ МЕДЬ, СЕРЕБРО, ЗОЛОТО
Как упоминалось в общем разделе о переходных элементах, металлы IB и IIB подгрупп имеют заполненный 10 d-электронами предпоследний, (n 1)-й слой. В этом случае нет полного согласия с представлением о том, что у переходных элементов d-оболочка находится в стадии заполнения.
Выращивание кристаллов галогенидов серебра
Считается, что отличительный электрон в элементах каждого из этих семейств находится на внешней s-орбитали, но на основании химических и физических свойств эти элементы относят к переходным металлам. Действительно, в подгруппе IB внутренние d-электроны обладают такой энергией, что по крайней мере два из них могли бы находиться на внешних слоях.
Они достаточно подвижны для участия в образовании химической связи и не относятся к классической ситуации электронов на заполненной d-оболочке. Следует отметить, что d-электроны элементов подгруппы IIB не участвуют в образовании химической связи в соединениях.
Все элементы подгруппы IB имеют в электронной конфигурации ns1 электрон, который определяет их общие свойства и общую степень окисления I. Медь и серебро проявляют также степень окисления II, хотя Ag2+ легко переходит в состояние Ag+, что делает его прекрасным окислителем. Золото, в отличие от Cu и Ag, не имеет степени окисления II, а наиболее стабильной степенью его окисления является III. Cu и Ag могут проявлять степень окисления III в жестких условиях под действием сильнейших окислителей. Степени окисления выше III для этих металлов не характерны, хотя вероятны.
Свойства. Серебро имеет более низкие температуры плавления и кипения, легче испаряется, чем медь и золото (см. табл. 17а). Это означает, что металлические связи между атомами серебра слабее. Заполненная целиком 4f-оболочка золота создает полностью завершенный 32 электронами 4-й уровень, что приводит к высокой плотности и малому радиусу его атома.
Подвижность внешнего электрона у элементов очевидна, так как они обладают высокой электропроводимостью, причем серебро наивысшей. У меди и серебра потенциалы ионизации почти в два раза больше, чем у металлов подгруппы IA, что указывает на относительную инертность Cu и Ag. Еще алхимики назвали эти металлы «благородными», чтобы отличать их от всех «неблагородных», проявляющих высокую реакционную способность, например Pb и Sn. Все три металла Cu, Ag, Au обладают высокой пластичностью, но особенно отличается золото. Из золота можно изготовить фольгу толщиной около 0,00001 см, а из 1 г золота вытянуть проволоку длиной до 3000 м.
Гальваника золочение 585 пробой меди, латуни, серебра
Применение. Благородные металлы традиционно использовались для чеканки монет (см. табл. 17б). Но в настоящее время золото не используется в монетных сплавах оно служит всеобщим эквивалентом, в котором выражается стоимость всех других товаров.
Серебро и золото широко применяются в ювелирном деле, а все три металла используются для изготовления украшений, декоративных столовых изделий и др. Применение золота зависит от его чистоты; чистоту можно определять в величинах пробы (чистое золото 1000 единиц пробы) или в каратах (чистое золото имеет 24 карата). Высокая коррозионная стойкость, устойчивость к окислению, а также красивый внешний вид делают металлы этой группы весьма ценными для различного декоративного применения. Благодаря высокой отражательной способности серебро используют при изготовлении зеркал, особенно в области видимого и инфракрасного излучения, а алюминий более выгоден для рефлекторов, работающих в ультрафиолете. Серебряный припой (сплав Ag-Pb) применяют в пайке меди с медью, а также в производстве ламп накаливания.
Месторождения и металлургия. Металлы для приготовления монет мало распространены и, хотя встречаются в свободном состоянии, сильно рассеяны. Уникальный агломерат элементной меди массой более 3 т имеется в выставочном отделе Смитсоновского института. Все металлы подгруппы IB с древних времен получают термическим разложением оксидов или сульфидов.
Природные ресурсы свободных металлов в сколько-нибудь значимых отложениях близки к истощению. Сегодня экономичны только крупномасштабные разработки месторождений. Золото имеет очень высокую плотность, благодаря чему его отмывают от более легкой породы и в результате золото остается на дне промывного желоба.
Более привлекательны методы, в которых большие объемы золотоносных шламов промывают мощными потоками воды в специальных каналах. Для обработки отходов также имеется несколько технологий. Шламы пропускают над медно-ртутной поверхностью, в результате золото образует со ртутью амальгаму. Ртуть из амальгамы извлекают цианированием. В присутствии кислорода цианид натрия образует с золотом растворимый в воде комплексный ион [[Au(CN)2]], из которого золото вытесняют цинком:
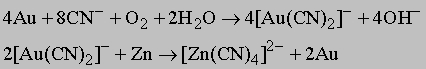
Такие же методы применимы для получения серебра. Другой метод извлечения золота заключается в обработке его хлором с образованием растворимого в воде AuCl3 с последующим выщелачиванием золота из раствора.
Серебро. Серебро получают в основном из технологических отходов производства меди и свинца. Серебро отделяют от свинца, используя хорошую растворимость Ag в цинке и плохую растворимость цинка в расплаве свинца. Небольшое количество цинка добавляют к серебросодержащему свинцу, Ag растворяется в Zn и поднимается на поверхность расплава, с которой его снимают.
Затем цинк из серебра отгоняют. Остатки свинца в осадочном серебре удаляют окислением. Окончательной процедурой получения серебра является электролиз или электрорафинирование.
Медь. Из этой подгруппы медь является наиболее нужным в промышленности металлом. Электрические провода, трубы, емкости для химической промышленности в больших количествах изготавливают из меди. Руды сегодня содержат 1% меди, поэтому приходится перерабатывать многие тонны руды. Переработку медных сульфидных руд.
Кроме меди высокой чистоты, в промышленности применяются разнообразные медные сплавы. Некоторые из них приведены в табл. 17б. Другие сплавы обсуждались ранее, такие, как медь-бериллий, из которых изготавливают неискрящий инструмент; сплавы с марганцем, используемые для изготовления коррозионностойких материалов для пропеллерных мешалок.
Оксиды. При прямом синтезе с кислородом медь и серебро образуют Cu2O, CuO и Ag2O. Оксид CuO можно получить также из ионов Cu(II) и OHпри осторожной низкотемпературной дегидратации (для предотвращения образования Cu2O). Оксид меди(I) Cu2O при растворении в минеральных кислотах (HCl или H2SO4) образует соли меди (II), а не меди(I), из-за реакции диспропорционирования Cu(I) в растворе:
2Cu+ -> Cu0 + Cu2+ Аналогично ведет себя и Au(I): 3Au+ -> 2Au0 + Au3+
Состояние Cu(I) сохраняется в растворе только при образовании комплексного иона. Оксиды Cu2O и Ag2O должны, казалось бы, проявлять сходные свойства, но в действительности они различаются. Cu2O термически неустойчив и разлагается на кислород и Cu0. Простые соли серебра легко образуются из Ag2O, но из Cu2O невозможно получить соли Cu(I). Оксиды Au(I) и Au(III) стабильны.
Вот некоторые заключения о необычных состояниях окисления металлов подгруппы: 1) Металлическая медь легче образует Cu2+, чем Cu+, поэтому из Cu0 невозможно получить Cu+, так как получается Cu2+. 2) Металлическое серебро легче образует Ag+, чем Ag2+. 3) Au легче образует Au3+, чем Au+. 4) Переходы Cu+ (r) Cu3+ и Ag0 (r) Ag3+ возможны только под действием сильных окислителей.
Поэтому медь и серебро в виде простых ионов Cu3+ и Ag3+ в растворе не существуют. 5) Au3+ как окислитель существенно хуже, чем Cu3+ и Ag3+. 6) Ag+ весьма стабильный ион в растворе, тогда как Cu+ и Au+ в растворе самопроизвольно диспропорционируют.
Амфотерность. CuO и Cu(OH)2 проявляют слабую амфотерность и в сильнощелочной среде образуют [[Cu(OH)4]]2. Металлическая медь в присутствии кислорода растворяется в концентрированном растворе аммиака, образуя комплексное соединение [[Cu(NH3)4]](OH)2, которое обладает редким свойством оно способно растворять соединения целлюлозы и хлопок. Au2O3 амфотерное соединение, в реакции со щелочью образует NaAuO2. Ag2O практически полностью основной оксид.
Галогениды. Галогениды металлов подгруппы IB проявляют более предсказуемые свойства, чем оксиды. Известны галогениды Cu(I) (CuF, CuCl, CuBr и CuI, но CuF в растворе диспропорционирует на CuF2 и Cu0). CuF получают по реакции обмена CuCl с HF или прокаливанием CuF2 в атмосфере HF при 1000° С. Эти галогениды имеют белый цвет, что соответствует иону Cu с полностью завершенной (n 1)d-оболочкой.
Для Cu(II) известны все галогениды, кроме CuI2, который диспропорционирует до CuI и I2. Окраска CuF2, CuCl2 и CuBr2 белая, желто-коричневая и черная соответственно. Все галогениды меди(I) и меди(II) в избытке галогена или HX образуют растворимые комплексные соединения с ионами CuI32, CuCl2, CuCl32, CuCl42. Серебро со всеми галогенами образует нерастворимые в воде моногалогениды AgF, AgCl, AgBr и AgI.
Существует определенная взаимосвязь между усилением окраски, уменьшением растворимости и уменьшением ионного характера связи в этих галогенидах. Несколько неожиданно, что твердый AgF имеет желтоватую окраску, а раствор Ag+F бесцветен. AgCl, AgBr и AgI окрашены в белый, кремовый и чисто желтый цвета соответственно.
AgBr благодаря своей светочувствительности широко используется в фотографии (в производстве пленки и фотобумаги). Микрокристаллические частицы AgBr на поверхности пленки или фотобумаги на свету сенсибилизируются в большей или меньшей степени в зависимости от количества света, засветившего пленку.
Затем на пленку действуют органическим восстановителем, и при этом экспонированные частицы AgBr превращаются в металл Ag. Непрореагировавшие частицы AgBr удаляются при закреплении изображения с помощью тиосульфата натрия Na2S2O3 (гипосульфит), который образует стабильный и растворимый комплексный ион [[Ag(S2O3)2]]3, отмываемый из пленки.
Высушенная пленка является негативом с темным изображением на местах сильной экспозиции. Позитив получают, просвечивая пленку, лежащую на фотобумаге, покрытой аналогичным химическим составом. После проявления и закрепления наиболее светлые места на фотобумаге соответствуют максимальной яркости при экспозиции. В определенных единичных тонах (как сепия) возможно применение сульфидов для превращения Ag в Ag2S и замена серебра на платиновые металлы.
Благодаря сильному окислительному действию фтора серебро образует соединения с высокой степенью окисления AgF2 и AgF3. Под действием фтора хлориды переходят во фториды. В избытке галогенид-ионов, как и в случае меди, образуются комплексные ионы Ag(I). Например, из AgF или AgCl образуются AgF2и AgCl2.
Известны также соединения, которые очень сходны с галогенидами; их даже называют псевдогалогенидами, например цианид серебра AgCN, тиоцианат серебра AgSCN, азид серебра AgN3. У золота наиболее устойчивый галогенид AuF3, однако в избытке HF он гидролизуется до Au(OH)3. Это не слишком необычно для такого высокозарядного иона с большой плотностью.
AuCl3 в соответствии со своим строением является димером Au2Cl6. При восстановлении AuCl3 или HAuCl4 водородом или SnCl2 образуется вещество глубокого пурпурового цвета, возможно, мелкодисперсная смесь Au + SnO2. Среди множества других известны комплексные ионы золота (псевдогалогениды) состава [[Au(CN)4]] и [[Au(SCN)4]]. Органические вещества, имеющие донорную электронную пару, также образуют различные комплексы с Au(III). Золото образует некоторые 6-координационные ковалентные ионы, например AuF63, но более распространены тетраковалентные ионы типа AuX4.
Амминокомплексы. Аммиак в водном растворе NH3*H2O образует с ионом серебра и рядом нерастворимых солей растворимые амминокомплексы; аналогичные реакции идут с медью:
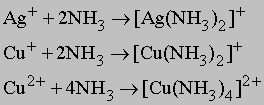
И только наиболее нерастворимые соли серебра (AgI и Ag2S) не образуют амминокомплексов. Серебро легко выделяется из комплексов в виде зеркального покрытия на стекле под действием слабых органических восстановителей. Растворы аммиачных комплексов серебра очень неустойчивы, образуют Ag3N и Ag2NH, которые взрываются без видимых причин (сотрясения или удара).
Сульфиды. Сульфиды рассматриваемых металлов мало похожи на оксиды. Медь образует CuS и Cu2S (последнее соединение не является стехиометрическим). CuS вследствие очень низкой растворимости выпадает в осадок при добавлении H2S даже из кислых растворов. Сульфид Cu(I) образуется из CuS при избытке H2S или термической диссоциации CuS.
В серусодержащей атмосфере на поверхности серебра образуется темный или черный осадок сульфида серебра. Такой налет на столовой посуде удаляется с трудом с помощью комплексообразования серебра или электрохимическим вытеснением из AgS. AuS не существует, а сульфид Au(III) осаждается из растворов комплексов Au(III) и растворяется в Na2S с образованием NaAuS2.
Другие соединения. Упомянем некоторые соединения подгруппы IB. Широко известен пентагидрат сульфата меди(II) CuSO4*5H2O (медный купорос), используемый как фунгицид вместе с арсенитом меди CuHAsO3 и ацетатом меди Cu(CH3COO)2. При прокаливании кристаллогидрата сульфата меди происходит ступенчатая дегидратация и образуется безводный сульфат белого цвета, а при термической обработке большинства других солей получаются основные соли, например, из CuCl2*5H2O получается CuCl2*Cu(OH)2.
Соли меди(III) можно синтезировать только с помощью сильных окислителей, например, из CuO и KO2 образуется KCuO2; Na9[[Cu(TeO6)2]] получается при электролитическом окислении в щелочной среде; известны также K3[[CuF6]] и K7[[Cu(IO6)2]]. Оксид серебра Ag2O2 (или AgIAgIIIO2) имеет промышленное значение для изготовления электродов в серебряно-цинковых элементах и аккумуляторах. Серебро проявляет степень окисления III в AgF3 и некоторых комплексных соединениях, в которых органические лиганды стабилизируют высокую степень окисления серебра.
Источник: sanstv.ru
Галогенид меди или серебра
Лекция 15. Элементы 11 группы. Часть 2
Лекция из курса:
Поделиться:
Лекция 15. Элементы 11 группы. Часть 2
1 / Загрузка
Скачать конспект лекции
Предыдущая лекция

Лекция 14. Элементы 11 группы. Часть 1
Следующая лекция

Лекция 16. Элементы 12 группы
Электроды с кристаллическими мембранами
Кристаллические гомогенные мембраны изготавливают из индивидуального кристаллического соединения (LaF3, Ag2S) или гомогенной смеси кристаллических веществ (Ag2S+AgCl, Ag2S+CuS). Если мембрана состоит только из одного кристаллического вещества, то она может быть либо монокристаллом либо изготовлена прессованием или спеканием многих мелких кристаллов в виде поликристаллического диска.
Так мембрану хлорид- и бромид-селективных электродов изготавливают из монокристаллов (хлорида или бромида серебра) или поликристаллических смешанных таблеток. Такие мембранные электроды называются гомогенными. При изготовлении гетерогенных кристаллических мембран электродно-активное вещество смешивают с инертной матрицей (силиконовая смола, эпоксидные смолы, поливинилхлорид) или наносят гидрофобизованный графит. В качестве ионочувствительного активного вещества используются различные малорастворимые соединения, такие, как, сульфат бария, оксалат кальция и др. Электрическая проводимость этих мембран обусловлена способностью иона решетки с наименьшим радиусом и зарядом перемещаться по вакансиям решетки.
Для кристаллических мембран характерна высокая специфичность, обусловленная тем, что размер, форма и распределение заряда вакансии решетки позволяют занять это место только определенному подвижному иону. Низкая растворимость материала мембраны позволяет достигать очень низких пределов обнаружения. Состав наиболее распространенных кристаллических мембран приведен в таблице 1.
Состав наиболее распространенных кристаллических мембран
| Определяемый ион | Состав мембраны |
| F — | LaF3 |
| Cl — | AgCl или AgCl+Ag2S |
| Br — | AgBr или AgBr+Ag2S |
| I — | AgI или AgI+Ag2S |
| SCN — | AgSCN+Ag2S |
| S 2- | Ag2S |
| Ag + | Ag2S |
| Cu 2+ | Cu1,8Se или CuS+Ag2S |
| Pb 2+ | PbS+Ag2S |
| Cd 2+ | CdS+Ag2S |
Практическое значение имеет ионселективный электрод с мембраной из сульфида серебра, пригодный для измерения концентрации (активности) и Ag + — и S 2- -ионов. Сульфид серебра является превосходным электродно-активным веществом и обладает малой растворимостью (Ks~10 -51 ), высокой устойчивостью к окислителям и восстановителям, низким электрическим сопротивлением.
Мембрану можно изготовить из прессованного кристаллического сульфида серебра или из пластинки монокристалла. Подвижными в мембране из сульфида серебра являются ионы серебра. Серебро этим электродом может быть определено в интервале от 1 до 10 -7 М, а в некоторых условиях и до 10 -12 М и ниже. В столь же низких концентрациях могут быть определены и сульфид-ионы.
На основе мембраны их сульфида серебра конструируются также различные галогенидные и металлочувствительные электроды. Для этого в сульфид серебра вводят галогениды серебра или сульфиды меди, свинца, кадмия и некоторых других металлов.
Электроды на основе сульфида серебра с добавкой соответствующего галогенида серебра чувствительны к ионам Cl — , Br — , I — , CN — и др. Введение в сульфид серебра сульфидов других металлов позволяет получить электрод, чувствительный к ионам металла, внесенного со вторым сульфидом (Cd 2+ , Pb 2+ , Cu 2+ и др.).
Используются также электроды на основе сульфида или селенида меди, чувствительные к ионам меди.
Электроды, выпускаемые промышленностью на основе кристаллических мембран, состоят из пластмассового корпуса (поливинилхлорид, тефлон и др.), в конец которого вклеен или плотно вставлен в оправу монокристалл или прессованная мембрана. Пластмассовый корпус заполняется раствором, содержащим ион, на который данный электрод реагирует. И наконец, в эту трубку погружают электрод сравнения; раствор, заполняющий трубку, следовательно, должен содержать также ион, на который реагирует электрод сравнения.
Характерная особенность всех кристаллических мембран заключается в том, что электрический ток переносится через них только ионами. Ионами-переносчиками заряда могут служить ионы только определенного размера, такого, на который реагирует сам электрод, например, ионы серебра, меди и т.д. такой реакцией обладают все ионселективные электроды. Ее называют первичной реакцией.
Электроды могут обладать также и вторичной реакцией, когда они реагируют на противоион труднорастворимого соединения кристалла мембраны. Например, электрод с электродно-активной фазой из сульфида серебра можно использовать для определения концентрации (активности) ионов серебра в растворах солей серебра и сульфид-ионов в сульфидных растворах. Подобными свойствами обладают хлорид-, бромид-, иодид-, тиоцианат-селективные электроды, имеющие первичную реакцию на ионы серебра.
Нижний предел чувствительности электрода определяется произведениями растворимости входящих в состав мембраны соединений.
В таблице 2 приведены значения оптимального интервала рН раствора и области концентрации ионов, определяемых при помощи ионселективных электродов с кристаллическими мембранами.
Характеристики ионселективных электродов с гомогенными
| Определяемый ион | Интервал измерения, pC | Оптимальный интервал рН раствора | Мешающие ионы | Применение |
| Cl — | 0-4,3 | 2-11 | S 2- , I — , Br — , CN — | Анализ пищевых продуктов, фарм. препаратов, мыл, пластиков, стекла, вод |
| Br — | 0-5,3 | 2-12 | S 2- , I — , CN — | Титрование эпоксигрупп HBr |
| I — | 0-7,3 | 3-12 | S 2- , CN — | — |
| F — | 0-6 | 5-8 | OH — | Анализ вод, электролитических ванн, зубных паст, тканей, зубов и костей |
| SCN — | 0-5 | 2-12 | I — , Cl — , сильные восстановители | — |
| CN — | 0-6 | 11-13 | S 2- , I — | Анализ промышленных стоков, электролитических ванн, определение амигдалина |
| Cu 2+ | 0-8 | 3-7 | S 2- , Ag + , Hg 2+ , Cl — , Br -, Fe 3+ | Анализ электролитических ванн, вод, пищевых продуктов, сточных вод, рудных концентратов, фунгицидов |
| Cd 2+ | 1-7 | 3-7 | Fe 3+ , Pb 2+ , Ag + , Hg 2+ , Cu 2+ | Анализ вод, промышленных отходов, электролитических ванн, бумаги и пигментов |
| Pb 2+ | 1-7 | 4-7 | Cd 2+ , Ag + , Hg 2+ , Cu 2+ , Fe 3+ | Анализ нефтяных продуктов, пищевых продуктов, загрязнений, воздуха, определение Pb с ЭДТА и SO4 2- раствором Pb 2+ |
| S 2- | 0-17 | 13-14 | нет | Анализ промышленных отходов, продуктов бумажной и целлюлозной промышленности |
| Ag + | 0-17 | 2-9 | Hg 2+ | Титрование смеси галогенидов или цианидов раствором Ag + |
F — -селективный электрод
Наиболее совершенным ионселективным электродом с кристаллической мембраной является фторид-селективный (фторидный) электрод, изображенный на рисунке 4.
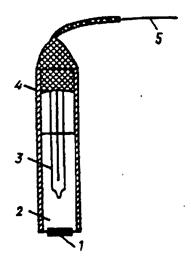
Рис. 4. Фторид-селективный электрод:
1 – пластинка из LaF3, 2 – утренний стандартный раствор NaF+NaCl, 3 – внутренний электрод сравнения, 4 – изоляция, 5 – токоотвод
Мембрана его изготовлена из пластинки монокристалла фторида лантана, имеющего чисто фторидную проводимость и активированного для увеличения дефектов решетки (понижения электрического сопротивления) фторидом двухзарядного катиона (бария, европия). Монокристалл имеет гексагональную решетку, состоящую из слоев фторида лантана, окруженных фторид-ионами, пять из которых находятся в непосредственной близости. В такого рода решетке фторид-ионы отличаются высокой подвижностью.
Перенос заряда в таком монокристалле происходит за счет дефектов кристаллической решетки:
LaF3 + Вакансия (дырка) → LaF2 + + F —
Чувствительность фторид-селективного электрода позволяет проводить измерения равновесной концентрации фторид-ионов в широкой области концентраций – от 10 -6 до 1 М. В этой области отклонений от уравнения Нернста не наблюдается. Селективность электрода очень высока – даже тысячекратный избыток посторонних ионов (галогенид-, нитрат-, сульфат-ионов и др.) по сравнению с фторид-ионами не мешает определению последних и только в присутствии гирокисид-ионов селективность падает (ОН — -ион является мешающим). Работа фторид-селективного электрода ухудшается также в присутствии лигандов, образующих с ионами La 3+ прочные координационные соединения в растворе (цитрат-, оксалат-ионы и др.). Существенно мешают определению активности фторид-ионов только катионы, образующие комплексные соединения с фторид-ионами – Al 3+ , Fe 3+ , Ce 4+ , Li + , Th 4+ . При определении концентрации (активности) фторид-ионов в присутствии таких ионов, как Al 3+ и Fe 3+ необходимо в раствор добавлять комплексообразующий реагент R, который в свою очередь образует еще более устойчивые комплексы с данными катионами металлов по реакции вытеснения, при этом выделяются фторид-ионы, которые можно измерить при помощи электрода, например:
AlF6 3- + R 3- ↔ AlR + 6F —
Подходящими комплексообразующими реагентами являются цитраты, ЭДТА, ЦГДА и др.
Вполне понятно также, что с увеличением кислотности среды равновесная концентрация фторид-ионов в растворе уменьшается за счет образования молекул HF, на которые электрод не дает отклика (электродный потенциал при этом возрастает и становится более положительным):
H + + 3F — ↔ HF + 2F — ↔ HF2 — + F — ↔ HF3 2-
Таким образом, показания фторидного электрода в кислой области будут существенно зависеть от рН. В щелочной области на поверхности электрода может образоваться осадок La(OH)3, что также вызовет искажение показаний электрода (потенциал электрода при этом уменьшается и становится более отрицательным):
LaF3 + 3OH — ↔ La(OH)3 + 3F —
Точные границы рН, в которых показания фторидного электрода от рН зависят несущественно, привести трудно, так как с уменьшением концентрации фторид-ионов эта область также уменьшается. Для растворов с концентрацией фторид-ионов n·10 -4 М и более этот интервал охватывает область значений рН примерно от 4-5 до 8-9, чего можно добиться при помощи ацетатного буферного раствора.
Зависимость потенциала фторид-селективного электрода от рН раствора иллюстрирует рисунок 5.
Рис. 5. Зависимость потенциала фторид-селективного электрода от рН раствора
Фторидный электрод используется для определения фторид-ионов в питьевой и морских водах, различных биологических пробах, витаминах, молоке, при контроле за загрязнением окружающей среды, в пищевых продуктах и т.д. Он широко применяется также для исследования процессов образования фторидных комплексов в растворе и других реакций с участием фторид-ионов.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru