Нитрат серебра — это неорганическое соединение с химической формулой AgNO. 3. Эта соль является универсальным предшественником многих других соединений серебра, таких как те, которые используются в фотографии. Он гораздо менее чувствителен к свету, чем галогениды. Когда-то его называли лунной каустикой, потому что древние алхимики называли серебро луной, которые связывали серебро с луной.
В твердом серебре нитрат ионы серебра имеют трех- координацию. в тригональной плоскости.
Discovery
Albertus Magnus в XIII веке документально подтвердил способность азотной кислоты разделять золото и серебро путем растворения серебра. Магнус отметил, что полученный раствор нитрата серебра может почернить кожу.
Синтез
Нитрат серебра можно получить реакцией серебра, такого как серебряный слиток или серебряная фольга, с азотной кислотой, в результате чего получают нитрат серебра, воду и оксиды азота. Побочные продукты реакции зависят от концентрации используемой азотной кислоты.
Как проверить изделие из СЕРЕБРА без специалиста! Лайфхак!
3 Ag + 4 HNO 3 (холодный и разбавленный) → 3 AgNO 3 + 2 H 2 O + NO Ag + 2 HNO 3 (горячий и концентрированный) → AgNO 3 + H 2 O + NO2
Это выполняется под вытяжным шкафом из-за токсичности в ходе реакции выделялись оксиды азота.
Типичная реакция с нитратом серебра заключается в суспендировании стержня меди в растворе нитрата серебра и оставлении его на некоторое время. несколько часов. Нитрат серебра реагирует с медью с образованием волосовидных кристаллов металлического серебра и голубого раствора нитрата меди :
2 AgNO 3 + Cu → Cu (NO 3)2+ 2 Ag
Нитрат серебра разлагается при нагревании:
2 AgNO 3 (л) → 2 Ag (т) + O2 (г) + 2 NO2 (г)
Качественно разложение незначительно ниже точки плавления, но становится заметным около 250 ° C и полностью разлагается при 440 ° C.
Большинство нитратов металлов термически разлагаются до соответствующих оксидов, но оксид серебра разлагается при более низкой температуре, чем нитрат серебра, поэтому при разложении нитрата серебра вместо него образуется элементарное серебро.
Используется
предшественник других соединений серебра
Нитрат серебра — наименее дорогая соль серебра; он предлагает ряд других преимуществ. Он не гигроскопичен, в отличие от фторбората серебра и перхлората серебра . Он относительно устойчив к свету. Наконец, он растворяется в Растворители, включая воду. Нитрат может быть легко заменен другими лигандами, что делает AgNO 3 универсальным.
Обработка растворами галогенид-ионов дает осадок AgX (X = Cl, Br, I). При изготовлении фотопленки нитрат серебра обрабатывают галогенидами солями натрия или калия с образованием нерастворимого галогенида серебра in situ в фотографическом желатине, который затем наносят на полоски три- ацетата или полиэфира. Аналогичным образом, нитрат серебра используется для приготовления некоторых взрывчатых веществ на основе серебра, таких как фульминат, азид или ацетилид, посредством реакции осаждения.
100грамм ПРОВОЛОКИ с АМПЕРМЕТРА СТОИТ 164 ТЫС
Обработка нитрата серебра основанием дает темно-серый оксид серебра :
2 AgNO 3 + 2 NaOH → Ag 2 O + 2 NaNO 3 + H 2O
Отрыв галогенидов
Катион серебра Ag. быстро реагирует с источниками галогенидов с образованием нерастворимого галогенида серебра, который представляет собой кремовый осадок, если используется Br-, белый осадок, если Используется Cl. и желтый осадок, если используется I.. Эта реакция обычно используется в неорганической химии для получения абстрактных галогенидов:
Ag. (водн.) + X. (водн.) → AgX (s)
, где X. = Cl., Br. или I..
Другие соли серебра с некоординирующими анионами, а именно тетрафторборат серебра и гексафторфосфат серебра, используются для более требовательных применений..
Подобным образом эта реакция используется в аналитической химии для подтверждения присутствия хлорида, бромида или йодида ионы. Образцы обычно подкисляются разбавленной азотной кислотой для удаления мешающих ионов, например карбонат ионы и сульфидные ионы. Эта стадия позволяет избежать путаницы осаждений сульфида серебра или карбоната серебра с осадками галогенидов серебра. Цвет осадка варьируется в зависимости от галогенида: белый (хлорид серебра ), бледно-желтый / кремовый (бромид серебра ), желтый (йодид серебра ). AgBr и особенно AgI фоторазлагаются на металл, о чем свидетельствует сероватый цвет экспонированных образцов.
Ту же реакцию использовали на пароходах, чтобы определить, была ли питательная вода для котлов загрязнена морской водой. Он по-прежнему используется, чтобы определить, является ли влага на ранее сухих грузах результатом конденсации из влажного воздуха или утечки морской воды через корпус.
Органический синтез
Серебро нитрат используется во многих случаях в органическом синтезе, например для снятия защиты и окислений. Ag. обратимо связывает алкены, и нитрат серебра был использован для разделения смесей алкенов путем селективной абсорбции. Полученный аддукт можно разложить с помощью аммиака с выделением свободного алкена. Нитрат серебра хорошо растворим в воде, но плохо растворим в большинстве органических растворителей, за исключением ацетонитрила (111,8 г / 100 г, 25 ° C).
Биология
В гистология, нитрат серебра используется для окрашивания серебром, для демонстрации ретикулярных волокон, белков и нуклеиновых кислот. По этой причине он также используется для демонстрации белков в гелях PAGE. Его можно использовать в качестве красителя в сканирующей электронной микроскопии.
Медицина

Микрофотография, на которой видно нитрат серебра (коричневый), отмеченный хирургический край.
Соли серебра имеют антисептик свойства. В 1881 году Credé ввел использование разбавленных растворов AgNO 3 в новорожденных глазах при рождении, чтобы предотвратить заражение гонореей от мать, которая могла вызвать слепоту. (Вместо этого теперь используются современные антибиотики.)
Расплавленный нитрат серебра в форме палочек традиционно назывался «лунным каустиком». Его используют в качестве прижигающего агента, например, для удаления грануляционной ткани вокруг стомы. Генерал сэр Джеймс Эбботт отмечал в своих дневниках, что в Индии в 1827 году британский хирург вливал его в раны на руке, полученные в результате укуса бешеной собаки, чтобы прижечь раны и предотвратить начало бешенства.
Нитрат серебра используется для прижигания поверхностных кровеносных сосудов в носу, чтобы предотвратить кровотечение из носа.
Стоматологи иногда используют тампоны с нитратом серебра для лечения язв во рту. Некоторые ортопеды используют нитрат серебра для уничтожения клеток ногтевого ложа.
Канадский врач К.А. Дуглас Рингроуз исследовал использование нитрата серебра для процедур стерилизации, полагая, что нитрат серебра можно использовать для блокировки и разъедания маточных труб. Этот метод оказался неэффективным.
Дезинфекция
Было проведено много исследований по оценке способности иона серебра инактивировать Escherichia coli, микроорганизм, обычно используемый в качестве индикатора для фекальное загрязнение и как заменитель патогенов при очистке питьевой воды. Концентрации нитрата серебра, оцененные в экспериментах по инактивации, колеблются от 10 до 200 микрограммов на литр в пересчете на Ag. Противомикробная активность Сильвера нашла множество применений до открытия современных антибиотиков, когда она вышла из употребления. Его связь с аргирией заставила потребителей насторожиться и заставить их отвернуться от нее, когда им представилась альтернатива.
Против бородавок

Кожа, окрашенная нитратом серебра
Многократное ежедневное нанесение нитрата серебра может вызвать адекватное разрушение кожных бородавок, но иногда могут развиваться пигментные рубцы. В плацебо-контролируемом исследовании с участием 70 пациентов прием нитрата серебра в течение девяти дней привел к исчезновению всех бородавок у 43% и уменьшению количества бородавок у 26% через месяц после лечения по сравнению с 11% и 14%, соответственно, в группе плацебо..
Безопасность
Нитрат серебра как окислитель следует хранить вдали от органических соединений. Несмотря на его обычное использование в чрезвычайно низких концентрациях для предотвращения гонореи и контроля носовых кровотечений, нитрат серебра по-прежнему очень токсичен и вызывает коррозию.
Кратковременное воздействие не вызывает каких-либо немедленных побочных эффектов, кроме пурпурных, коричневых или черных пятен на коже, но при постоянном воздействии высоких концентраций будут заметны побочные эффекты, в том числе ожоги. Длительное воздействие может вызвать повреждение глаз. Нитрат серебра, как известно, вызывает раздражение кожи и глаз. Нитрат серебра не был тщательно исследован на предмет потенциального канцерогенного воздействия.
Нитрат серебра в настоящее время не регулируется в водных источниках Агентством по охране окружающей среды США. Однако, если в организме накапливается более 1 грамма серебра, может развиться состояние, называемое аргирия. Аргирия — это постоянное косметическое состояние, при котором кожа и внутренние органы приобретают сине-серый цвет.
Агентство по охране окружающей среды США устанавливало максимальный предел загрязнения воды серебром до 1990 года, когда было установлено, что аргирия не влияет на функцию каких-либо пораженных органов, несмотря на обесцвечивание. Аргирия чаще ассоциируется с потреблением растворов коллоидного серебра , чем с нитратом серебра, поскольку он используется только в очень низких концентрациях для дезинфекции воды. Тем не менее, все же важно соблюдать осторожность перед приемом любого раствора иона серебра.
Ссылки
Внешние ссылки
| На Викискладе есть материалы, связанные с нитратом серебра. |
- Международная карта химической безопасности 1116
- Карманный справочник NIOSH по химической опасности
- v
- t
Соли и ковалентные производные иона нитрата
| HNO 3 | He | ||||||||||||||||
| LiNO 3 | Be (NO 3)2 | B (NO. 3). 4 | RONO 2 | NO. 3. NH4NO3 | HOONO 2 | FNO 3 | Ne | ||||||||||
| NaNO 3 | Mg (NO 3)2 | Al (NO 3)3 | Si | P | S | ClONO 2 | Ar | ||||||||||
| KNO 3 | Ca (NO 3)2 | Sc (NO 3)3 | Ti (NO 3)4 | VO (NO 3)3 | Cr (NO 3)3 | Mn (NO 3)2 | . Fe (NO 3)3 | Co (NO 3)2. Co (NO 3)3 | Ni (NO 3)2 | CuNO 3. Cu (NO 3)2 | Zn (NO 3)2 | Ga (NO 3)3 | Ge | As | Se | Br | Kr |
| RbNO 3 | Sr (NO 3)2 | Y (NO 3)3 | Zr (NO 3)4 | Nb | Mo | Tc | Pd (NO 3)2. | AgNO 3. | Cd (NO 3)2 | In | Sn | Te | I | Xe (NO 3)2 | |||
| CsNO 3 | Ba (NO 3)2 | Hf | Ta | W | Re | Os | Ir | . | Hg2(NO 3)2. Hg (NO 3)2 | . Tl (NO 3)3 | Pb (NO 3)2 | Bi (NO 3)3. BiO (NO 3) | At | Rn | |||
| Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||
| Ce (NO 3)3. Ce (NO 3)4 | Nd (NO 3)3 | Eu (NO 3)3 | Gd (NO 3)3 | Tb (NO 3)3 | |||||||||||||
| Th (NO 3)4 | UO2(NO 3)2 | Bk | Cf | Es | Fm | Md | Нет | Lr |
Источник: alphapedia.ru
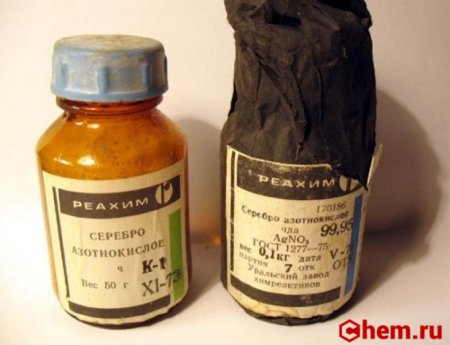
Серебро азотнокислое для чего применяют

Нитрат серебра (азотнокислое серебро, «адский камень», ляпис от итал. lapis «карандаш» /лат. lapis «камень») — неорганическое соединение, соль металла серебра и азотной кислоты с формулой AgNO3, бесцветные ромбические кристаллы, растворимые в воде. Не образует кристаллогидратов.
Получение
Нитрат серебра может быть получен растворением серебра в азотной кислоте по реакции:

Ag + 2 HNO3 ⟶ AgNO3 + NO2 ↑ + H2O
Физические свойства
Плотность — 4,352 г/см³. Температура плавления — 209,7 °C. При температуре выше 300 °C начинает разлагаться на серебро, кислород и оксид азота(IV), при 440 °C разлагается полностью. Хорошо растворим в воде, растворимость 222,5 г/100 г ; растворимость в метиловом спирте — 3,6 г/100 г ; в этиловом спирте — 2,12 г/100 г ; в ацетоне — 0,44 г/100 г ; в пиридине — 33,6 г/100 г , ацетонитриле (все растворимости — при 20 °C).
Нитрат серебра(I) обладает жгуче-кислым вкусом.
Химические свойства
Нитрат серебра является реактивом на соляную кислоту и соли соляной кислоты, поскольку взаимодействует с ними с образованием белого творожистого осадка хлорида серебра, нерастворимого в азотной кислоте:
HCl + AgNO3 ⟶ AgCl ↓ + HNO3 NaCl + AgNO3 ⟶ AgCl ↓ + NaNO3
Образует осадки с водными растворами бромидов, йодидов, фосфатов, тиоцианатов, цианидов, сульфидов.
При нагревании разлагается, выделяя металлическое серебро:
2 AgNO3 → 350∘C 2 Ag + 2 NO2 + O2 Реагирует с щелочью с образованием оксида: 2 AgNO3 + 2 NaOH ⟶ Ag2O + 2 NaNO3 + H2O в этаноле, при -50 градусах, образуется гидроксид серебра AgNO3 + NaOH → C2H5OH−50 AgOH ↓ + KNO3 ↓
Применение
Нитрат серебра применяется:
- в гальванотехнике как источник ионов серебра;
- в аналитической химии как реактив на хлориды;
- в фотографии как компонент проявителей, усилителей и других растворов;
- в медицине, как средство для прижигания кожи.
Использование в медицине


Нитрат серебра используется в медицине в виде сплава нитрата серебра и нитрата калия) иногда отлитый в виде палочек — ляписного карандаша для прижигания и стерилизации ран, удаления мелких бородавок.
Лечебное действие нитрата серебра заключается в подавлении жизнедеятельности микроорганизмов, в небольших концентрациях он действует как прижигающее, противовоспалительное и вяжущее средство, а концентрированные растворы, как и кристаллы AgNO3, прижигают живые ткани.
Впервые ляпис (адский камень) применили врачи Ян-Баптист ван Гельмонт и Франциск де ла Бое Сильвий, которые научились получать нитрат серебра взаимодействием металла с азотной кислотой. Они обнаружили, что прикосновение к кристаллам полученного вещества приводит к появлению на коже чёрных пятен, а при длительном контакте — глубоких ожогов.

Токсичность
Нитрат серебра ядовит. Минимальная смертельная доза ЛД50 для собак — 20 мг/кг, для кроликов — 800 мг/кг. Класс опасности — 2.
Коррозионно-активен, при контакте с кожей может вызывать химические ожоги. Оставляет на коже чёрные пятна.
Нитрат Серебра
Химическое название
Химические свойства
Вещество также называют ляпис, азотнокислое серебро, «адский камень». Химическое соединение из неорганической химии, соль, образованная металлом и азотной кислотой. Молярная масса соединения = 169,9 грамм на моль. По своим физическим свойствам – это прозрачные бесцветные кристаллы, в форме мелких палочек и пластинок.
Хорошо растворяется в воде и этиловом спирте. Вещество темнеет на свету, имеет жгуче-кислый вкус. Формула Нитрата Серебра: AgNO3, совпадает с рацемической формулой. Начинает разлагаться при температуре выше 300 градусов Цельсия.
Химические свойства
Раствор Нитрата Серебра реагирует с соляной кислотой и солями соляной кислоты. Во время реакции образуется белый творожистый осадок хлорида Ag, который не растворим в азотной кислоте. При действии высоких температур начинается разложение Нитрата Серебра (примерно 350 градусов), при этом выделяется металл, кислород и NO2. При электролизе раствора азотнокислого серебра на катоде выделяется Ag, а на аноде — кислород. Таким образом вещество диссоциирует на ионы Ag+ и NO3–.
Соль активно применяется в медицине; при проявке пленочных фотографий; входит в состав ляписного карандаша в комбинации с нитратом калия; при получении диоксана, растворителей для смягчения химикатов. Вещество используют при производстве аккумуляторов, в криминалистике, текстильной промышленности.
Фармакологическое действие
Прижигающее, противовоспалительное, антисептическое, бактерицидное, противомикробное.
Фармакодинамика и фармакокинетика
Нитрат Серебра вызывает денатурацию белковых молекул, связывая карбоксильные и сульфгидрильные группы, изменяя конформацию молекулы. Бактерицидное действие вещества возникает во время диссоциации соединения на ионы. При взаимодействии средства с белками образуется альбуминат серебра имеющий черную окраску.
Вещество нарушает работу некоторых ферментных систем в микробных клетках. Лекарство обладает кратковременными бактерицидным и длительным бактериостатическим действием. Даже сильно разведенный раствор способен оказывает сильное бактерицидное действие.
При определенной концентрации ионов Ag вещество проявляется вяжущие и противовоспалительные свойства, так как преципитация происходит только в интерстициальных белках. При применении высоких концентраций лекарства, образуются рыхлые альбуминаты и значительно повреждаются клеточные мембраны и внутриклеточные структуры.
Показания к применению
Применение азотнокислого серебра:
Противопоказания
Побочные действия
Азотнокислое серебро может спровоцировать развитие аллергических реакций.
Нитрат Серебра, инструкция по применению (Способ и дозировка)
Применять наружно. Перед использованием следует проконсультироваться с врачом и четко соблюдать его рекомендации.
Передозировка
При длительном контакте вещества с кожей могут возникнуть глубокие ожоги.
Взаимодействие
Вещество разлагается при контакте с бромидами, хлоридами, йодидами и органикой.
Условия продажи
Может понадобиться рецепт.
Препараты, в которых содержится (Аналоги)
Азотнокислое серебро в сочетании с нитратом калия находится в Ляписном медицинском карандаше; входит в состав некоторых гомеопатических средств.
Отзывы
Отзывы о лекарственном средстве оставляют в основном при попытках избавиться от бородавок с помощью Ляписного карандаша:
- “… Использовала это средство в течение 2 месяцев на бородавке на руке. Сейчас она вроде сошла, только осталось маленькое красное пятнышко”;
- “… Мне карандаш не помог вообще. Что только не пробовала, пока не попала к врачу, и не удалила новообразование ультразвуком — все было напрасно”;
- “… Бородавки постепенно начали чернеть, эффект начал проявляться спустя несколько недель. После использования карандаша пока не появлялись более”.
Цена, где купить
Купить азотнокислое серебро удастся в интернет-магазине или аптечной сети. Купить Нитрат Серебра в аптеке в виде Медицинского Ляписного карандаша можно примерно за 120 рублей.

Образование: Окончила Ровенский государственный базовый медицинский колледж по специальности «Фармация». Окончила Винницкий государственный медицинский университет им. М.И.Пирогова и интернатуру на его базе.
Опыт работы: С 2003 по 2013 г. – работала на должностях провизора и заведующего аптечным киоском. Награждена грамотами и знаками отличия за многолетний и добросовестный труд. Статьи на медицинскую тематику публиковались в местных изданиях (газеты) и на различных Интернет-порталах.
Источник: ollimpia.ru
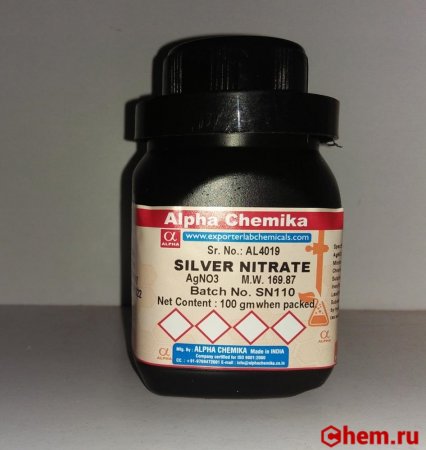
Серебро азотнокислое (нитрат серебра), ХЧ (арт. 170164)
Купить в розницу серебро азотнокислое (нитрат серебра) в нашем интернет-магазине могут физические и юридические лица. Минимальной суммы заказа нет.
Серебро азотнокислое (нитрат серебра) — неорганическое вещество, соль серебра и азотной кислоты.
Используется в качестве лабораторного реагента на галогениды, в гальванике, оптике и электронике, для химической металлизации
Пр-во: АО “ЛенРеактив”
Внешний вид: порошок белого цвета
Квалификация: ХЧ (химически чистое)
Массовая доля основного вещества: 99,9%
Гарантийный срок хранения: 2 года
Упаковка: банки темного стекла
Химическая формула: AgNO3
Меры предосторожности
Данное вещество – химический реактив, не предназначенный для употребления внутрь или наружного применения!
Не является лекарственным (фармацевтическим) препаратом. Не является БАД.
Хранить в местах, исключающих доступ детей!
Хранить в герметичной ёмкости.
Избегайте попадания данного вещества на кожу, в глаза, на слизистые оболочки!
При работе с данным веществом следует применять индивидуальные средства защиты, а также соблюдать правила личной гигиены.
Помещения, в которых проводятся работы, должны быть оборудованы общей приточно-вытяжной вентиляцией.
Похожие товары

Алюмокалиевые квасцы, ХЧ (арт. 013055) (Ленреактив, Россия)

Инсектоакарицидный порошок ФАС-СУПЕР, 10 гр. (арт. 700020) (Ленреактив, Россия)

Цилиндр мерный лабораторный 100 мл, полипропилен (арт. 991072) (Ленреактив, Россия)

Алюмокалиевые квасцы, ЧДА (арт. 010119) (Ленреактив, Россия)

Клей МОМЕНТ КРИСТАЛЛ водостойкий прозрачный, 30 мл (арт. 700027) (Ленреактив, Россия)

Клей моментальный КОНТАКТ CУПЕР-клей гель, 3 гр. (арт. 700023) (Ленреактив, Россия)

Ловушка-домик клеевая от тараканов и муравьев МАШЕНЬКА с приманкой (арт. 700030) (Ленреактив, Россия)

Приманка клеевая ФОРС-САЙТ, туба 135 гр. (арт. 700021) (Ленреактив, Россия)

Клей МОМЕНТ 88 особопрочный водостойкий универсальный, 30 мл (арт. 700024) (Ленреактив, Россия)

Стакан пластиковый лабораторный мерный, 500 мл (арт. 996743) (Ленреактив, Россия)

Натрий серноватистокислый 5-водный, ЧДА (арт. 130242) (Ленреактив, Россия)

Пропиленгликоль USP, имп (арт. 920070) (Ленреактив, Россия)

Олово двухлористое, имп. (арт. 143056) (Ленреактив, Россия)

Калий хлористый (хлорид калия) ЧДА (арт. 100244) (Ленреактив, Россия)

Медь сернокислая (II) 5-водная, ЧДА (арт. 120194) (Ленреактив, Россия)

Ловушки от тараканов NADZOR, упаковка — 6 шт. (арт. 700031) (Ленреактив, Россия)

Калий хлористый (хлорид калия) ХЧ (арт. 100245) (Ленреактив, Россия)

Стакан пластиковый лабораторный мерный, 1000 мл (арт. 998102) (Ленреактив, Россия)

Гидроксид натрия (натрий гидроокись, едкий натр, каустик, каустическая сода), гранулы, техн., (арт. 990850) (Ленреактив, Россия)

Лаурилсульфат натрия, Тайвань (арт. 533012) (Ленреактив, Россия)
Источник: lenreactiv-shop.ru