Соединения этого элемента разнообразны и многочисленны. Некоторые из них неустойчивы к действию света, что, как мы увидим, сыграло исключительно важную роль в развитии материальной культуры человечества.
Оксиды переходных металлов проявляют слабо основные свойства и непосредственно с водой не реагируют. Оксиды серебра не составляют исключение, но прочность гидроксида серебра настолько мала, что в обычных условиях AgOH вообще не существует. Удается обнаружить только следы его присутствия в воде, при взбалтывании порошка оксида Ag2O. Лишь при температуре — 50 °С при смешивании спиртовых растворов щелочи (КОН) и нитрата серебра получают белый осадок AgOH.
Серебро дает прочные соединения с галогенами: AgF, AgCl, AgBr, Agl.
Цвет их углубляется при переходе слеза направо в этом ряду. Фторид и хлорид — белые, бромид — желтоватый, а иодид отчетливо окрашен в желтый цвет. Это обстоятельство указывает на менее прочную связь электронов в бромиде и иодиде, чем в фториде и хлориде. Окраска указывает на поглощение света (видимой части спектра), т. е. на возможность перехода электронов соли на более высокие уровни.
Видимый свет несет небольшую энергию — большинство его квантов не способны поднять прочно связанные электроны на более высокий уровень во фториде и хлориде. Электроны в бромиде и иодиде размещены дальше от ядра (число электронных оболочек в атомах этих галогенов велико), уровни энергии их расположены теснее, и потому энергии кванта видимого света уже достаточно для переноса электрона на «возбужденный» уровень.
Часть падающего света поглощается и отраженный имеет «окраску» — вещество кажется нам желтым. При длительном действии света, особенно, конечно, его ультрафиолетовых лучей, все галогениды серебра разлагаются. Кратковременное действие оставляет «следы» в частицах галогенидов серебра, незаметные на глаз, но облегчающие действие восстановителей. На этом явлении основан фотографический процесс.
Растворимость фторида серебра довольно велика —особенно резко выражен контраст между растворимостью фторида и этим же свойством других галогенидов серебра. В литре воды при 20 °С можно растворить 15 моль фторида и лишь одну десятитысячную долю моля хлорида.
Растворимость бромида еще меньше (пять десятимиллионных долей моля), а растворимость иодида выражается уже миллиардными долями моля в литре. Заметим, что вообще свойства фтористых соединений своеобразны и резко отличаются от свойств соединений других галогенов. Эта особенность скорее характеризует индивидуальные черты фтора, чем серебра. Фторид серебра хорошо диссоциирует на ионы, чувствителен к ультрафиолетовым лучам и, выделяясь из водных растворов, образует кристаллогидраты с двумя и четырьмя молекулами воды на молекулу соли.
Интересно, что раствор фторида серебра реагирует с порошкообразным металлическим серебром при нагревании. В результате получается: AgF + Ag = Ag2F (субфторид серебра). Он представляет собой кристаллы (зеленоватого цвета), способные проводить электрический ток так же, как его проводят металлы, т. е. без разложения и за счет свободных электронов. Предполагают, что в кристаллах субфторида имеются группы, состоящие из одного иона фтора, зажатого между двумя ионами серебра: Ag + F — Ag + . Между этими группами в кристалле движутся свободные электроны. Каждая группа соответствует, как видно, одному электрону.
Из других галогенидов упомянем о иодиде AgI. Его кристаллическая структура очень похожа на структуру кристаллов льда. Поэтому на частицах иодида серебра легко образуются кристаллы льда из переохлажденного пара. На этой особенности основано использование иодида для ускорения выпадения дождя. Хлорид серебра можно получить обменной реакцией соли серебра и какого-либо хлорида другого металла:
Аналогично получаются и другие галогениды этого металла. К образованию соответствующих галогенидов ведет и прямое взаимодействие галогенов с серебром при нагревании:
Хлорид серебра может быть получен и другими путями. Например, в концентрированных растворах NaCl идет реакция:
В присутствии воздуха в результате этой реакции образуется хлорид серебра.
Из других солей серебра следует назвать нитрат — соль, которая хорошо растворима в воде и является обычным исходным веществом при изучении различных реакций ионов серебра. Нитрат серебра получается при взаимодействии азотной кислоты с металлическим серебром:
Эта реакция характерна для взаимодействий азотной кислоты с металлами переходного типа. Прежде всего проявляется сильно окислительное действие азотной кислоты. Можно схематически представить себе, что первым продуктом взаимодействия металла с кислотой будет оксид- в данном случае Ag2O.
Азотная кислота, отдав металлу часть кислорода, образует продукт восстановления кислоты — оксид азота (II). Во второй стадии реакции Оксид реагирует с кислотой, давая соль (нитрат) и воду. Этот процесс с точки зрения электронных представлений можно представить так. Атом серебра отдает электрон: 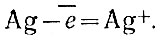
Атом азота, имеющий степень окисления +5 в азотной кислоте, присоединяет три электрона и приобретает степень окисления 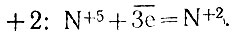 . Поэтому на один такой атом необходимо взять в реакции три атома серебра: получившиеся ионы серебра надо еще связать с тремя анионами МО3 — (ведь получается соль AgNO3). Поэтому всего в реакцию входят четыре молекулы кислоты, но лишь одна из них подвергается восстановлению электронами серебра.
. Поэтому на один такой атом необходимо взять в реакции три атома серебра: получившиеся ионы серебра надо еще связать с тремя анионами МО3 — (ведь получается соль AgNO3). Поэтому всего в реакцию входят четыре молекулы кислоты, но лишь одна из них подвергается восстановлению электронами серебра.
Источник: ollimpia.ru
Фторид серебра(II)
Фторид серебра(II) (дифторид серебра) — бинарное неорганическое соединение с химической формулой AgF2, тёмно-коричневые моноклинные кристаллы.
Получение
Получают фторированием серебра или хлорида серебра молекулярным фтором.
Свойства
Сильный окислитель. Окисляет воду. В жидком фтороводороде, в присутствии кислот Льюиса, переходит в катионную форму Ag 2+ , которая является очень сильным окислителем, превосходящим по активности фтор.
Применение
Применяется в синтезе фреонов, фторорганических соединений, в некоторых неорганических синтезах как сильный фторирующий агент.
Ссылки
Для улучшения этой статьи желательно:
- Найти и оформить в виде сносок ссылки на независимые авторитетные источники, подтверждающие написанное.
| HF DF |
||||||||||||||||
| LiF | BeF2 | BF3 | CF4 | N2F2 N2F4 NF3 NH4F |
O4F2 O2F2 OF2 |
F | ||||||||||
| NaF | MgF2 | AlF3 | SiF2 Si3F8 Si4F10 SiF4 |
PF3 PF5 |
S2F2 SF4 S2F10 SF6 |
ClF ClF3 ClF5 |
||||||||||
| KF | CaF2 | ScF3 | TiF2 TiF3 TiF4 |
VF2 VF3 VF4 VF5 |
CrF2 СrF3 СrF4 СrF5 |
MnF2 MnF3 MnF4 |
FeF2 FeF3 |
CoF2 CoF3 |
NiF2 NiF4 |
CuF CuF2 |
ZnF2 | GaF3 | GeF2 GeF4 |
AsF3 AsF5 |
SeF4 SeF6 |
BrF BrF3 BrF5 |
| RbF | SrF2 | YF3 | ZrF2 ZrF3 ZrF4 |
NbF3 NbF4 NbF5 |
MoF3 MoF5 MoF6 |
TcF5 TcF6 |
RuF3 RuF5 RuF6 |
RhF3 RhF4 RhF5 RhF6 |
PdF2 PdF3 PdF4 |
AgF AgF2 |
CdF2 | InF3 | SnF2 SnF4 |
SbF3 SbF5 |
TeF4 TeF6 |
IF IF3 IF5 IF7 |
| CsF | BaF2 | HfF4 | TaF5 | WF4 WF5 WF6 |
ReF4 ReF5 ReF6 ReF7 |
OsF4 OsF5 OsF6 OsF7 OsF8 |
IrF3 IrF4 IrF5 IrF6 |
PtF2 PtF4 PtF5 PtF6 |
Au4F8 AuF3 AuF5 AuF5·F2 |
Hg2F2 HgF2 |
TlF TlF3 |
PbF2 PbF4 |
BiF3 BiF5 |
Po | At | |
| Fr | RaF2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| LaF3 | CeF3 CeF4 |
PrF3 PrF4 |
NdF3 | Pm | SmF2 SmF3 |
EuF2 EuF3 |
GdF3 | Tb | DyF3 | HoF3 | Er | Tm | YbF2 YbF3 |
LuF3 | ||
| AcF3 | ThF4 | PaF4 PaF5 |
UF3 UF4 UF5 UF6 |
NpF3 NpF4 NpF5 NpF6 |
PuF3 PuF4 PuF6 |
Am | CmF3 | BkF4 | Cf | Es | Fm | Md | No | Lr |
Источник: xn--h1ajim.xn--p1ai
СЕРЕБРА ГАЛОГЕНИДЫ
Гемифторид Ag 2 F при нагр. выше 90°С и при растворении в воде разлагается с образованием AgF и Ag; диамагнитен; м. б. получен УФ облучением AgF. Фторид AgF гигроскопичен; хорошо раств. в воде (172 г в 100 г при 20 °С); в системе AgF-H 2 O т-ра эвтектики —14,2 °С (37,5% по массе AgF); до 18,6°С в равновесии с р-ром (62,9% по массе AgF) находится тетрагидрат AgF·4H 2 O ( 
 -1145,6 кДж/моль), до 39,5 °С (68,95% AgF)-дигидрат AgF·2H 2 O (
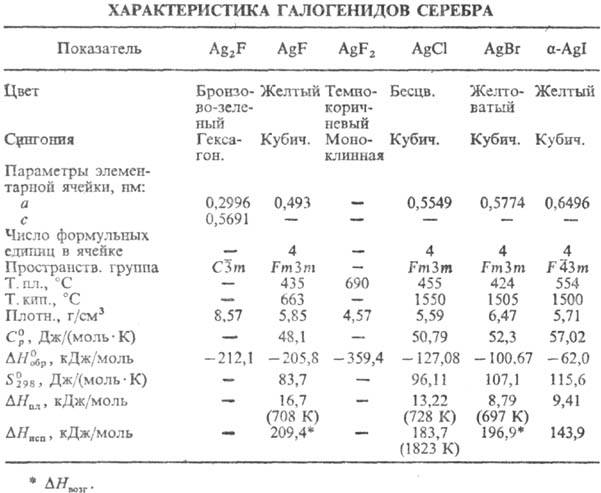
-1145,6 кДж/моль), до 39,5 °С (68,95% AgF)-дигидрат AgF·2H 2 O ( 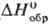 -801,6 кДж/моль,
-801,6 кДж/моль, 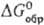 — 669,9 кДж/моль), выше 39,5 °С- безводная соль. Дифторид AgF 2 разлагается водой с образованием AgF, HF, О 2 и примеси О 3 .
— 669,9 кДж/моль), выше 39,5 °С- безводная соль. Дифторид AgF 2 разлагается водой с образованием AgF, HF, О 2 и примеси О 3 .
Хлорид (минерал хлораргирит, или кераргирит, роговое серебро) AgCl в газовой фазе находится в виде моно-, ди-и тримерных молекулу не раств. в воде (произведение р-ри-мости 1,8·10 -10 ), раств. в конц. H N О 3 .
Бромид (минерал бромаргирит) AgBr до 259 °С существует в кубич. кристаллич. модификации, выше 259 °С- в ромбич.; не раств. в воде (произведение р-римости 5,4 x x 10 -13 ).
Иодид (минерал иодаргирит) Agl существует в неск. кристаллич. модификациях: до 136°С устойчив a -Agl, в интервале 136 — 147 °С-гексагон. b -форма (а = 0,4596 нм, с = 0,7500 нм, z = 2, пространств. группа Р6 3 тс), выше 147 °С-кубич. g -модификация; не раств. в воде (произведение р-римости 8,5·10 -17 ), раств. в этаноле.
С еребра галогениды раств. в избытке соответствующих галогеноводород-ных к-т с образованием галогенидных комплексов, они также раств. в р-рах цианидов и тиосульфатов щелочных металлов и водном аммиаке с образованием комплексных ионов Ag. Серебра галогениды восстанавливаются до Ag неорг. (Pb, Zn, Mg, Н 2 ) и орг. (гидразин, формальдегид, гидрохинон и т.п.) восстановителями. Под действием света разлагаются с выделением Ag°; светочувствительность AgF больше, чем у AgCl.
С еребра галогениды получают взаимод. Ag с галогенами в присут. воды, а также обработкой Ag конц. водными р-рами галогеново-дородных к-т и обменным взаимод. между р-римой солью Ag и соответствующим галогенидом металла.
Для регенерации Ag из разл. отходов используется сплавление серебра галогенидов с карбонатами щелочных металлов. Серебра галогениды (AgCl, AgBr, AgI) используют для получения светочувствит. эмульсий в произ-ве кино- и фотоматериалов. Из AgCl изготовляют элементы оптики для ИК спектрометров, детекторы космич. излучений. AgBr-катализатор при получении нек-рых карбоновых к-т.
AgF, AgI и двойные иодиды щелочных металлов и Ag обладают высокой ионной проводимостью в твердом состоянии и применяются для изготовления твердых электролитов и датчиков. AgF используют также как компонент люминофоров и фторирующий агент в орг. синтезе, AgI-при гальванич. серебрении, для образования искуссю дождя и снега из грозовых туч. П. М. Чукуров.
Источник: xumuk.ru