По распространённости в земной коре алюминий находится на третьем месте после кислорода и кремния, а среди металлов — на первом.
В земной коре алюминий встречается только в составе соединений.
Основные природные минералы алюминия:
- боксит, состав которого можно примерно выразить формулой Al 2 O 3 ⋅ xH 2 O ⋅ SiO 2 ⋅ 2 H 2 O ,
- нефелин ( Na , K ) O ⋅ Al 2 O 3 ⋅ xH 2 O ⋅ 2 H 2 O 2 ,
- каолинит Al 2 O 3 ⋅ xH 2 O ⋅ SiO 2 ⋅ 2 H 2 O .
Каолинит — образец многочисленных алюмосиликатов , включающих преимущественно атомы кремния и кислорода, которые очень широко распространены в природе.
Физические свойства
В свободном состоянии алюминий — светлый блестящий металл, лёгкий , относительно мягкий, легкоплавкий, имеет высокую тепло- и электропроводность.
Алюминий является химически активным металлом, однако при обычных условиях он устойчив на воздухе и сохраняет свой металлический блеск длительное время. Это объясняется тем, что поверхность алюминия покрыта тонкой, невидимой глазу, прозрачной, но плотной плёнкой оксида алюминия, которая препятствует взаимодействию алюминия с компонентами атмосферы (парами воды и кислородом).
«Почему торий такой крутой»- Академия Сэма О’Нэллы (Озвучка Broccoli)
Свойства алюминия обусловили его широкое применение и необходимость получения алюминия в свободном виде.
В лабораторных условиях небольшое количество алюминия можно получить путём восстановления хлорида алюминия калием при высокой температуре:
Al Cl 3 + 3 K = t 3 KCl + Al .
Так был впервые получен алюминий.
В промышленных условиях алюминий получают из бокситов. При нагревании бокситов образуется оксид алюминия. Восстановить алюминий из оксида с помощью традиционных восстановителей практически невозможно, поэтому его получают методом электролиза .
Источник: www.yaklass.ru
Где находится алюминий в таблице менделеева
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Периодическая система химических элементов
Универсальная таблица растворимости
кислот, солей и оснований в воде
Коллекция таблиц к урокам по химии
Информационные и справочноинструктивные
- Главная

- для Ученика

- 9 класс

- Урок
Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия
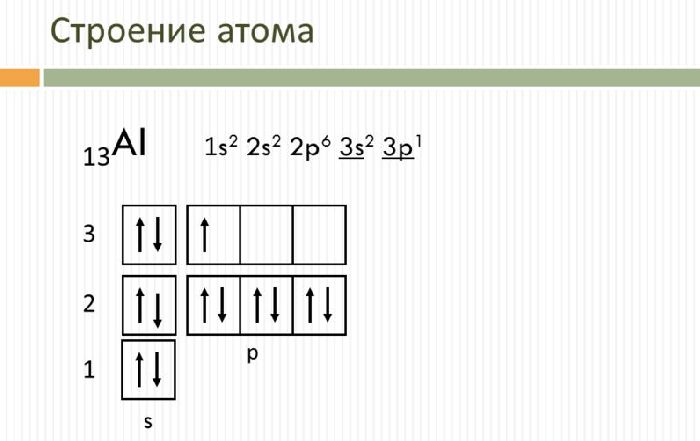
Строение атома алюминия

«Алюминий — Самый Крутой Бро»- Академия Сэма О’Нэллы (Озвучка Broccoli)
Алюминий (Al) – лёгкий металл, занимающий третье место по распространённости в земной коре среди химических элементов. Строение атома алюминия позволяет легко обрабатывать металл: он поддаётся литью, формовке, механическому воздействию.
Строение
Электронное строение атома элемента алюминия связано с его положением в периодической таблице Менделеева. Алюминий имеет 13 порядковый номер и находится в третьем периоде, в IIIa группе. Относительная атомная масса алюминия – 27. Электронная конфигурация атома алюминия – 1s 2 2s 2 2p 6 3s 2 3p 1 , модель распределения электронов – +13Al)2)8)3.
Атом элемента состоит из положительно заряженного ядра +13 (13 протонов и 14 нейронов) и трёх электронных оболочек с 13 электронами. На внешнем энергетическом уровне находится всего три электрона. В возбуждённом состоянии атом способен отдавать все три электрона, проявляя степень окисления +3, или образовывать три ковалентные связи. Поэтому алюминий имеет третью валентность.
В природе алюминий встречается только в составе соединений – глины, слюды, корунда. Металл ценился дороже золота до открытия промышленного способа его получения.
Свойства
Алюминий – серебристый металл, обладающий высокой электропроводностью и пластичностью. Элемент при комнатной температуре легко соединяется с кислородом, образуя на поверхности оксидную плёнку, защищающую металл от коррозии. Образование плёнки препятствует реакции с водой, концентрированными азотной и серной кислотами, поэтому алюминиевая тара подходит для перевозки этих кислот.

Для снятия оксидной плёнки используют соли аммония, горячие щёлочи, сплавы ртути. После разрушения оксидной плёнки алюминий вступает в реакцию со многими неметаллами и соединениями. Основные химические свойства элемента описаны в таблице.
Взаимодействие
Ход реакции
Пример
Только в условиях отсутствия оксидной плёнки. Образуется гидроксид алюминия
Образуется оксид алюминия
При комнатной температуре. С йодом – в присутствии катализатора
При температуре выше 200°С, образуется сульфид алюминия
При температуре 500°С, образуется фосфид алюминия
При температуре 800°С, образуется нитрид алюминия
При температуре 2000°С, образуется карбид алюминия
При комнатной температуре реагирует с разбавленными кислотами, при нагревании – с концентрированными. Образуются соли
Реагируют растворы и сплавы
2Al + Cr2O3 = 2Cr + Al2O3
Алюминий не взаимодействует с водородом.
Что мы узнали?
Атом алюминия включает 13 электронов. Схема строения алюминия – 1s 2 2s 2 2p 6 3s 2 3p 1 . На внешнем уровне находится три электрона, определяющие третью валентность элемента. Алюминий – лёгкий, плавкий металл, легко вступающий в реакцию с кислородом и образующий на поверхности оксидную плёнку. Благодаря плёнке металл не подвержен коррозии и не вступает в реакцию с концентрированными кислотами. При комнатной температуре алюминий реагирует с галогенами, при нагревании – с серой, фосфором, азотом, углеродом.
Источник: obrazovaka.ru