Один из первых полупроводниковых материалов, атомный номер 32.
— выпрямительные плоскостные диоды от 0.3 до 1000 А.
— транзисторы как мощные, так и маломощные.
— туннельные и СВЧ — диоды.
— варикапы (полупроводниковый диод с регулируемой емкостью).
— датчики Холла и другие магниточувствительные приборы.
Недостаток – рабочая температура не больше 60-70 0 С. Из-за этого вытесняется Si и GаAs.
Получение. Ge – рассеянный элемент, не имеет своих месторождений. Основные источники Ge – побочные продукты цинкового производства, коксования углей, концентраты из Cu-Pb-Zn-руд. Сырье хлорируют. Получают GeCl4 (жидкость с tкип=83 0 С), ее очищают экстракцией, ректификацией. Далее путем гидролиза переводят в GeO2:
Далее восстанавливают H2 в электрических печах при 650-700 0 С в графитовых тиглях: GeO2 + 2H2 = Ge + 2H2O
Восстановление совмещают с плавлением и кристаллизацией.
Поликристаллические слитки подвергают зонной плавке для получения Ge особой чистоты, либо выращивают легированные монокристаллы методом вытягивания из расплава.
Главный Секрет Молодости — Органический Германий (Сибирское Здоровье Полный Обзор)
Физико-химические и электрические свойства германия
Имеет металлический блеск, характеризуется твердостью и хрупкостью. Тпл = 936 0 С, d = 5.3 г/см 3 . Структура алмаза с периодом 5.66 , ширина запрещенной зоны при 300 К 0.665 эВ.
При комнатной температуре химически стоек. При температуре больше 650 0 С окисляется до GeO2. GeO2 заметно растворяется в воде, из-за чего не может служить защитой поверхности Ge (в отличии от SiO2). Кристаллический Ge при комнатной температуре не растворим в воде, соляной кислоте, разбавленной серной кислоте.
Растворяется в смеси HNO3+HF, смеси H2O2 и окислителей. При нагревании взаимодействует с галогенами и серой. До температуры плавления не взаимодействует с графитом и кварцем, поглощает H2 до .
Для температуры больше 200 К Прозрачен для излучения с > 1.8мкм.
В качестве доноров и акцепторов при легировании используют элементы V и III групп: As, Sb, Bi; Al, Ga, In. ионизации примесей 0.01 эВ. Элементы I,II,VI,VII,VIII групп создают более глубокие уровни в запрещенной зоне. В нормальных условиях концентрация носителей заряда в Ge определяется концентрацией примесей (уже для температуры больше 90 К).
Собственная электропроводность появляется при 50 0 С при концентрации примеси равной 8*10 19 м -3 и для 200 0 С при содержании 7*10 21 м -3 . Удельное сопротивление при 20 0 С – 0.47 Ом*м, а в расплаве 6.5*10 -7 Ом*м (близкое к жидким металлам).
Карбид кремния (SiC)
В природе встречаются очень редко. Следствием сильных ковалентных связей отличается высокой температурной и химической стойкостью и твердостью.
Получают в электрических печах по реакции восстановления кварцевого песка углеродом:
SiO2 + 3C = SiC + 2CO
До 2000 0 С имеет кубическую — модификацию с а=4.359 .
При температуре больше 2600-2700 возгоняется. При получении образует друзы кристаллов, которые дробят до порошка и для получения полупроводниковой чистоты возгоняют в атмосфере аргона при Т = 2400-2600 0 С. Образует до 100 политипов (различающихся наложением атомных слоев). В зависимости от политипа имеет ширину запрещенной зоны от 2.39 до 3.33 эВ.
Производство германия
Фактически это группа полупроводниковых соединений одного химического состава. Управление политипизмом сложный процесс. Наиболее легко воспроизводится политип 6H ( ). В то же время химические механические свойства SiC слабо зависят политипа. Твердость – 9.5. Не окисляется до Т=1400 0 С. При комнатной температуре не взаимодействует с кислотами.
При нагревании взаимодействует с расплавами щелочей, H3PO4, HNO3+HF. Электропроводность примесная. От ее вида зависит окраска. Примеси P, As, Sb, Bi, Fe дают зеленую окраску, N, B-желтую и “n” –тип.Ca, Mg, B, Al, Ge, In — голубую и фиолетовую, и “p”- тип. Избыток Si дает “n”, избыток углерода -“p” тип. Собственная электропроводность при Т>1400 0 С.
Замечательная особенность SiC – способность к люминесценции в видимой области. Изменяя политип и примеси можно получать излучение от красного до фиолетового. Это используется для создания светодиодов на принципе инжекционной электролюминесценции.
Основой светодиодов является “р-n“ переход, формирующийся за счет диффузии примесей при 1800-2000 0 С. Наиболее распространены желтые светодиоды (примеси В и N). Несмотря на невысокую эффективность преобразования энергии – не деградируют, очень стабильны (световые эталоны). Применяют также для изготовления мощных выпрямителей, тензорезисторов, полевых транзисторов, варисторов. Высокую твердость используют при получении образивных материалов.
Источник: studfile.net
Характеристика химического элемента германия

История открытия
Химический элемент германий был установлен благодаря прогнозам Дмитрия Ивановича Менделеева. Именно им предсказано существование экасилиция, были даны рекомендации по его поиску.
Русский химик считал, что данный металлический элемент находится в титановых, циркониевых рудах. Менделеев пытался своими силами найти данный химический элемент, но его попытки не увенчались успехом. Только спустя пятнадцать лет на прииске, расположенном в Химмельфюрсте, был найден минерал, получивший название аргиродит. Своему названию данное соединение обязано серебру, обнаруженному в этом минерале.
Химический элемент германий в составе был обнаружен только после того, как к исследованиям приступила группа химиков из горной академии г. Фрейберга. Под руководством К. Винклера они выяснили, что на долю оксидов цинка, железа, а также на серу, ртуть приходится только 93 процента минерала. Винклер предположил, что оставшиеся семь процентов приходится на неведомый в то время химический элемент. После проведения дополнительных химических экспериментов был обнаружен германий. О своем открытии химик сообщил в докладе, представил информацию, полученную о свойствах нового элемента, Немецкому химическому обществу.
Химический элемент германий был представлен Винклером в качестве неметалла, по аналогии с сурьмой и мышьяком. Химик хотел назвать его нептунием, но это название уже использовалось. Тогда его стали называть германий. Химический элемент, открытый Винклером, вызвал серьезную дискуссию между ведущими химиками того времени.
Немецкий ученый Рихтер предположил, что это и есть тот самый экасилициум, о котором говорил Менделеев. Спустя некоторое время данное предположение было подтверждено, что доказало жизнеспособность периодического закона, созданного великим русским химиком.

Физические свойства
Как можно охарактеризовать германий? Химический элемент имеет 32 порядковый номер в периодической системе Менделеева. Данный металл плавится при 937,4 °С. Температура кипения этого вещества составляет 2700 °С.
Интересные факты
Германий – элемент, который впервые стали применять в Японии для медицинских целей. После многочисленных исследований германийорганических соединений, проводимых на животных, а также в ходе исследований на людях, удалось обнаружить положительное воздействие таких руд на живые организмы. В 1967 году доктору К. Асаи удалось обнаружить тот факт, что у органического германия существует огромный спектр биологического воздействия.

Биологическая активность
Какова характеристика химического элемента германия? Он способен переносить кислород по всем тканям живого организма. Попадая в кровь, он ведет себя по аналогии с гемоглобином. Германий гарантирует полноценное функционирование всех систем организма человека.
Именно этот металл является стимулятором размножения клеток иммунитета. Он, в виде органических соединений, позволяет формировать гамма-интерфероны, которые подавляют размножение микробов.
Германий препятствует образованию злокачественных опухолей, не дает развиваться метастазам. Органические соединения данного химического элемента способствуют выработке интерферона, защитной белковой молекулы, которая вырабатывается организмом в качестве защитной реакции на появление инородных тел.

Области применения
Противогрибковое, антибактериальное, противовирусное свойство германия стало основой сфер его применения. В Германии этот элемент в основном получили как побочный продукт переработки цветных руд. Разными способами, которые зависят от состава исходного сырья, выделяли германиевый концентрат. В его составе содержалось не больше 10 процентов металла.
Как именно в полупроводниковой современной технике применяется германий? Характеристика элемента, данная ранее, подтверждает возможность его использования для производства триодов, диодов, силовых выпрямителей, кристаллических детекторов. Также германий используется при создании дозиметрических приборов, устройств, которые необходимы для измерения напряженности постоянного и переменного магнитного поля.
Существенную область применения данного металла составляет изготовление детекторов инфракрасного излучения.
Перспективным является использование не только самого германия, но и некоторых его соединений.
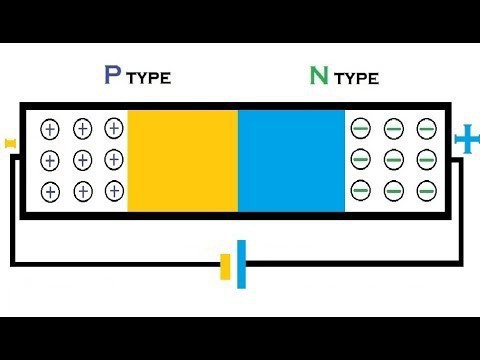
Химические свойства
Германий при комнатной температуре довольно стоек к воздействию влаги, кислорода воздуха.
В ряду химических элементов (кремний — германий — олово) наблюдается увеличение восстановительной способности.
Германий устойчив к воздействию растворов соляной и серной кислот, он не вступает во взаимодействие с растворами щелочей. При этом данный металл довольно быстро растворяется в царской водке (семи азотной и соляной кислот), а также в щелочном растворе пероксида водорода.
Как дать полную характеристику химическому элементу? Германий и его сплавы необходимо проанализировать не только по физическим, химическим свойствам, но и областям применения. Процесс окисления германия азотной кислотой протекает достаточно медленно.
Нахождение в природе
Попробуем дать характеристику химическому элементу. Германий в природе обнаружен только в виде соединений. Среди самых распространенных в природе германийсодержащих минералов выделим германит и аргиродит. Кроме того, германий присутствует в сульфидах и силикатах цинка, а в незначительном количестве он есть в различных типах каменного угля.
Вред для здоровья
Какое воздействие оказывает на организм германий? Химический элемент, электронная формула которого имеет вид 1е; 8 е; 18 е; 7 е, может негативно воздействовать на человеческий организм. Например, при загрузке германиевого концентрата, измельчении, а также загрузке диоксида данного металла, могут появляться профессиональные заболевания. В качестве иных источников, приносящих вред здоровью, можно рассматривать процесс переплавки порошка германии в бруски, получение угарного газа.
Адсорбированный германий можно достаточно быстро вывести из организма, в большей степени с мочой. В настоящее время нет детальной информации о том, насколько токсичны неорганические соединения германия.
Раздражающее действие на кожу оказывает тетрахлорид германия. В клинических испытаниях, а также при длительном пероральном приеме кумулятивных количеств, которые достигали 16 граммов спирогермания (органического противоопухолевого препарата), а также иных германиевых соединений, обнаружена нефротоксическая и нейротоксическая активность данного металла.
Подобные дозировки в основном не характерны для промышленных предприятий. Те эксперименты, что проводились на животных, были направлены на изучение действия германия и его соединений на живой организм. В результате удалось установить ухудшение здоровья при вдыхании существенного объема пыли металлического германия, а также его диоксида.
Ученые обнаружили в легких животных серьезные морфологические изменения, которые аналогичны пролиферативным процессам. Например, было выявлено существенное утолщение альвеолярных разделов, а также гиперплазия лимфатических сосудов вокруг бронхов, утолщения кровеносных сосудов.
Диоксид германия не оказывает раздражающего действия на кожу, но непосредственный контакт этого соединения с оболочкой глаза приводит к образованию германиевой кислоты, являющейся серьезным глазным раздражителем. При продолжительных внутрибрюшинных инъекциях были обнаружены серьезные изменения в периферической крови.

Важные факты
Самыми вредными соединениями германия являются хлорид и гидрид германия. Последнее вещество провоцирует серьезное отравление. В результате морфологического обследования органов животных, которые погибли при острой фазе, показали существенные нарушения в системе кровообращения, а также клеточные модификации в паренхиматозных органах. Ученые пришли к выводу, что гидрид представляет собой многоцелевой яд, который поражает нервную систему, угнетает систему периферийного кровообращения.
Тетрахлорид германия
Он является сильным раздражителем дыхательной системы, глаз, кожи. В концентрации 13 мг/м 3 он способен подавлять на клеточном уровне легочный ответ. При увеличении концентрации данного вещества наблюдается серьезное раздражение верхних дыхательных путей, существенные изменения ритма и частоты дыхания.
Отравление данным веществом приводит к катарально-десквамативным бронхитам, интерстициальной пневмонии.
Получение
Так как в природе германий представлен в качестве примеси к никелевым, полиметаллическим, вольфрамовым рудам, для выделения чистого металла в промышленности проводят несколько трудоемких процессов, связанных с обогащением руды. Из нее выделяют сначала оксид германия, затем проводят его восстановление водородом при повышенной температуре до получения простого металла:
GeO2 + 2H2 = Ge + 2H2O.
Электронные свойства и изотопы
Германий считают непрямозонным типичным полупроводником. Величина его диэлектрической статистической проницаемости составляет 16, а величина сродства к электрону — 4эВ.
В тонкой пленке легированным галлием можно придать германию состояние сверхпроводимости.
В природе присутствует пять изотопов этого металла. Из них стабильными являются четыре, а пятый подвергается двойному бета-распаду, период полураспада составляет 1,58×10 21 лет.
Заключение
В настоящее время органические соединения данного металла применяют в разных сферах промышленности. Прозрачность в инфракрасной спектральной области металлического германия сверхвысокой чистоты важна для изготовления оптических элементов инфракрасной оптики: призм, линз, оптических окон современных датчиков. Самой распространенной областью использования германия считают создание оптики тепловизионных камер, которые функционируют в диапазоне длин волн от 8 до 14 микрон.
Подобные устройства применяют в военной технике для систем инфракрасного наведения, ночного видения, пассивного тепловидения, противопожарных системах. Также германий имеет высокий показатель преломления, что необходимо для антибликового покрытия.
В радиотехнике транзисторы на основе германия имеют характеристики, которые по многим показателям превышают показатели кремниевых элементов. Обратные токи у германиевых элементов существенно выше, чем у их кремниевых аналогов, что позволяет существенно увеличивать эффективность подобных радиоприборов. Учитывая, что германий не так распространен в природе, как кремний, в радиоприборах в основном применяют кремниевые полупроводниковые элементы.
Источник: fb.ru
Германий какой элемент

В ключевое отличие между кремнием и германием состоит в том, что У германия есть d-электроны, но у кремния нет d-электронов.
Кремний и германий находятся в одной группе (группа 14) периодической таблицы. Следовательно, у них есть четыре электрона на внешнем энергетическом уровне.Более того, они находятся в двух степенях окисления +2 и +4. Кремний и германий имеют схожие физические и химические характеристики, поскольку оба являются металлоидами. Однако между кремнием и германием также есть существенная разница.
1. Обзор и основные отличия
2. Что такое кремний
3. Что такое германий
4. Параллельное сравнение — кремний против германия в табличной форме
5. Резюме
Что такое кремний?
Кремний — это химический элемент с атомным номером 14, и он находится в группе 14 периодической таблицы, чуть ниже углерода. Мы можем обозначить его символом Si. Его электронная конфигурация составляет 1 с. 2 2 с 2 2p 6 3 с 2 3p 2 . Кремний может удалить четыре электрона и образовать +4 заряженный катион, или он может поделиться этими электронами с образованием четырех ковалентных связей.
Более того, мы можем охарактеризовать кремний как металлоид, потому что он обладает как металлическими, так и неметаллическими свойствами. Это твердый и инертный твердый металлоид. Температура плавления этого химического элемента 1414 о C, а температура кипения 3265 о C. Кремний в кристаллической форме очень хрупкий. Он очень редко встречается в природе в виде чистого кремния. В основном это оксид или силикат.
Поскольку кремний защищен внешним оксидным слоем, он менее подвержен химическим реакциям. Также этот элемент требует высоких температур для его окисления. Напротив, кремний реагирует с фтором при комнатной температуре. Кроме того, кремний не реагирует с кислотами, а реагирует с концентрированными щелочами.
![]()
Кремний широко используется в промышленности. Кремний — это полупроводник, поэтому его используют в компьютерах и электронных устройствах. Кремниевые соединения, такие как диоксид кремния или силикаты, широко используются в керамической, стекольной и цементной промышленности.
Что такое германий?
Ученый Клеменс Винклер открыл Германий в 1886 году. Мы можем обозначить этот элемент символом Ge, а его атомный номер 32. Он находится в периодической таблице под Si. Его электронная конфигурация составляет 1 с. 2 2 с 2 2p 6 3 с 2 3p 6 4 с 2 3D 10 4p 2 . Ge представляет собой металлоид, имеющий кристаллическую структуру, аналогичную структуре алмаза. Он твердый, хрупкий, имеет серо-белый цвет. Температура плавления Ge составляет около 937 о C, а температура кипения 2830 о С.
![]()
Кроме того, этот элемент химически и физически похож на кремний. Германий устойчив в воздухе и воде. Также он не реагирует с разбавленными кислотами и растворами щелочей. Как и кремний, мы используем германий в качестве полупроводникового материала в транзисторах и других электронных устройствах.
Более того, германий обычно имеет степени окисления +4 и +2, но чаще всего встречается в состоянии +4. Когда мы подвергаем этот элемент воздействию воздуха, он медленно превращается в форму диоксида, GeO.2.
В чем разница между кремнием и германием?
Кремний — это химический элемент с атомным номером 14 и химическим символом Si, а германий — химический элемент с атомным номером 32 и химическим символом Ge. Ключевое различие между кремнием и германием состоит в том, что у германия есть d-электроны, но у кремния нет d-электронов. Кроме того, конфигурация электронов кремния равна 1 с. 2 2 с 2 2p 6 3 с 2 3p 2 а электронная конфигурация германия равна 1 с 2 2 с 2 2p 6 3 с 2 3p 6 4 с 2 3D 10 4p 2 . Поэтому в качестве существенного различия между кремнием и германием можно сказать эти конфигурации.
Более того, атом германия имеет больший радиус, чем кремний. Кроме того, еще одно заметное различие между кремнием и германием заключается в том, что при определенных температурах у германия больше свободных электронов, чем у кремния. Таким образом, проводимость германия выше.
![]()
Резюме — Кремний против германия
И кремний, и германий используются в качестве полупроводников. Однако между кремнием и германием есть различия. Ключевое различие между кремнием и германием состоит в том, что у германия есть d-электроны, но у кремния нет d-электронов.
Источник: ru.strephonsays.com