Таблица содержит качественные реакции на анионы такие как SO4 2- , NO3 — , РО4 3- , CrO4 2- , S 2- , СО2 и другие.
Выпадение белого осадка, который не растворяется в кислотах: SO4 2- + Ва 2+ = BaSO4↓
1) добавить концентрированную H2SO4 и Сu, затем нагреть
Образование голубого раствора, содержащего ионы Сu 2+ , выделение газа бурого цвета (NO2).
Возникновение окраски сульфата нитрозо-железа (II) [Fe(H2O)5NO] 2+ . Окраска от фиолетовой до коричневой (реакция «бурого кольца»)
Выпадение светло-желтого осадка в нейтральной среде:
Выпадение желтого осадка, не растворимого в уксусной кислоте, но растворимого в HCl:
Выпадение черного осадка:
выпадение белого осадка, растворимого в кислотах:
известковая вода Са(ОН)2
Выпадение белого осадка и его растворение при пропускании СO2
Появление характерного запаха SO2:
Выпадение белого осадка
Выпадение белого осадка, который не растворяется в HNO3, но растворимого в концентрате NH3 · Н2О:
Качественные реакции на анионы. 9 класс.
Выпадение светло-желтого осадка, не растворимого в HNO3:
Аg + + Br — = AgBr↓ осадок темнеет на свету
Выпадение желтого осадка, не растворимого в HNO3 и NH3 конц.:
Аg + + I — = AgI↓ осадок темнеет на свету
ОН — (щелочная среда)
индикаторы: лакмус фенолфталеин
синее окрашивание, малиновое окрашивание
_______________
Источник информации: Насонова А.Е. Химия в таблицах. 8-11 класс. Справочное пособие, 2000
Поделитесь ссылкой с друзьями:
Похожие таблицы
- Аналитическая классификация анионов по группам (Таблица)
- Качественные реакции на катионы (Таблица)
- Качественные реакции органических соединений (Таблица)
- Химические свойства аминокислот, качественные реакции (Таблица)
| Подписываемся на обновления! | |||||
Информация, размещенная на сайте, предоставлена в целях ознакомления. Владельцы сайта infotables.ru не несут ответственности за риски, связанные с использованием информации, полученной с этого cайта.
Источник: infotables.ru
Качественные реакции на ионы (таблицы)
методическая разработка по химии (9,11 класс) по теме
Документ содержит две таблицы «Качественные реакции на катионы» и «Качественные реакции на анионы» и может использоваться как справочный материал в лабораторном практикуме по решению качественных задач в 9 и 11 классах
Скачать:
Предварительный просмотр:
Качественные реакции на катионы.
Реагент или воздействие
КИУ реакции на катион
Изменение цвета: универсальный индикатор и лакмус покраснеют, метиловый оранжевый—порозовеет.
Окраска пламени становится равномерно желтой.
Окраска пламени становится равномерно фиолетовой.
Раствор с анионом Cl-
Выпадает белый творожистый осадок, не растворимый в азотной кислоте, чернеющий на свету.
Раствор щелочи при нагревании
Запах аммиака. Влажная индикаторная бумага дает изменение как на ион ОН —
NH 4 + +OH — = NH 3 ↑+H 2 O
В голубом или синем растворе соли выпадает осадок синего цвета.
Cu 2+ +2OH — = Cu(OH) 2 ↓
2) раствор с анионом SO4 2-
1) Окраска пламени становится равномерно желто-зеленой;
2) выпадает белый осадок, который в кислотах не растворяется.
1)Не записываем; 2)Ba 2+ +SO 4 2- = BaSO4↓
Красная кровяная соль K 3 (Fe(CN) 6 )
Выпадение темно-синего осадка.
K + +Fe 2+ +(Fe(CN) 6 ) 3- =
Окраска пламени становится равномерно кирпично-красной.
1) Желтая кровяная соль K 4 (Fe(CN) 6 ); 2) роданид-ион SCN — ;3) раствор щелочи
1) Выпадение синего осадка; 2) кроваво-красное окрашивание раствора; 3) выпадение бурого осадка.
1)K + +Fe 3+ +(Fe(CN) 6 4- =
3)Fe 3+ +3OH — = Fe(OH) 3 ↓
Качественные реакции на анионы.
КИУ реакции на катион
Изменение цвета: универсальный индикатор и лакмус посинеют, метиловый оранжевый—пожелтеет.
Раствор с катионом Ag +
Выпадает белый творожистый осадок, не растворимый в азотной кислоте, чернеющий на свету.
Раствор с катионом Ag +
Выпадение светло-желтого осадка, который растворяется в азотной кислоте и темнеет на свету.
Раствор с катионом Ag +
Выпадение желтого осадка, который растворяется в азотной кислоте и темнеет на свету.
Раствор с катионом Pb 2+
Выпадение черного осадка.
Раствор с катионом Ba 2+
Выпадает белый осадок, который в кислотах не растворяется.
SO 4 2- +Ba 2+ = BaSO 4 ↓
Раствор с катионом H +
Выделяется газ, имеющий запах жженой спички.
SO 3 2- +2H + = H 2 O+SO 2 ↑
Раствор с катионом Ca 2+
Выпадает белый осадок, который в кислотах растворяется с выделением газа без цвета и запаха.
CO 3 2- +Ca 2+ = CaCO 3 ↓
Раствор с катионом Ag +
Выпадение желтого осадка, который растворяется в азотной кислоте.
PO 4 3- +3Ag + = Ag 3 PO 4 ↓
По теме: методические разработки, презентации и конспекты

Качественные реакции на ионы 9 класс
Качественные реакции на ионы 9 класс.

Практическая работа № 3. По теме: «Качественные реакции на ионы»
Цель работы: проведение качественных реакций на ионы; Задачи работы:Научиться распознавать наличие определенных ионов в растворе;На основе теории электролитической диссоциации научиться сос.

Качественные реакции на ионы железа
В данном материале представлены конспект урока и презентация по теме: «Качественные реакции на ионы железа».

Технологическая карта урока химии «Генетические ряды Fe2+ и Fe3+. Качественные реакции на ионы Fe2+ и Fe3+»
Тип урока: Урок открытия новых знаний.Цели урока:Образователная: Создать условия для формирования понятий о генетическом ряде железа(II) и железа (III), качественных реакциях на ионы Fe2+и.

Практическое исследование «Качественные реакции на ионы железа Fe 2+ b Fe 3+»
Игровые задания для учащихся 8-9 классов «Качественные реакции на ионы железа».
Урок-практикум «Качественные реакции на ионы металлов»
Практическая работа направлена на формирование и совершенствование умений распознавать вещества на основе знаний качественных реакций на ионы металлов в растворе.

Качественные реакции.Определение ионов.
Источник: nsportal.ru
Качественные реакции на неорганические вещества и ионы — уравнения и таблица

Задачей аналитической химии является определение состава исследуемого объекта, т. е. распознавание содержащихся в нём элементов и установление их точного количества. Первую часть задачи возможно решить посредством проведения качественных реакций на ионы (неорганических веществ) и функциональные группы (органическая химия).

Основные признаки качественной реакции
- выделение газа;
- изменение цвета раствора;
- выпадение или растворение осадка (для теоретического предположения достаточно воспользоваться таблицей растворимости).

Так как в аналитической химии широко применяют физические и физико-химические методы анализа, то для некоторых веществ признаком прохождения качественной реакции становятся изменение окраски пламени горелки при внесении в него вещества, начало люминесценции при ультрафиолетовом облучении или характе́рная форма образующихся кристаллов (которую возможно рассмотреть только при помощи микроскопа).
Аналитические группы

Качественные реакции на катионы и анионы принято классифицировать по так называемым аналитическим группам, приняв за основной признак деления взаимодействие ряда ионов со специальным, групповым реагентом. Продуктами таких реакций будут соединения с похожими свойствами, например, осадки, плохо растворимые в воде, или неустойчивые комплексы.
Самой распространённой схемой деления является сероводородная, где групповыми реагентами являются карбонат аммония, раствор сероводорода и соляная кислота. Свойства образуемых хлоридов, сульфидов и карбонатов позволяют определить 5 аналитических групп, к которым относятся ионы:
- K+, Na+, NH4+, Mg2+;
- Ba2+, Ca2+, Sr2+;
- Al3+, Cr3+, Fe3+, Fe2+, Ni2+, Co2+, Mn2+, Zn2+;
- Cu2+, Cd2+, Bi3+, As3+, Sn2+, Sn4+, Sb3+;
- Ag+, Pb2+, Hg.
Групповые реакции в химии используются не только для определения состава, но и для переведения ионов в инертное (не реакционноспособное) состояние.
Этот приём называется маскированием и своей целью имеет устранение соединений, мешающих проведению определённых химических исследований объекта.
Обнаружение катионов

Изменение окраски пламени является самым эффектным признаком качественной реакции и распространяется на определённое количество катионов неорганических веществ. За счёт выделения избытка энергии пламя становится жёлто-зелёным (Ba2+) и жёлтым (Na+), карминово-красным (Sr2+) и кирпично-красным (Ca2+), и даже фиолетово-розовым (K+). Тем не менее такой способ не является наиболее эффективным, так как интенсивность окраски напрямую зависит от концентрации, а определение цвета является субъективным. Поэтому результаты обычно проверяют дополнительно, используя иные реакции.
| Аналитическая группа | Ион | Реакция | Признак |
| I | K+ | KCl + NaHC4H4O6 (гидротартрат натрия)=KHC4H4O6 +NaCl | Выпадение белого кристаллического осадка, нерастворимого в воде, растворимого в гидроксиде калия и соляной кислоте |
| NH4+ | NH4Cl+NaOH=NH3 + H2O +NaCl | Выделение аммиака | |
| Mg2+ | MgCl2+2Na2CO3+H2O=(MgOH)2CO3+4NaCl+CO2 | Образование белого аморфного осадка | |
| II | Ba2+ | 2BaCl2+K2Cr2O7+H2O=2BaCrO4+2HCl | Жёлтый осадок, растворимый в HCl и нерастворимый в CH3COOH |
| Ca2+ | CaCl2+Na2CO3=CaCO3+2NaCl | Белый кристаллический осадок | |
| III | Zn2+ | ZnCl2+H2S=ZnS+2HCl | Белый осадок |
| Cr3+ | 2CrCl3+3H2O2+10KOH=2K2CrO4+8H20+6KCl | Появление жёлтой окраски | |
| Mn2+ | 2Mn(NO3)2+5PbO2+6HNO3=2HMnO4+5Pb(NO3)2+2H2O | Красно-фиолетовый цвет раствора | |
| Fe2+ | FeSO4+K3Fe(CN)6=KFeFe(CN)6+K2SO4 | Синий осадок | |
| Fe3+ | FeCl3+4KSCN=K Fe(SCN)4+3KCl | Ярко-красный цвет раствора | |
| IV | Cu2+ | CuSO4+4NH3=Cu(NH3)4SO4 | Устойчивый комплекс ярко-синего цвета |
| Cu2+ | CuCl2+H2S=CuS+2HCl | Чёрный, нерастворимый в воде и разбавленных кислотах, осадок |
Пятая группа отличается тем, что катионы серебра, свинца и меди, образуют малорастворимые в воде соединения характе́рной окраски, позволяющие без труда отличить их от других веществ. Например, серебро образует следующие осадки — AgSO4 бесцветный, Ag2S чёрный, AgI жёлтый, AgBr бледно-жёлтый, AgCl белый творожистый и Ag3PO4 жёлтый кристаллический, свинец — PbI2 ярко-жёлтый, PbSO4 белый.
Кроме того, и сам ион серебра является специфическим реагентом, только не для неорганической химии, а для органических соединений.
Ag2O в аммиачном растворе при добавлении альдегида образует на поверхности сосуда тонкую плёнку чистого серебра. Сама реакция широко известна как получение «серебряного зеркала».
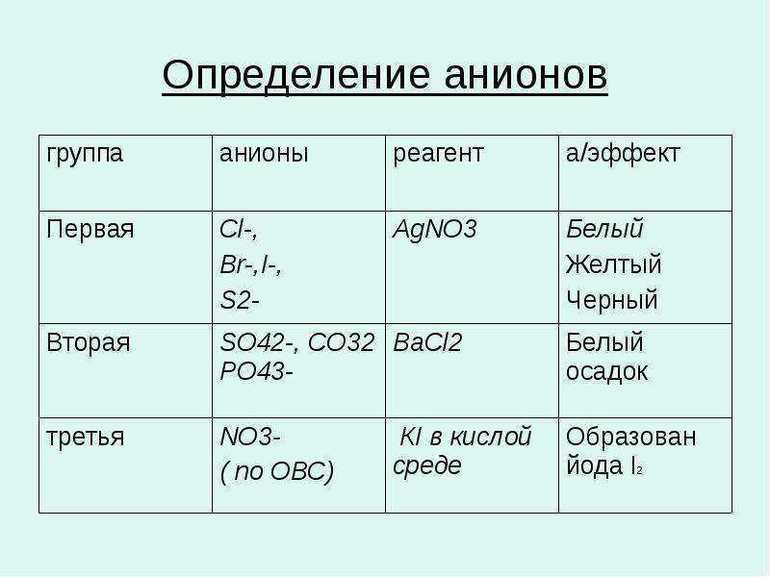
Определение анионов
По групповому реагенту и органические, и неорганические анионы делятся на три группы: групповой реагент BaCl2, AgNO3 (или HNO3) или групповой реагент отсутствует. Для I группы (SO4(2-), PO4(3-), SO3(2-)) признаком прошедшей качественной реакции является образование бесцветных и малорастворимых соединений. Нитрат серебра образует с анионами II группы (ионы галогенов) характерно окрашенные соединения, растворимые в азотной кислоте.
Для определения остальных анионов существуют специфические реакции, например, NO3- взаимодействует с дифениламином ((С6H5)2NH), окрашивая раствор в очень яркий оттенок фиолетового.
Эта реакция проводится капельным методом, т. е. с помощью микропипеток на стеклянные пластинки наносится по 1-2 капли обоих реагентов, что является достаточным для получения яркого внешнего эффекта.
Качественные реакции имеют большое значение для химии. При помощи относительно простых специфических реакций становится возможным установить, какие же вещества находятся в смеси, и в дальнейшем провести ряд сложных операций, направленных на её разделение, экстракцию определённых соединений и т. д. Это используют и в исследовательских, и в промышленных лабораториях, следящих за контролем качества продукции.
Источник: nauka.club