Гидроксид меди (II) — Cu(OH)2 – аморфный порошок синего цвета.
Выпадает в виде голубого хлопьевидного осадка из растворов солей меди (II) при добавлении щелочи или гидроксида аммония:
При действии избытка гидроксида аммония растворяется с образованием сине-фиолетового комплекса – тетраамминмеди (II):
1.При нагревании разлагается:
2.Слабо амфотерен (с преобладанием основных свойств). Легко растворяется в кислотах:
В небольших количествах растворяется в концентрированных растворах щелочей с образованием комплексных соединений – тетрагидроксокупратов:
Растворимые соли меди (II) в растворах очень слабо (из-за образования устойчивых аквакомплексов) гидролизуются по катиону и имеют кислую реакцию:
Cu 2+ + HOH ↔ CuOH + + H +
Безводный CuSO4 – порошок белого цвета. При растворении в воде образуется комплексный ион [Cu(H2O)4] 2+ синего цвета. Гидратированные ионы меди имеют синюю окраску. Из раствора выделяются кристаллогидраты состава CuSO4•5H2O (медный купорос).
Золото и серебро окисляются кислородом только в присутствии цианид-ионов (из-за образования устойчивых комплексов) или сероводорода (вследствие образования малорастворимых сульфидов):
2. С неметаллами
Серебро и золото при нагревании реагируют с серой. С хлором эти металлы образуют соответственно AgCl, AuCl3:
Серебро растворяется в концентрированных азотной и серной кислотах:
Золото можно растворить в «царской водке»:
Соединения серебра (I)
Оксид серебра (I) – Ag2O – имеет основной характер, в воде не растворяется. С концентрированными растворами щелочей взаимодействует с образованием гидроксокомплексных соединений:
Ag2O обладает сильными окислительными свойствами, например окисляет пероксид водорода:
Катионы серебра – сильные комплексообразователи.
Образование комплексных соединений:
Гидроксид серебра (I) очень неустойчивое соединение и в водном растворе не образуется:
Золото образует два оксида – Au2O и Au2O3. Более устойчивы соединения золота в степени окисления +3. Золото растворяется в «царской водке», получается золотохлористоводородная кислота H[AuCl4]. Известны соли этой кислоты Na[AuCl4].
Гидроксиды золота (I) и (III) получают обменными реакциями. Au(OH)3 – имеет амфотерный характер (золотая кислота). Растворяется в кислотах и щелочах с образованием комплексных соединений:
Катионы Au 3+ — сильные комплексообразователи, координационное число – 4 — Na[AuCl4]
Источник: studopedia.su
25 примеров гидроксидов

В гидроксиды представляют собой комбинации катионов металлов и гидроксильных анионов (OH – ). Они есть неорганические соединения тройные, так как они содержат в своей структуре водород, кислород и металлический элемент . Их получают, когда оксид металла и вода. Например: гидроксид натрия, гидроксид бария, гидроксид алюминия.
При растворении в воде гидроксиды диссоциируют и высвобождают гидроксильная группа, помимо катиона металла. Гидроксиды имеют сильный основной характер, это связано с тем, что гидроксильная группа может захватывать протоны, поэтому их еще называют базы .
Характеристики гидроксидов
В соответствии с Номенклатура акцийЧтобы назвать гидроксид, достаточно к выражению «гидроксид» добавить название металла, из которого он состоит. Однако некоторые металлы, которые могут вступать в комбинацию с гидроксильными группами, могут принимать более одного состояния окисление , например, +2 или +3.
В этом случае номенклатура усложняется и необходимо указать между скобка , после названия металла степень окисления С чем сочетается металл в римских цифрах?
Другой вариант — использовать суффикс в названии металла, который дает отчет о его степени окисления в молекула (Это известно как функциональная номенклатура). «Медвежий» окончание соответствует самому низкому состоянию окисления или валентности (из двух, которые имеет металл), окончание «ico» соответствует самому высокому.
Чтобы написать формулу гидроксида, необходимо помнить, что число гидроксила будет указано в нижнем индексе, и оно будет совпадать с степенью окисления, принятой для металла.
Из-за его основной персонажгидроксиды заставляют лакмусовую бумагу менять цвет с красного на синий, а в присутствии фенолфталеина раствор меняет цвет с бесцветного на розовый. Реакция взаимодействия гидроксидов и кислоты производить соль и воду; обычно эти реакции высвобождают энергию.
Использование гидроксидов
Гидроксиды имеют разные использует в повседневной жизни. Например, сода или едкий калий (гидроксид натрия и калия соответственно) используются для прочистки труб.
В гидроксид магния известен как антацид , многие желудочные пищеварения включают его в свои рецептуры. В более высоких концентрациях обладает слабительным действием.
В гидроксид алюминия он также используется в качестве антацида в так называемых «фруктовых солях». Гидроксид кальция широко используется в строительстве, в этой области он известен как «гашеная известь».
Примеры гидроксидов
Двадцать пять гидроксидов перечислены ниже в качестве примера:
- Гидроксид натрия, NaOH. Его используют в текстильной промышленности, также из него делают мелки и бумагу. Он также используется в различных чистящих средствах, например в красках.
- Гидроксид бария, Ba (OH)2. Его используют при изготовлении керамики и различных видов ядов.
- Гидроксид алюминия, Al (OH)3. Он используется для снятия различных расстройств желудка.
- Гидроксид цинка, Zn (OH)2. Используется как адсорбент; Также были созданы наночастицы этого гидроксида.
- Гидроксид железа, Fe (OH)3. Его используют при производстве красок и лекарств.
- Гидроксид железа, Fe (OH)2. Широко используется в металлургической промышленности.
- Гидроксид меди, Cu (OH)2. Он используется как лабораторный реактив, а также как фунгицид.
- Гидроксид меди, CuOH. Подобен гидроксиду меди (Cu (OH)2).
- Гидроксид кальция, Ca (OH)2. Это так называемая мертвая известь или гашеная известь, столь важная в строительстве. Он также используется в сельское хозяйство и в химической, фармацевтической и еда .
- Гидроксид лития, LiOH. Он используется для удаления углекислого газа в системах очистки.
- Гидроксид хрома (III), Cr (OH)3. Его используют при производстве красок, особенно для достижения зеленого цвета.
- Гидроксид свинца (IV), Pb (OH)4. В основном используется в оболочках для кабелей.
- Гидроксид золота (III), Au (OH)3. Он используется во многих областях медицины и керамики.
- Гидроксид серебра, AgOH. Он используется для создания определенных продуктов, которые работают для обнаружения хлоридов в других растворах.
- Гидроксид ртути, Hg (OH)2. Его используют все реже из-за его токсичности.
- Гидроксид бериллия, Be (OH)2. Он используется как сырье в получении металлического бериллия.
- Гидроксид свинца (II), Pb (OH)2. Его часто используют для покрытий.
- Гидроксид платины (IV), Pt (OH)4. Он используется для производства очень тонкой проволоки.
- Гидроксид кобальта (II), Co (OH)2. Он используется при приготовлении солей кобальта.
- Гидроксид марганца (III), Mn (OH)3. Он образует разные типы зеленых кристаллов.
- Гидроксид стронция, Sr (OH)2. Поглощает углекислый газ из воздуха.
- Гидроксид магния, Mg (OH)2. Он используется как антацидное или слабительное средство.
- Гидроксид олова (II), Sn (OH)2. Он используется в красителях в тканевой промышленности.
- Гидроксид аммония, NH4ой. Он используется в основном в пищевой промышленности.
- Гидроксид кадмия, Cd (OH)2. Встречается в промышленных аккумуляторных батареях.
Источник: amara-malik.com
Готовимся к углубленному изучению химии
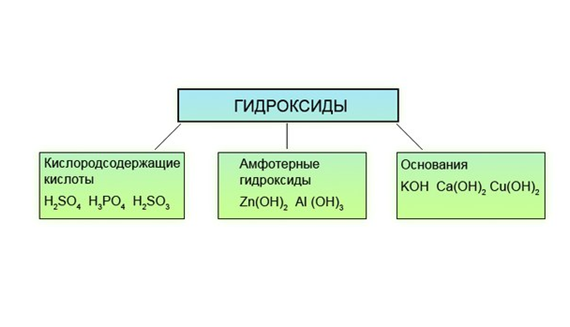
Амфотерные гидроксиды – электролиты, образующие при диссоциации одновременно катионы Н + и анионы ОН – :
X + + OH – ⇌ ХOH = HXO ⇌ H + + XO – .
Амфотерные гидроксиды в кислой среде ведут себя как основания, а в щелочной – как кислоты.
K амфотерным гидроксидам относятся Be(OH)2, Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3, Fe(OH)3,
Cr(OH)3 и некоторые другие, им соответствуют амфотерные оксиды. Практически все они нерастворимы в воде, являются слабыми электролитами и диссоциируют ступенчато.
Химические свойства амфотерных гидроксидов
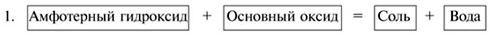
2Al(OH)3 + Na2O 2NaAlO2 + 3H2O ↑ .

Некоторые амфотерные гидроксиды (Be(OH)2, Zn(OH)2, Pb(OH)2) реагируют с кислотным оксидом СО2 с образованием осадков основных солей и воды. Например:
2Be(OH)2 + CO2 = (BeOH)2CO3 + H2O.
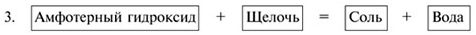
Zn(OH)2 + 2KOH (тв.) K2ZnO2 + 2H2O ↑ ,
Zn(OH)2 + 2KOH = K2[Zn(OH)4].
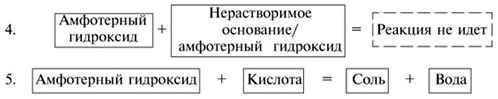
Al(OH)3 + 3HCl = AlCl3 + 3H2O.
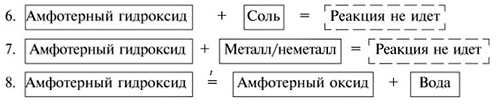
Все амфотерные гидроксиды (как и большинство оснований) разлагаются при нагревании на оксид и воду. Например:
2Al(OH)3 Al2O3 + 3H2O.
В связи с этим нужно учитывать, что фактически в процессе сплавления их со щелочами и оксидами участвует не сам амфотерный гидроксид, а соответствующий ему оксид.

SHAPE * MERGEFORMAT

УПРАЖНЕНИЯ
1) СО2 и HCl 2) Н2 и NaOH 3) NО и NaNO3 4) H2SO4 и NaOH
Решение: Гидроксид хрома – амфотерный гидроксид. Амфотерные гидроксиды реагируют с кислотами и щелочами, с кислотыми и основными оксидами. Поэтому нам подходит вариант 4 –серная кислота и гидроксид натрия (щелочь):
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O
Cr(OH)3 + NaOH = Na[Cr(OH)4]
________________________________________________________________
2. Гидроксид калия взаимодействует с каждым из двух веществ
1) нитратом натрия и нитратом серебра
2) гидроксидом алюминия и нитратом серебра
3) гидроксидом цинка и оксидом меди(I)
4) хлоридом бария и оксидом фосфора(V)
Решение :
Гидроксид калия это щелочь. она взаимодействует с кислотами,кислотными оксидами, амфотерными оксидами и гидроксидами,растворами солей при условии, если есть признак необратимости реакции (осадок, газ, слабый электролит). Данному условию соответствует набор веществ в варианте 2 — амфотерный гидроксид и соль.
________________________________________________________________
3. Осуществить превращения:
Al- 1 — Al2O3 — 2 — NaAlO2 — 3 — Al (OH)3 — 4 — Al2O3
1. 4Al + 3O2 = 2Al2O3
2. Al2O3 + Na2O 2NaAlO2
3. NaAlO2 + HCl + H2O = NaCl + Al(OH)3
4. 2Al(OH)3 Al2O3 +3H2O
________________________________________________________________
4. Осуществить превращения:
AlCl3 — 1 — Al(OH)3 — 2 — Na[Al (OH)4] — 3 — AlCl3
1. AlCl3 + 3NaOH = 3NaCl + Al(OH)3 |
2. Al(OH)3 + NaOH = Na[ Al(OH)4 ]
3. Na[ Al(OH)4 ]+ 4HCl = NaCl + AlCl3 + 4H2O
________________________________________________________________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Закончите уравнения реакций:
Cr(OH)3 + 6HCl = ?
Cr(OH)3 + NaOH = ?
2. Напишите уравнения реакций, описывающие следующие химические превращения:
а) ZnCl2 + KOH(избыток) → осадок → растворение осадка;
б) Cr(NO3)2 + NaOH(избыток) → осадок → растворение осадка.
3. Закончи уравнения реакций:
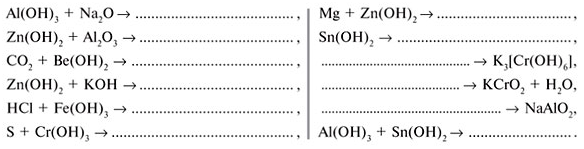
4 . В предложенных рядах исключи (вычеркни) одну лишнюю формулу – такую, которая не образует с остальными однородную группу. Объясни свой выбор.
а) HClO4, H2SO3, HNO3, H3PO4; б) KOH, Mg(OH)2, Al(OH)3;
в) HBr, HCl, HF; г) Mg(OH)2, Ca(OH)2, Zn(OH)2, Ba(OH)2;
д ) H2CO3, H2SO3, HNO3; е ) ZnO, BeO, MgO.
5. Составь уравнения реакций, соответствующие схемам:
1) Zn Na2 → ZnO2 → ZnSO4 → Zn(OH)2 → ZnO;
2) Al2O3 → X → Al(OH)3 → Y → AlCl3;
6.
Предложи cпособ разделения смеси KOH, Mg(OH)2, Fe(OH)3. Напиши уравнения реакций.
7 . Осуществите следующие превращения:
Al2O3 → Al → Al2O3 → NaAlO2 → AlCl3
8. Из порошкообразной смеси, содержащей Na2CO3, Fe, Al и BaSO4, выделите химическим путем все соединения в чистом виде. Напишите уравнения реакций и последовательность их проведения (опишите технологию всей работы).
9 . Напишите схему диссоциации гидроксида хрома ( III ), а также молекулярное и ионное уравнения реакций растворения его в:
а) азотной кислоте;
б) растворе гидроксида натрия.
10 . Заполни таблицу по химическим свойствам амфотерных гидроксидов (укажи продукты реакций). Напиши уравнения реакций на примере Zn(OH)2.
Источник: himiy88.blogspot.com