В зависимости от поведения в водных растворах и расплавах все вещества делятся на электролиты и неэлектролиты .
Электролиты — это вещества, которые в растворённом или расплавленном виде распадаются на ионы и проводят электрический ток.
К электролитам относятся щёлочи, кислоты и соли. Это соединения с ионными и ковалентными сильнополярными связями.
Неэлектролиты — это вещества, растворы и расплавы которых не проводят электрический ток.
К неэлектролитам относятся вещества с неполярными и ковалентными малополярными связями: простые вещества, углеводороды, спирты, альдегиды, углеводы и др.
Электролитическая диссоциация
Электролитическая диссоциация — это распад электролитов на ионы под воздействием воды или при расплавлении.
В водных растворах диссоциация происходит с участием полярных молекул воды. При растворении ионных соединений имеющиеся в их кристаллах ионы гидратируются и переходят в раствор. При растворении полярных веществ (кислот) взаимодействие их молекул с молекулами воды приводит к увеличению полярности ковалентной связи и её превращению в ионную. Затем молекулы распадаются на ионы.
Как отличить слабый электролит от сильного?
Степень диссоциации. Сильные и слабые электролиты
Степень диссоциации (α) — это отношение числа продиссоциировавших молекул к общему числу молекул в растворе.
α = N дис . N общ . .
Число частиц вещества связано с его количеством: N = n ⋅ N a . Значит, α = n дис . n общ . .
Величина (α) выражается в долях единицы или в процентах, например: (α) (=) (0,4) (=) (40) % .
Степень диссоциации показывает, какая часть молекул вещества распалась на ионы. Например, если степень диссоциации сернистой кислоты (10) % , значит, из каждых (100) молекул кислоты распадаются на ионы (10).
Степень диссоциации обычно определяют экспериментально, исследуя электропроводность раствора. Она зависит от природы вещества, его концентрации в растворе и от температуры.
Если степень диссоциации вещества в разбавленных растворах близка к (1) (или к (100) % ), то это сильный электролит . К сильным электролитам относятся щёлочи и растворимые соли, а также сильные кислоты (азотная, серная, соляная, бромоводородная, йодоводородная, хлорная, хлорноватая, марганцевая, хромовая).
Сильные электролиты диссоциируют необратимо. В уравнениях диссоциации таких электролитов используют знак равенства или стрелку:
KOH → K + + OH − .
Если вещество распадается на ионы незначительно и его степень диссоциации близка к (0), то такое вещество называют слабым электролитом .
К слабым электролитам относятся: вода, слабые минеральные кислоты (азотистая, угольная, сероводородная, плавиковая), карбоновые кислоты, нерастворимые основания, гидроксиды аммония и аминов.
В растворах слабых электролитов устанавливается равновесие между ионами и молекулами (или нерастворившимся веществом немолекулярного строения), поэтому в уравнениях диссоциации записывают знак равновесия:
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии — INTENSIV
HNO 2 ⇄ H + + NO 2 − .
Такое состояние можно охарактеризовать константой диссоциации:
K дис . ( HNO 2 ) = c ( H + ) ⋅ c ( NO 2 − ) c ( HNO 2 ) .
Чем больше константа диссоциации, тем лучше электролит распадается на ионы. Константы диссоциации приведены в справочниках.
K дис . ( AgOH ) = 1,1 ⋅ 10 − 4 ,
K дис . ( NH 4 OH ) = 1,8 ⋅ 10 − 5 .
Значит, гидроксид аммония — более слабый электролит по сравнению с гидроксидом серебра.
К диссоциации слабых электролитов применим принцип Ле Шателье. Например, степень диссоциации азотистой кислоты можно понизить, если в раствор добавить сильную кислоту. Увеличение концентрации ионов водорода сдвинет равновесие влево.
Источник: www.yaklass.ru
Сильные и слабые электролиты
ЭЛЕКТРОЛИТЫ – вещества, растворы или расплавы которых проводят электрический ток.
НЕЭЛЕКТРОЛИТЫ – вещества, растворы или расплавы которых не проводят электрический ток.
Диссоциация – распад соединений на ионы.
Степень диссоциации – отношение числа продиссоциированных на ионы молекул к общему числу молекул в растворе.
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ при растворении в воде практически полностью диссоциируют на ионы.
При написании уравнений диссоциации сильных электролитов ставят знак равенства.
К сильным электролитам относятся:
· Растворимые соли (смотри таблицу растворимости);
· Многие неорганические кислоты: HNO3, H2SO4,HClO3, HClO4, HMnO4, HCl, HBr, HI (смотри кислоты-сильные электролиты в таблице растворимости);
· Основания щелочных (LiOH, NaOH,KOH) и щелочноземельных (Ca(OH)2, Sr(OH)2, Ba(OH)2) металлов (смотри основания-сильные электролиты в таблице растворимости).
СЛАБЫЕ ЭЛЕКТРОЛИТЫ в водных растворах лишь частично (обратимо) диссоциируют на ионы.
При написании уравнений диссоциации слабых электролитов ставят знак обратимости.
К слабым электролитам относятся:
· Почти все органические кислоты и вода (Н2О);
· Некоторые неорганические кислоты: H2S, H3PO4,HClO4, H2CO3, HNO2, H2SiO3 (смотри кислоты-слабые электролиты в таблице растворимости);
· Нерастворимые гидроксиды металлов (Mg(OH)2,Fe(OH)2, Zn(OH)2) (смотри основания-cлабые электролиты в таблице растворимости).
На степень электролитической диссоциации влияет ряд факторов:
- природа растворителя иэлектролита: сильными электролитами являются вещества с ионными и ковалентными сильно-полярными связями; хорошей ионизирующей способностью, т.е. способностью вызывать диссоциацию веществ, обладают растворители с большой диэлектрической проницаемостью, молекулы которых полярны (например, вода);
- температура: поскольку диссоциация — процесс эндотермический, повышение температуры повышает значение α;
- концентрация: при разбавлении раствора степень диссоциации возрастает, а с увеличением концентрации — уменьшается;
- стадия процесса диссоциации: каждая последующая стадия менее эффективна, чем предыдущая, примерно в 1000–10 000 раз; например, для фосфорной кислоты α1 > α2 > α3:
H3PО4⇄Н++H2PО−4 (первая стадия, α1), H2PО−4⇄Н++HPО2−4 (вторая стадия, α2), НPО2−4⇄Н++PО3−4 (третья стадия, α3). По этой причине в растворе данной кислоты концентрация ионов водорода наибольшая, а фосфат-ионов РО3−4 — наименьшая. 1. Растворимость и степень диссоциации вещества между собой не связаны. Например, слабым электролитом является хорошо (неограниченно) растворимая в воде уксусная кислота. 2. В растворе слабого электролита меньше других содержится тех ионов, которые образуются на последней стадии электролитической диссоциации На степень электролитической диссоциации влияет также добавление других электролитов: например, степень диссоциации муравьиной кислоты HCOOH ⇄ HCOO − + H + уменьшается, если в раствор внести немного формиата натрия. Эта соль диссоциирует с образованием формиат-ионов HCOO − : HCOONa → HCOO − + Na + В результате в растворе концентрация ионов НСОО– повышается, а согласно принципу Ле Шателье, повышение концентрации формиат-ионов смещает равновесие процесса диссоциации муравьиной кислоты влево, т.е. степень диссоциации уменьшается. Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводностиразбавленного раствора бинарного слабого электролита от концентрации раствора:  Здесь
Здесь  — константа диссоциации электролита,
— константа диссоциации электролита,  — концентрация,
— концентрация,  и
и  — значения эквивалентной электропроводности при концентрации
— значения эквивалентной электропроводности при концентрации  и при бесконечном разбавлении соответственно. Соотношение является следствием закона действующих масс и равенства
и при бесконечном разбавлении соответственно. Соотношение является следствием закона действующих масс и равенства  где
где 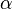 — степень диссоциации. Закон разбавления Оствальда выведен В.Оствальдом в 1888 году и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации. Электролитическая диссоциация воды. Водородный показатель рН Вода представляет собой слабый амфотерный электролит: Н2О Н+ + ОН- или, более точно: 2Н2О= Н3О+ + ОН- Константа диссоциации воды при 25оС равна: Такое значение константы соответствует диссоциации одной из ста миллионов молекул воды, поэтому концентрацию воды можно считать постоянной и равной 55,55 моль/л (плотность воды 1000 г/л, масса 1 л 1000 г, количество вещества воды 1000г:18г/моль=55,55 моль, С=55,55 моль: 1 л =55,55 моль/л). Тогда Эта величина постоянная при данной температуре (25оС), она называется ионным произведением воды KW: Диссоциация воды – процесс эндотермический, поэтому с повышением температуры в соответствии с принципом Ле-Шателье диссоциация усиливается, ионное произведение возрастает и достигает при 100оС значения 10-13. В чистой воде при 25оС концентрации ионов водорода и гидроксила равны между собой: [H+] = [OH-] = 10-7 моль/л Растворы, в которых концентрации ионов водорода и гидроксила равны между собой, называются нейтральными. Если к чистой воде прибавить кислоту, концентрация ионов водорда повысится и станет больше, чем 10-7 моль/л, среда станет кислой, при этом концентрация ионов гидроксила мгновенно изменится так, чтобы ионное произведение воды сохранило свое значение 10-14. Тоже самое будет происходить и при добавлении к чистой воде щелочи. Концентрации ионов водорода и гидроксила связаны между собой через ионное произведение, поэтому, зная концентрацию одного из ионов, легко вычислить концентрацию другого. Например, если [H+] = 10-3 моль/л, то [OH-] = KW/[H+] = 10-14/10-3 = 10-11 моль/л, или, если [OH-] = 10-2 моль/л, то [H+] = KW/[OH-] = 10-14/10-2 = 10-12 моль/л. Таким образом, концентрация ионов водорода или гидроксила может служить количественной характеристикой кислотности или щелочности среды. На практике пользуются не концентрациями ионов водорода или гидроксила, а водородным рН или гидроксильным рОН показателями. Водородный показатель рН равен отрицательному десятичному логарифму концентрации ионов водорода: рН = — lg[H+] Гидроксильный показатель рОН равен отрицательному десятичному логарифму концентрации ионов гидроксила: рОН = — lg[OH-] Легко показать, прологарифмировав ионное произведение воды, что рН + рОН = 14 Если рН среды равен 7 — среда нейтральная, если меньше 7 — кислая, причем чем меньше рН, тем выше концентрация ионов водорода. pН больше 7 – среда щелочная, чем больше рН, тем выше концентрация ионов гидроксила.
— степень диссоциации. Закон разбавления Оствальда выведен В.Оствальдом в 1888 году и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации. Электролитическая диссоциация воды. Водородный показатель рН Вода представляет собой слабый амфотерный электролит: Н2О Н+ + ОН- или, более точно: 2Н2О= Н3О+ + ОН- Константа диссоциации воды при 25оС равна: Такое значение константы соответствует диссоциации одной из ста миллионов молекул воды, поэтому концентрацию воды можно считать постоянной и равной 55,55 моль/л (плотность воды 1000 г/л, масса 1 л 1000 г, количество вещества воды 1000г:18г/моль=55,55 моль, С=55,55 моль: 1 л =55,55 моль/л). Тогда Эта величина постоянная при данной температуре (25оС), она называется ионным произведением воды KW: Диссоциация воды – процесс эндотермический, поэтому с повышением температуры в соответствии с принципом Ле-Шателье диссоциация усиливается, ионное произведение возрастает и достигает при 100оС значения 10-13. В чистой воде при 25оС концентрации ионов водорода и гидроксила равны между собой: [H+] = [OH-] = 10-7 моль/л Растворы, в которых концентрации ионов водорода и гидроксила равны между собой, называются нейтральными. Если к чистой воде прибавить кислоту, концентрация ионов водорда повысится и станет больше, чем 10-7 моль/л, среда станет кислой, при этом концентрация ионов гидроксила мгновенно изменится так, чтобы ионное произведение воды сохранило свое значение 10-14. Тоже самое будет происходить и при добавлении к чистой воде щелочи. Концентрации ионов водорода и гидроксила связаны между собой через ионное произведение, поэтому, зная концентрацию одного из ионов, легко вычислить концентрацию другого. Например, если [H+] = 10-3 моль/л, то [OH-] = KW/[H+] = 10-14/10-3 = 10-11 моль/л, или, если [OH-] = 10-2 моль/л, то [H+] = KW/[OH-] = 10-14/10-2 = 10-12 моль/л. Таким образом, концентрация ионов водорода или гидроксила может служить количественной характеристикой кислотности или щелочности среды. На практике пользуются не концентрациями ионов водорода или гидроксила, а водородным рН или гидроксильным рОН показателями. Водородный показатель рН равен отрицательному десятичному логарифму концентрации ионов водорода: рН = — lg[H+] Гидроксильный показатель рОН равен отрицательному десятичному логарифму концентрации ионов гидроксила: рОН = — lg[OH-] Легко показать, прологарифмировав ионное произведение воды, что рН + рОН = 14 Если рН среды равен 7 — среда нейтральная, если меньше 7 — кислая, причем чем меньше рН, тем выше концентрация ионов водорода. pН больше 7 – среда щелочная, чем больше рН, тем выше концентрация ионов гидроксила.
Источник: studfile.net
Как определить сильные и слабые электролиты
Электролиты — это вещества, сплавы веществ или растворы, которые имеют способность электролитически проводить гальванический ток. Определить, к каким электролитам относится вещество, можно применяя теорию электролитической диссоциации.

Статьи по теме:
- Как определить сильные и слабые электролиты
- Как вычислить степень диссоциации
- Как определить силу кислоты
Инструкция
Суть данной теории заключается в том, что при расплавлении (растворении в воде) практически все электролиты раскладываются на ионы, которые бывают как положительно, так и отрицательно заряженные (что и называется электролитической диссоциацией). Под воздействием электрического тока отрицательные (анионы «-») движутся к аноду (+), а положительно заряженные (катионы, «+»), движутся к катоду (-). Электролитическая диссоциация – это обратимый процесс (обратный процесс носит название «моляризация»).
Степень (a) электролитической диссоциации находится в зависимости от природы самого электролита, растворителя, и от их концентрации. Это отношение числа молекул (n) , которые распались на ионы к общему числу введенных в раствор молекул (N). Получаете: a = n / N
Таким образом, сильные электролиты — вещества, полностью распадающиеся на ионы при растворении в воде. К сильным электролитам, как правило, относятся вещества с сильнополярными или ионными связями: это соли, которые хорошо растворимы, сильные кислоты (HCl, HI, HBr, HClO4, HNO3, H2SO4), а также сильные основания (KOH, NaOH, RbOH, Ba(OH)2, CsOH, Sr(OH)2, LiOH, Ca(OH)2). В сильном электролите вещество, растворенное в нем, находится по большей части в виде ионов (анионов и катионов); молекул, которые недиссоциированные — практически нет.
Слабые электролиты — такие вещества, которые диссоциируют на ионы лишь частично. Слабые электролиты вместе с ионами в растворе содержат молекулы недиссоциированные. Слабые электролиты не дают в растворе сильной концентрации ионов.
К слабым относятся:
— органические кислоты (почти все) (C2H5COOH, CH3COOH и пр.);
— некоторые из неорганических кислот (H2S, H2CO3 и пр.);
— практически все соли, малорастворимые в воде, гидроксид аммония, а также все основания (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
— вода.
Они практически не проводят электрический ток, или проводят, но плохо.
Обратите внимание
Хотя чистая вода проводит электрический ток очень плохо, она все-таки имеет измеримую электрическую проводимость, объясняемую тем, что вода немного диссоциирует на гидроксид-ионы и ионы водорода.
Полезный совет
Большинство электролитов – вещества агрессивные, поэтому при работе с ними будьте предельно осторожны и соблюдайте правила техники безопасности.
Совет полезен?
Статьи по теме:
- Как определить, сильная кислота или слабая
- Как определить сильные электролиты
- Что такое электролиты в современной химии
Добавить комментарий к статье
Похожие советы
- Как определить кислоту в смеси
- Что такое электролит
- Какие свойства у электролитов
- Как определять ионы
- Как происходит взаимодействие кислот с солями
- Как ослабить или усилить гидролиз
- От чего зависят кислотно-основные свойства
- Самое широкое применение электролиза
Источник: www.kakprosto.ru