Вода — самый распространенный на земле растворитель. Особенно хорошо в ней растворяются вещества ионного строения, такие как соли. При попадании в воду растворимые соли диссоциируют — разделяются на ионы. Но некоторые вещества не просто растворяются, а разлагаются водой. При этом возникают новые вещества. Такой процесс называется гидролизом.
Что такое гидролиз?
- Определение
- Виды
- Полезное видео: гидролиз солей
- Формула
- Степень гидролиза
- Практическое применение и значение
- Полезное видео: гидролиз солей — классификация солей
- Заключение
Определение
Реакция между растворителем и растворяемым веществом, при которой они оба разделяются на составные части, а продуктами становятся новые вещества, называется сольволизом. Гидролиз в химии — это частный случай такой реакции, где в роли растворителя выступает вода.

Гидролиз солей. Теория для задания 23 ЕГЭ по химии.
Что такое гидролиз
- по аниону;
- по катиону;
- по аниону и катиону;
- щелочное;
- кислотное;
- ферментативное.
Википедия приводит такое определение гидролиза. Это взаимодействие с водой, в ходе которого вещество разлагается на составные части, и получаются новые соединения. Такие реакции значительно отличаются у органических и неорганических веществ, солей, протеинов, липидов и прочих.

Что такое гидролиз
В общем виде уравнение выглядит так:
где MA — соль, HA — кислота, MOH — основание.
Что такое гидролиз солей? Это реакция обмена ионами между Н2О и растворимой солью. Если результат такого взаимодействия — соединения, которые плохо диссоциируют, то продуктами такого превращения будут слабые электролиты. Гидролиз как реакция — процесс, противоположный нейтрализации. В отличие от нее он эндотермический.
Он может идти обратимо и необратимо.
Какой процесс называется необратимым гидролизом? Реакция гидролиза необратима, если продукт реакции выводится из раствора, то есть осаждается или улетучивается в виде газа, а также если получается и газ, и осадок.
Это интересно! Как отличить металлы и неметаллы в таблице элементов Менделеева
Виды
То, как пойдет процесс, зависит от свойств основания и кислоты, образовавших конкретное соединение.
Обратите внимание! Соль сильной кислоты и сильного основания не гидролизуется, раствор будет с нейтральным pH.

Константа гидролиза
- По катиону и аниону. Соединение слабого основания и слабой кислоты, органическое или неорганическое, разлагается и по положительному, и по отрицательному иону. Получившийся раствор может иметь слабощелочную, слабокислую или нейтральную среду.
- По катиону. Разложение неорганических солей слабого основания и сильной кислоты проходит по катиону. Он соединяется с гидроксильным ионом ОН. Оставшиеся положительно заряженные частицы Н делают раствор кислотным. Так гидролизуется, например, сернокислая медь CuSO4.
- По аниону. Способность гидролизоваться по отрицательному иону свойственна солям сильных оснований и слабых кислот. Отрицательный ион кислотного остатка объединяется с частицей Н+ из Н2О, остается избыточное количество гидроксид-ионов. Поэтому pH в полученном растворе станет щелочным. Пример — KNO2. Если он прореагирует с Н2О, получится гидроксид калия KOH и азотистая кислота HNO2.
- Щелочной. Этот тип процесса характерен для органических соединений. Они гидролизуются в присутствии щелочи. Например, в присутствии NaOH гидролизуется C5H11Cl.
- Кислотный. Процесс в присутствии сильных неорганических кислот (серной, соляной) характерен только для органических соединений, таких как сложные эфиры.
- Ферментативный. Ферменты (энзимы) выступают катализаторами для расщепления биополимеров: белков, жиров, липоидов, крахмалов, гликогена и других. Именно такие процессы проходят в пищеварительном тракте.
- Ступенчатый гидролиз. Разложение в несколько стадий происходит, когда с H2O реагирует соль многоосновной кислоты или многокислотного основания. Сначала проходит разложение исходное соединение, возникает новая соль, она затем также гидролизуется. Таких ступеней может быть несколько. Na2CO3 — результат взаимодействия сильного основания и слабой кислоты. На первой стадии она разлагается по аниону, и получается NaHCO3. Далее идет ее сольволиз в водном растворе, получается слабая кислота H2CO3.
Полезное видео: гидролиз солей
Формула
Как делать эту реакцию? Для этого соль нужно поместить в воду, но они могут и не начать реагировать друг с другом. Реакция пойдет при наличии ионов слабого основания или слабой кислоты.
ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятно
Как записать уравнение реакции? Формула записывается по следующему алгоритму.
- Сначала пишут уравнение диссоциации. Это нужно, чтобы увидеть, из каких ионов состоит соединение, и определить тип процесса.
- Далее пишут полное ионное уравнение. В нем указывают заряд частиц.
- Далее отбрасывают одинаковые ионы справа и слева, получая сокращенное ионное уравнение. При этом можно узнать среду раствора. Если остался ион Н+, она кислая, если ОН- — щелочная.
- Затем записывают молекулярное уравнение. В нем «собирают» из заряженных частиц нейтральные. Чтобы уравнять число частиц справа и слева, подставляют нужные коэффициенты. Вместо знака «равно” везде пишут стрелки вправо и влево. Это значит, что процесс может идти и в одну, и в другую сторону.
Пример — уксуснокислый калий CH3COOK.
Уравнение диссоциации: CH3COOK⇄ CH3COO- + K+
Это соединение состоит из положительного иона сильной щелочи КОН и отрицательного — слабой СН3СООН. Реакция гидролиза идет по аниону.
Полное ионное уравнение:
CH3COO- + К+ +НОН ⇄CH3COOН + К+ +ОН-
Остался гидроксид-ион, значит pH щелочной.
Отбрасываем катионы калия с обеих сторон:
CH3COO- +НОН⇄СН3СООН +ОН-

Таблица 4-х типов солей
Степень гидролиза
Важно! Степень гидролиза — это его количественная характеристика. Это отношение количества гидролизовавшегося соединения к его общему количеству в процентах. Ее обозначают греческой буквой альфа или h_гидр.
От чего зависит эта величина?
- Чем более слабая кислота или основание, при взаимодействии которых получилась соль, тем больше h_гидр.
- Температура раствора. Чем он холоднее, тем меньше вещество способно гидролизоваться.
- Концентрация раствора. Если сильнее развести раствор водой, степень повышается — по принципу Ле-Шателье, идет сдвиг равновесия к продуктам.
- Наличие катализаторов. Это особенно характерно для органики.
Это интересно! Уроки химии: что это такое галогены
У соединения сильной кислоты и основания степень нулевая (разложения не происходит), а у слабых эта величина велика (почти вся соль гидролизуется).
Еще одна характеристика такого процесса разложения— константа гидролиза К_g. Это константа равновесия для гидролиза. Она показывает, насколько вещество склонно гидролизоваться.
Константу можно выразить через степень:
Обычно h_гидр — очень маленькое число, поэтому соотношение можно упростить: К_g = h_гидр2*С. Это соотношение справедливо для неорганических солей.

Константа гидролиза
Практическое применение и значение
- Они применяются для очищения воды от железа способом аэрации. Сквозь воду пропускают кислород, который окисляет растворенный в ней Fe(HCO3)2 до соли железа (III). Такая соль гидролизуется практически полностью. При этом выпадают в осадок нерастворимые кристаллы Fe(OH)3.
- Применяют этот процесс для удаления и других примесей из воды. Для этого добавляют соли алюминия. Если присутствуют гидрокарбонат-ионы, происходит их полное разложение, получается полигидрат оксида железа, который коагулирует и осаждается, собирая на себя примеси.
- Ферментативное разложение органических веществ происходит при пищеварении. Расщепление водой в присутствии ферментов используют также для производства пищевых продуктов, лечебного питания, лекарств. Например, белковые гидролизаты применяют для парентерального (внутривенного) питания больных.
- Разложение водой органических веществ имеет значение в химии, а именно в химической промышленности. Из крахмала получается глюкоза и патока, а при разложении водой целлюлозы — этанол. Разлагая водой торф, получают кормовые дрожжи, воск, удобрения.
- На этом процессе основана работа моющих средств. Мыло, например, распадается на ионы Na и углеводородный остаток. В жесткой воде сложно получить хорошую мыльную пену. В такой воде, где много ионов кальция и магния, они вступают во взаимодействие с углеводородным остатком, образуя плохо растворимые соединения.
- С помощью такой реакции можно обнаружить присутствие ионов висмута, сурьмы, бериллия.
Это интересно! Что такое ковалентная связь – полярная и неполярная
Полезное видео: гидролиз солей — классификация солей
Заключение
Источник: znaniya.guru
Процессы, происходяшие при гидролизе различных солей
Задача 601.
Указать, какой порядок расположения растворов равной молекулярной концентрации соответствует возрастанию рН: а) NH4Cl — NaNO3 — CH2ClCOONa — NaF — CH3COONa — NaCN; б) NaCN — CH3COON — NaF — CH2ClCOONa — NaNO3 — NH4Cl.
Решение:
KD(CH3COOH) = 1,8 . 10 -8 ; KD(HF) = 6,6 . 10 -8 ; KD(CH2ClCOOH) = 1,4 . 10-3; KD(HCN) = 7,9 . 10 -10 .
а) NH4Cl — соль слабого основания и сильной кислоты гидролизуется по катиону:
Наблюдается избыток ионов H + , поэтому раствор имеет кислую реакцию, рН < 7.
б) NaNO3 — соль сильного основания и сильной кислоты гидролизу не подвергается, поэтому раствор имеет нейтральную среду, рН = 7.
в) Соли CH2ClCOONa, NaF, CH2ClCOONa и NaCN являются солями сильного основания и слабой кислоты, поэтому в водных растворах будут гидролизоваться по аниону, что можно представить общей схемой:
R — + H2O ⇔ RH + OH — , где R — — однозарядный анион кислоты.
Наблюдается избыток ионов OH -, что придаёт растворам данных солей щелочную реакцию, рН > 7. Причём при равных молекулярных концентрациях растворов данных солей рН раствора будет возрастать с уменьшением значения константы диссоциации кислоты.
Значение констант гидролиза соли сильного основания и слабой кислоты тем выше, чем меньше значение константы диссоциации кислоты, образующей данную соль, соответственно степень гидролиза солей увеличивается с уменьшением константы диссоциации кислоты. Таким образом, чем меньше константа диссоциации кислоты, тем меньше будет значение рОН и, соответственно, больше значение рН раствора. Поэтому по возрастанию рН соли можно расположить в ряд:
Ответ: а).
Задача 602.
Раствор кислоты и раствор основания смешивают в эквивалентных соотношениях, для каких из перечисленных пар (кислота + основание) раствор будет иметь нейтральную реакцию: а) NH4OH + HCl; б) NH4OH + CH3COOH; в) NaOH + HCl; г) NaOH + CH3COOH.
Решение:
а) NH4OH + HCl ⇔ NH4Cl + H2O.
В результате реакции образуется NH4Cl — соль слабого основания и сильной кислоты, поэтому гидролиз соли протекает по катиону:
При гидролизе образуется дополнительное количество ионов H+, которые будут придавать раствору кислую реакцию, рН < 7.
б) NH4OH + CH3COOH ⇔ CH3COONH4 + H2O.
В результате реакции образуется CH3COONH4 — соль слабого основания и слабой кислоты, которая будет подвергаться гидролизу как по катиону, так и по аниону:
Так как константы диссоциации NH4OH и CH3COOH приблизительно равны 1,8 . 10 -5 , то соль будет в равной степени гидролизоваться и по катиону, и по аниону, образуя примерно равные количества ионов H+ и OH-, реакция среды будет нейтральной, рН = 7.
в) NaOH + HCl ⇔ NaCl + H2O.
В результате реакции образуется NaCl — соль сильного основания и сильной кислоты, которая не гидролизуется. Следовательно, реакция раствора хлорида натрия будет иметь нейтральную реакцию, рН = 7.
г) NaOH + CH3COOH ⇔ CH3COONa + H2O.
В результате реакции образуется CH3COONa — соль сильного основания и слабой кислоты, которая гидролизуется по аниону:
Образуется дополнительное количество ионов OH — , которые придают раствору щелочную реакцию, рН > 7.
Таким образом, из всех перечисленных пар (кислота + основание) раствор будет иметь нейтральную реакцию в парах б) NH4OH + CH3COOH; в) NaOH + HCl.
Ответ: б); в).
Задача 603.
Какие из перечисленных ниже солей, подвергаясь частичному гидролизу, образуют основные соли: а) Cr2(SO4)3; б) Na2CO3; в) AgNO3; г) AlCl3.
Решение:
а) Cr2(SO4)3 — соль слабого основания и сильной кислоты гидролизуется по катиону:
Cr 3+ + H2O ⇔ CrOH 2+ + H + ;
или в молекулярной форме:
Гидролиз данной соли преимущественно протекает по первой ступени с образованием основной соли CrOHSO4.
б) Na2CO3 — соль сильного основания и слабой двухосновной кислоты гидролизуется по аниону:
CO3 2- + H2O ⇔ HCO3 — + OH-, или в молекулярной форме:
Na2CO3 + H2O ⇔ NaHCO3 + NaOH.
При частичном гидролизе образуется кислая соль NaHCO3.
в) AgNO3 — соль слабого основания и сильной кислоты гидролизуется по катиону:
Ag + + H2O ⇔ AgOH + H + , или в молекулярной форме:
AgNO3 + H2O ⇔ AgOH + HNO3.
Продуктом гидролиза будет неустойчивый гидроксид серебра. В растворе будет избыток ионов , что придаёт раствору кислую реакцию, рН < 7.
г) AlCl3 — соль многоосновного основания и сильной кислоты, которая гидролизуется по катиону:
Al 3+ + H2O ⇔ AlOH 2+ + H + , или в молекулярной форме:
AlCl3 + H2O ⇔ AlOHCl2 + HCl.
При гидролизе хлорида алюминия по первой ступени образуется основная соль AlOHCl2 за счёт связывания друг с другом ионов AlOH 2+ и Cl — . В растворе будет избыток ионов H+, которые дополнительно образуются и при диссоциации HCl: HCl ⇔ H + + CL — , которые придают раствору кислую реакцию, рН < 7.
Ответ: а); г).
- Вы здесь:
- Главная

- Задачи

- Химия-Глинка

- Парциальное давление газов | Задачи 47 — 52
Источник: buzani.ru
Гидролиз солей
Гидролизом называют взаимодействие ионов соли с водой, которое приводит к образованию слабого электролита. По отношению к гидролизу различают четыре типа солей.
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются.
Соли, образованные сильным основанием и слабой кислотой, гидролизуются по аниону. Среда таких растворов щелочная (pH > 7), например:
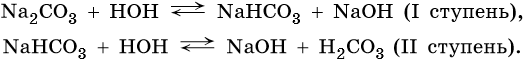
или в ионной форме
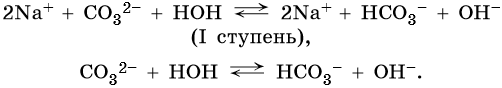
Гидролиз по второй ступени практически не протекает.
Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Среда таких растворов кислая (pH < 7,0), например:
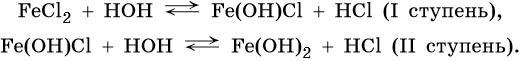
Гидролиз по второй ступени практически не идет.
Уравнение гидролиза по I ступени в ионной форме:
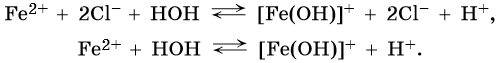
Соли, образованные слабым основанием и слабой кислотой, гидролизуются по катиону и аниону. Такие реакции часто идут полностью и до конца, гидролиз необратим. Реакция и pH среды растворов таких солей зависят от относительной силы кислот и оснований, например:
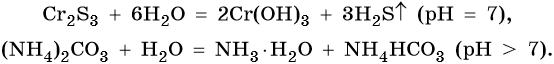
Гидролиз солей подчиняется принципу Ле Шателье и зависит от концентрации и температуры. При разбавлении растворов гидролиз усиливается, а при концентрировании замедляется. С повышением температуры резко возрастает концентрация ионов H + и OH – , поэтому гидролиз протекает полнее.
Гидролиз кислых солей имеет свои особенности. В этом случае наряду с гидролизом происходит диссоциация аниона кислой соли, поэтому реакция раствора может быть как щелочной (если гидролиз аниона преобладает над его диссоциацией), так и кислой (в обратном случае). Запомним некоторые примеры: Na2CO3 и NaHCO3 — щелочная; Na2SO3 — щелочная, а NaHSO3 — кислая; Na3PO4, Na2HPO4 — щелочная, а NaH2PO4 — кислая.
Перечислим еще ряд солей, определение реакции среды водных растворов которых вызывает затруднения у учащихся. AgNO3, CaCl2 — нейтральная, NaF, (NH4)2CO3 — слабощелочная, NH4F, MgCl2, Mg(NO3)2 — слабокислая. NH4NO2 — гидролиз по катиону и аниону.
Рассмотрим типовой пример задания.
Пример. Установите соответствие между названием соли и ее способностью к гидролизу.

Ацетат калия — соль, образованная анионом слабой уксусной кислоты и катионом сильного основания — гидроксида калия, следовательно, она гидролизуется по аниону. Сульфид калия также образован анионом слабой кислоты (H2S) и катионом сильного основания (KOH). Гидролиз по аниону. Хлорид железа (II) образован анионом сильной кислоты (HCl) и катионом слабого основания Fe(OH)2.
Гидролиз по катиону. Сульфид хрома (III) образован катионом слабого основания Cr(OH)3 и анионом слабой кислоты Н2S, поэтому подвергается гидролизу по катиону и аниону.
Ответ: А – 3; Б – 3; В – 2; Г – 4;
Источник: himi4ka.ru