Аппаратура и материалы: р-р глюкозы; 0, 5 н. р-р NaOH; 0, 5 н. р-р CuSO4; вода дистиллированная; спиртовой раствор йода; р-р крахмала; аммиачный р-р оксида серебра.
Методика и порядок выполнения работы
Опыт 1. Действие гидроксида меди (II) на глюкозу
1. В пробирку прилейте 0, 5 мл раствора глюкозы и 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора медного купороса. Что наблюдается? Напишите уравнения реакции.
2. К полученному раствору аккуратно добавьте 1 мл воды и нагрейте на пламени горелки пробирку, укрепив ее наклонно так, чтобы нагревалась только верхняя часть раствора. Прекратите нагревание, как только начнется изменение цвета. Почему при нагревании происходит изменение цвета реакционной смеси? Напишите уравнения реакции.
Опыт 2. Действие йода на крахмал
1. Приготовьте крахмальный клейстер по следующей методике: в стакан с 20 мл воды, нагретой до кипения, добавьте 2 г крахмала, хорошо размешайте образовавшуюся суспензию до образования прозрачного коллоидного раствора – крахмального клейстера или получите готовый раствор.
Глюкоза строение, свойства, применение | Химия 10 класс #38 | Инфоурок
2. Налейте в пробирку 2 – 3 мл охлажденного клейстера и добавьте несколько капель спиртового раствора йода. Отметьте изменение цвета. Нагрейте смесь в пробирке. Какие изменения наблюдаются? Данная реакция является качественной реакцией на крахмал.
Опыт 3. Действие аммиачного раствора оксида серебра на глюкозу
В пробирку, содержащую 1 – 2 мл раствора глюкозы в воде, прилейте
1 – 2 мл аммиачного раствора оксида серебра и нагрейте пробирку на кипящей водяной бане. Что наблюдается? Какая форма глюкозы (открытая или циклическая) дает реакцию «серебряного зеркала»? Напишите уравнение реакции.
Получение и исследование химических свойств альдегидов и кетонов
Методика и выполнение работы:
Опыт 1. Цветные реакции на карбонильные соединения
Аппаратура и материалы:
10%-ный раствор формальдегида; ацетон, концентрированная серная кислота; 0, 5%-ный раствор резорцина (свежеприготовленный); 0, 5%-ный водный раствор нитропруссида натрия, 1М раствор гидроксида натрия; пипетки; штатив с пробирками.
Качественная реакция на формальдегид с резорцином.
В пробирку наливают 2–3 мл 0, 5%-ного раствора резорцина и 1 мл 10%-ного раствора формальдегида. На полученную смесь осторожно по стенке пробирки наслаивают пипеткой 1–2 мл концентрированной серной кислоты. Что наблюдаете на границе двух жидкостей?
Реакция альдегидов и кетонов с нитропруссидом натрия
Налейте в одну пробирку 1 мл уксусного альдегида, во вторую – такой же объем ацетона. К полученным растворам прилейте по несколько капель 1М раствора гидроксида натрия и раствор нитропруссида натрия. Что наблюдаете? Какие изменения происходят через некоторое время?
Опыт 2. Окисление формальдегида аммиачным раствором гидроксида серебра.
Аппаратура и материалы:
5%-ный раствор формальдегида; 1%-ный раствор нитрата серебра, 5%-ный раствор аммиака (в капельнице); штатив с пробирками.
Реакция глюкозы с гидроксидом меди (II)
В пробирку налейте 2–3 мл 15%–ного раствора нитрата серебра при встряхивании по каплям прибавляйте к нему 5%-ный раствор аммиака до тех пор, пока образующийся вначале осадок полностью не растворится:
К прозрачному, бесцветному аммиачному раствору гидроксида серебра прибавьте несколько капель 5%-ного раствора формальдегида. Пробирку несколько минут нагревайте на газовой горелке до начала побурения раствора (до кипения не доводить).
Далее реакция идет без нагревания, и металлическое серебро выпадает в виде черного осадка или осаждается на стенках пробирки в виде блестящего серебряного налета («серебряное зеркало»). Написать уравнение происходящей реакции. Вступают ли в реакцию кетоны? Приведите объяснения.
Контрольные вопросы:
1.Какая реакция является качественной на крахмал?
2. Написать уравнение реакции «серебряного зеркала»?
3. Какие спирты образуются при восстановлении водородом следующих соединений: а) пропионового альдегида; б) метилэтилкетона; в) 2–метилпропаналя?
4. Окислили 2 моль метанола, образовавшийся при этом метаналь, растворили в 200 г воды. Вычислите массовую долю метаналя (%) в полученном растворе.
ЛАБОРАТОРНАЯ РАБОТА № 18
«ИЗУЧЕНИЕ СВОЙСТВ АММИНОВ, АМИНОКИСЛОТ И БЕЛКОВ»
Изучить в лабораторных условиях химические свойства аминов, аминокислот, белков.
Аппаратура и материалы: анилин; дистиллированная вода; HCl; NaOH; CuO кристаллический; глицерин; куриный белок; концентрированная азотная кислота; р-р медного купороса.
Методика и выполнение работы
Опыт 1. Образование солей анилина
В пробирку прилейте 0, 5 мл анилина и 3 мл воды. Взболтайте. Что наблюдается? В пробирку добавьте соляной кислоты до полного растворения анилина в воде. К раствору добавьте 1 – 2 мл раствора щелочи.
Что наблюдаете?
Почему при добавлении соляной кислоты происходит растворение анилина? Напишите уравнение реакции.
Почему при добавлении щелочи анилин выделяется из водного раствора? Напишите уравнение реакции.
Опыт 2. Получение медной соли глицерина
В пробирку, содержащую 2 мл раствора глицерина, добавьте 1 г порошка оксида меди (II) и нагрейте до кипения. Чем обусловлено появление голубой окраски раствора? Каково строение образующейся соли?
Опыт 3. Денатурация белка
Приготовьте раствор белка. Для этого белок куриного яйца растворите в 150 мл воды. В пробирку налейте 4 – 5 мл раствора белка и нагрейте на горелке до кипения. Отметьте помутнение раствора. Охладите содержимое пробирки.
Разбавьте водой в 2 раза.
Почему раствор белка при нагревании мутнеет?
Почему образующийся при нагревании осадок не растворяется осадок при охлаждении и разбавлении водой?
Опыт 4. Цветные реакции белков
1. Ксантопротеиновая реакция. В пробирку налейте 2 – 3 мл раствора белка и прибавьте несколько капель концентрированной азотной кислоты. Нагрейте содержимое пробирки, при этом образуется желтый осадок. Охладите смесь и добавьте аммиак до щелочной реакции (проба на лакмус). Окраска переходит в оранжевую.
2. Биуретовая реакция. В пробирку налейте 2 – 3 мл раствора белка и 2 – 3 мл раствора гидроксида натрия, затем 1 – 2 мл раствора медного купороса. Появляется фиолетовое окрашивание.
Контрольные вопросы:
1. Какие типы связей характерны для белков?
2. Охарактеризуйте свойства анилина?
ЛАБОРАТОРНАЯ РАБОТА № 19
«ИДЕНТИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ»
Основываясь на полученных знаниях и изучив теоретический материал, научиться идентифицировать органические вещества.
Аппаратура и материалы:
Спиртовка и набор реактивов.
Методика и выполнение работы
В вашем распоряжении имеется спиртовка и набор реактивов:
1) водный раствор NaOH;
4) водный раствор KMnO4
6) водный раствор;
7) аммиачный раствор оксида серебра;
В двух пробирках содержатся следующие вещества:
I вариант: а) глюкоза;
II вариант: а) уксусная кислота;
б) этиловый спирт;
III вариант: а) глюкоза;
С помощью минимального числа реагентов (указанных в начале работы) определите содержимое в каждой паре пробирок. Напишите уравнения соответствующих реакций.
Контрольные вопросы:
1. Опишите химические свойства глюкозы и сахарозы?
2. Какие типы химических реакций характерны для спиртов и карбоновых кислот?
ПРИЛОЖЕНИЕ
Таблица 1 – Плотность растворов NaCl и H2SO4 при 20 о С
| Массовая доля, ω, % | Плотность растворов, ρ, г/см 3 |
| NaCl | H2SO4 |
| 1, 007 | |
| 1, 014 | 1, 012 |
| 1, 022 | |
| 1, 029 | 1, 025 |
| 1, 036 | |
| 1, 044 | 1, 038 |
| 1, 051 | |
| 1, 058 | 1, 052 |
| 1, 065 | |
| 1, 073 | 1, 066 |
| 1, 081 | |
| 1, 089 | 1, 080 |
| 1, 096 | |
| 1, 104 | 1, 095 |
| 1, 119 | 1, 109 |
| 1, 124 | |
| 1, 139 | |
| 1, 155 | |
| 1, 170 | |
| 1, 186 | |
| 1, 202 | |
| 1, 219 | |
| 1, 235 |
Таблица 2 – Константы диссоциации некоторых слабых электролитов в водных растворах при 25˚ С
| Химическая формула | Название электролита | Константа диссоциации |
| Йодноватая кислота | ||
| Сернистая кислота | ||
| Фосфорная кислота | ||
| Фтороводородная кислота | ||
| Азотистая кислота | ||
| Муравьиная кислота | ||
| Уксусная кислота | ||
| Угольная кислота | ||
| Сероводородная кислота | ||
| Хлорноватистая кислота | ||
| Циановодородная кислота | ||
| Борная кислота | ||
| Кремниевая кислота | ||
| Йодноватистая кислота | ||
| Гидроксид свинца | ||
| Гидроксид аммония | ||
| Вода |
Таблица 3 – Стандартные электродные потенциалы металлов
| Электрод | Электродная реакция | Е 0 , В |
| Li + /Li | Li + + = Li | -3, 045 |
| K + /K | K + + = K | -2, 925 |
| Rb + /Rb | Rb + + = Rb | -2, 925 |
| Cs + /Cs | Cs + + = Cs | -2, 923 |
| Са 2+ /Са | Са 2+ + = Са | -2, 866 |
| Na + /Na | Na + + = Na | -2, 714 |
| Мg 2+ /Мg | Мg 2+ + 2 = Мg | -2, 363 |
| Аl 3+ /Аl | Аl 3+ + 3 = Аl | -1, 662 |
| Мn 2+ /Мn | Мn 2+ + 2 = Мn | -1, 179 |
| Zn 2+ /Zn | Zn 2+ + 2 = Zn | -0, 763 |
| Сr 3+ /Сr | Сr 3+ + 3 = Сr | -0, 744 |
| Fе 2+ /Fе | Fе 2+ + 2 = Fе | -0, 440 |
| Сd 2+ /Сd | Сd 2+ + 2 = Сd | -0, 403 |
| Со 2+ /Со | Со 2+ + 2 = Со | -0, 277 |
| Ni 2+ /Ni | Ni 2+ + 2 = Ni | -0, 250 |
| Sn 2+ /Sn | Sn 2+ + 2 = Sn | -0, 136 |
| Рb 2+ /Рb | Рb 2+ + 2 = Рb | -0, 126 |
| Н+/½ Н2 | Н + + = ½ Н2 | ± 0, 000 |
| Сu 2+ /Сu | Сu 2+ + 2 = Сu | +0, 337 |
| Нg2 2+ /Hg | Нg2 2+ + 2 = Hg | +0, 788 |
| Ag + /Ag | Ag + + = Ag | +0, 799 |
| Аu 3+ /Аu | Аu 3+ + 3 = Аu | +1, 498 |
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1. Рудзитис, Г.Е. Химия. Органическая химия. 10 кл. [Текст]: учебник для общеобразовательных учреждений с прил. на электрон. носителе: базовый уровень / Г.Е.Рудзитис, Ф.Г.Фельдман. – 13-е изд. – М.: Просвещение, 2009. – 192 с
2. Рудзитис, Г.Е. Химия. Основы общей химии 11 кл. [Текст]: учебник для общеобразовательных учреждений с прил. на электрон. носителе: базовый уровень / Г.Е.Рудзитис, Ф.Г.Фельдман. – 12-е изд. – М.: Просвещение, 2009. – 159 с.
3. Глинка, Н.Л. Общая химия [Текст]: учебник / под ред. В.А.Попкова, А.В.Бабкова. – 17-е изд., перераб. и доп– М.: Издательство Юрайт; ИД Юрайт, 2010 – 886 с.
Источник: lektsia.com
Глюкоза
Области знаний: Органическая химия, Органические соединения Другие наименования: Виноградный сахар Брутто-формула: C₆H₁₂O₆ Молярная масса: 180,16 г/моль Агрегатное состояние: Твёрдое Плотность при н. у.: 1,562 г/см³
Химические соединения Химические соединения
Глюкоза
Глюко́за (от греч. γλυκύς – сладкий) [виноградный сахар, декстроза, (2R,3S,4R,5R)-2,3,4,5,6-пентагидроксигексаналь, (2R,3S,4R,5R)-6-(гидроксиметил)тетрагидро-2H-пиран-2,3,4,5-тетраол, 6-(гидроксиметил)оксан-2,3,4,5-тетраол], органическое соединение, альдоза, моносахарид группы гексоз, CH2OH(CHOH)4CHO. В природе имеет D-конфигурацию; существует в виде циклических полуацеталей с образованием 6-членных колец: α-D-глюкопираноза и β-D-глюкопираноза. Молярная масса 180,16 г/моль. Плотность 1,562 г/см 3 . Температура плавления 146 °C (безводная α-D-глюкопираноза), 83 °C (моногидрат α-D-глюкопиранозы), 148–150 °C (безводная β-D-глюкопираноза). В чистом виде глюкоза впервые была выделена из виноградного сока (1747, А. Маргграф).
Глюкоза является самым распространенным в природе моносахаридом, служит универсальным, а для некоторых тканей, например мозга, и единственным источником энергии.
Физико-химические свойства
Глюкоза – бесцветное кристаллическое вещество, обладающее сладким вкусом, хорошо растворимо в воде [для α-D-глюкопиранозы: 32,3 г/100 мл (0 °C), 82 г/100 мл (25 °C), для β-D-глюкопиранозы: 154 г/100 мл (15 °C)], растворимо в 80 %-ном этиловом спирте [2 г/100 мл (α-D-глюкопираноза), 4,9 г/100 мл (β-D-глюкопираноза)], горячем этиловом спирте, горячем пиридине , малорастворимо в метиловом спирте , нерастворимо в ацетоне , диэтиловом эфире .
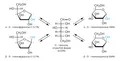
α-D-глюкоза и β-D-глюкоза образуют кристаллы с удельным вращением [α]=+112,2° и +18,7° соответственно. При растворении в воде между двумя формами устанавливается равновесие – происходит медленное изменение оптического вращения (мутаротация) до [α]=+52,7°. В равновесной смеси содержится 64% β-формы, 36% α-формы и следовые количества 5-членных циклических форм (фураноз) и открытой (альдегидной) формы глюкозы.
Глюкоза вступает во все реакции, типичные для моносахаридов . Под действием боргидрида натрия D-глюкоза восстанавливается до D-глюцита ( сорбита ). Окисление азотной кислотой приводит к образованию D-глюкаровой кислоты. Использование более мягких окислителей (бромная вода) позволяет получение D- глюконовой кислоты . На способности альдоз, в частности глюкозы, восстанавливать катионы металлов основаны качественные реакции на сахара с реактивами Толленса (аммиачный раствор оксида серебра; реакция «серебряного зеркала»), Бенедикта и Фелинга (оба содержат сульфат двухвалентной меди в щелочном растворе; выпадает красный осадок оксида одновалентной меди).
Окислительная деградация глюкозы метапериодатом натрия приводит к образованию формальдегида и муравьиной кислоты . В результате реакции с избытком фенилгидразина образуются озазоны. Глюкоза вступает в реакцию этерификации с ангидридами карбоновых кислот. Гликозидный (полуацетальный) гидроксил глюкозы легко замещается на другие нуклеофилы. Глюкоза образует алкоголяты (сахараты) со щелочными и щелочноземельными металлами и их гидроксидами. Под действием последних может происходить как усложнение (путем альдольной конденсации), так и деградация (путем ретроальдольного распада) углеродной цепи.
Способы получения
В промышленных масштабах глюкозу получают путём кислотного или ферментативного гидролиза картофельного или кукурузного крахмала .
Участие в обмене веществ
Глюкоза образуется в результате фотосинтеза (в растениях) и в процессе глюконеогенеза (у животных). В свободном состоянии она накапливается в цветках и плодах растений (особенно много глюкозы содержится в виноградном соке), присутствует в крови человека (0,1%). Основные количества природной глюкозы находятся в связанном виде в форме различных гликозидов , резервных дисахаридов ( сахароза растений, лактоза животных, трегалоза насекомых и грибов) и полисахаридов (крахмал растений, гликоген животных, декстраны бактерий) и структурных полисахаридов ( целлюлоза и гемицеллюлозы растений, глюканы грибов).
Основное физиологическое назначение катаболизма глюкозы заключается в использовании энергии, освобождающейся в этом процессе, для синтеза АТФ .
Метаболиты гликолиза используются для синтеза новых соединений: рибозо-5-фосфата – структурного компонента нуклеотидов ; аминокислот , таких как серин , глицин , цистеин . В печени и жировой ткани ацилированное производное кофермента А , образующееся из пирувата , используется как субстрат при биосинтезе жирных кислот , холестерина .
Важное значение имеют производные глюкозы, содержащие карбоксильную группу: глюкуроновая кислота , образуя растворимые конъюгаты с токсичными веществами, участвует в детоксикации организма; гликозаминогликаны играют важную роль в межклеточных взаимодействиях, формировании и поддержании формы клеток и органов, образовании каркаса при формировании тканей.
Применение
Глюкозу применяют в медицине: для восполнения потери крови в виде изотонического раствора , при явлениях сердечной недостаточности, шоке, отравлениях и др. Глюкоза является исходным соединением при производстве аскорбиновой кислоты ; применяется в пищевой промышленности. Превращения глюкозы в условиях брожения лежат в основе биотехнологического получения этилового спирта и ряда других ценных продуктов.
Редакция химических наук
Источник: bigenc.ru
Глюкоза — представитель моносахаридов, строение, физические и химические свойства, применние.
Глюкоза С6Н12О6 – моносахарид, не гидролизующийся с образованием более простых углеводов.

Как видно из структурной формулы, глюкоза является одновременно многоатомным спиртом и альдегидом, то есть альдегидоспиртом. В водных растворах глюкоза может принимать циклическую форму.
Физические свойства
Глюкоза – бесцветное кристаллическое вещество со сладким вкусом, хорошо растворимое в воде. По сравнению со свекловичным сахаром менее сладкая.
Химические свойства
Глюкоза обладает химическими свойствами, характерными для спиртов и альдегидов. Кроме того, она обладает и некоторыми специфическими свойствами.
1. Глюкоза – многоатомный спирт.
Глюкоза с Cu(OH)2 даёт раствор синего цвета (глюконат меди)
2. Глюкоза – альдегид.
а) Реагирует с аммиачным раствором оксидом серебра с образованием серебряного зеркала:
б) С гидроксидом меди даёт красный осадок Cu2O
в) Восстанавливается водородом с образованием шестиатомного спирта (сорбита)
а) Спиртовое брожение (для получения спиртных напитков)

С6H12O6 → 2СH3–CH2OH + 2CO2
б) Молочнокислое брожение (скисание молока, квашение овощей)
Применение, значение
Глюкоза образуется в растениях в процессе фотосинтеза. Животные получают её с пищей. Глюкоза – главный источник энергии в живых организмах. Глюкоза является ценным питательным продуктом. Применяется в кондитерском деле, в медицине как укрепляющее средство, для получения спирта, витамина С и др.
Крахмал. Нахождение в природе, гидролиз крахмала, применение.
Крахмал (C6H10O5)n — аморфный порошок белого цвета, без вкуса и запаха, плохо растворим в воде, в горячей воде образует коллоидный раствор (клейстер). Макромолекулы крахмала построены из большого числа остатков α-глюкозы. Крахмал состоит из двух фракций: амилозы и амилопектина. Амилоза имеет линейные молекулы, амилопектин – разветвлённые.
Биологическая роль.
Крахмал – один из продуктов фотосинтеза, главное питательное запасное вещество растений. Крахмал – основной углевод в пище человека.
Получение.
Крахмал получают чаще всего из картофеля. Для этого картофель измельчают, промывают водой и перекачивают в большие сосуды, где происходит отстаивание. Полученный крахмал ещё раз промывают водой, отстаивают и сушат в струе теплого воздуха.
Химические свойства.
1. С иодом крахмал даёт фиолетовое окрашивание.
2. Крахмал – многоатомный спирт.
3. Крахмал сравнительно легко подвергается гидролизу в кислой среде и под действием ферментов:
В зависимости от условий гидролиз крахмала может протекать ступенчато, с образованием различных промежуточных продуктов:
крахмал растворимый декстрины мальтоза глюкоза
Происходит постепенное расщепление макромолекул.
Применение крахмала.
Крахмал применяется в кондитерском производстве (получение глюкозы и патоки), является сырьём для производства этилового, н-бутилового спиртов, ацетона, лимонной кислоты, глицерина и так далее. Он используется в медицине в качестве наполнителей (в мазях и присыпках), как клеящее вещество.
Крахмал является ценным питательным продуктом. Чтобы облегчить его усвоение, содержащие крахмал продукты подвергают действию высокой температуры, то есть картофель варят, хлеб пекут. В этих условиях происходит частичный гидролиз крахмала и образуются декстрины, растворимые в воде.
Декстрины в пищеварительном тракте подвергаются дальнейшему гидролизу до глюкозы, которая усваивается организмом. Избыток глюкозы превращается в гликоген (животный крахмал). Состав гликогена такой же, как у крахмала, – (C6H10O5)n, но его молекулы более разветвлённые.
Дата добавления: 2018-02-15 ; просмотров: 10493 ; Мы поможем в написании вашей работы!
Источник: studopedia.net