· Обновлено 25 октября 2022
Углерод — это химический элемент, неметалл, расположенный в таблице Д. И. Менделеева в главной подгруппе IV группы, во 2-м периоде, имеет порядковый номер 6.
Агрегатное состояние углерода при нормальных условиях — твердое вещество с атомной кристаллической решеткой. Молекула углерода одноатомна. Химическая формула углерода — С.
Строение углерода
В нейтральном атоме углерода находится шесть электронов. Два из них расположены вблизи ядра и образуют первый слой (1s-состояние). Следующие четыре электрона образуют второй электронный слой. Два из четырех электронов находятся в 2s-состоянии, а два других — в 2р-состоянии. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s 2 2s 2 2р 2 .
ГРАФИТ. Свойства, сферы применения, где купить.
Несмотря на наличие двух неспаренных электронов на внешнем уровне, в большинстве химических соединений углерод четырехвалентен. Возможность образовывать четыре связи углерод получает при переходе одного электрона из состояния 2s в 2р — происходит «распаривание», т. е. переход атома углерода из нейтрального состояния в возбужденное. Этому возбужденному состоянию атома углерода соответствует электронная конфигурация 1s 2 2s 1 2p 3 .
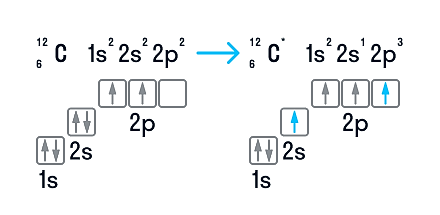
Возможные валентности: II, IV.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
![]()
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков

Аллотропия углерода
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Выделяют два вида углерода в зависимости от образования модификаций:
- Кристаллический углерод входит в состав твердых веществ (алмаз, графит, графен, фуллерен, карбин).
- Аморфный углерод образует мягкие вещества (уголь, кокс, сажа).
Рассмотрим подробнее основные аллотропные модификации углерода, их физические свойства и применение.
Алмаз
Алмаз — трехмерный полимер, бесцветное кристаллическое вещество, самый твердый природный минерал, имеет высокую теплопроводность. Его используют в промышленности для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что алмаз твердый, в то же время он хрупкий. Получающийся при измельчении алмаза порошок применяют для шлифовки драгоценных камней. Хорошо отшлифованные прозрачные алмазы называют бриллиантами.
Графит и его прекрасные свойства | ElectroBOOM
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Одно из уникальных свойств алмазов — способность преломлять свет (люминесценция). При действии излучения алмазы начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. При этом необработанный алмаз не обладает такими качествами.
В промышленных масштабах алмазы получают при высоком давлении (тысячи МПа) и высоких температурах (1 500–3 000 °С). Процесс протекает в присутствии катализатора (например, Ni).
При нагревании алмаза до 1 000 °С и высоком давлении без доступа воздуха получают графит. При температуре 1 750 °С переход из алмаза в графит протекает существенно быстрее. При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода.
Графит
Графит — темно-серое мягкое кристаллическое вещество со слабым металлическим блеском. Хорошо электро- и теплопроводен, стоек при нагревании в вакууме. Имеет слоистую структуру. На поверхности оставляет черные черты. На ощупь графит жирный и скользкий.
Графит термодинамически устойчив, поэтому в расчетах термодинамических величин он принимается в качестве стандартного состояния углерода.
На воздухе графит не загорается даже при сильном накаливании, но легко сгорает в чистом кислороде с образованием диоксида углерода.
При температуре 3 000 °С в электрических печах получают искусственный графит из лучших сортов каменного угля.
Графен
Графен представляет собой монослой графита. Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при помощи нагревания кремниевых пластин, верхний слой которых состоит из карбида кремния. Под действием высоких температур происходит отщепление атомов углерода, которые остаются на пластинке в виде графена, а кремний испаряется. Графен представляет собой тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
Карбин
Карбин — твердое черное вещество. Состоит из линейных полимерных цепей, которые соединены чередующимися одинарными и тройными связями в линейные цепочки: −С≡С−С≡С−С≡С−.
Впервые карбин был открыт в 60-х годах, но его существование не признавали до тех пор, пока его не обнаружили в природе — в метеоритном веществе.
Карбин — полупроводник, под действием света его проводимость сильно увеличивается. Переход в графит возможен при нагревании до 2 300 °С.
Карбин применяют в медицине для изготовления искусственных кровеносных сосудов.
Уголь
Уголь — мельчайшие кристаллики графита, полученные путем термического разложения углеродсодержащих соединений без доступа воздуха.
Угли имеют разные свойства в зависимости от веществ, из которых получены. Наиболее важные сорта угля — кокс, древесный уголь, сажа.
- Кокс получается при нагревании каменного угля без доступа воздуха. Применяется в металлургии при выплавке металлов из руд.
- Древесный уголь образуется при нагревании дерева без доступа воздуха. Благодаря пористому строению он обладает высокой адсорбционной способностью.
- Сажа — очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скип@$https://skysmart.ru/articles/chemistry/khimiya-ugleroda» target=»_blank»]skysmart.ru[/mask_link]
Основные свойства природного графита

Минералы и горные породы / Описание минерала Графит
Графиты — вещества серого цвета с металлическим блеском, аморфного, кристаллического, или волокнистого сложения, жирные на ощупь, удельный вес от 1,9 до 2,6. По внешнему виду графит, имеет металлический свинцово-серый цвет, колеблющейся от серебристого до черного, с характерным жирным блеском.
Поэтому потребители зачастую называют явнокристаллические графиты серебристыми, а скрытокристаллические — черными.На ощупь графит жирен и отлично пачкается. На поверхностях он легко дает черту от серебристого до черной, блестящей. Графит отличается способностью прилипать к твердым поверхностям, что позволяет создавать тонкие пленки при натирании им поверхностей твердых тел.
Графит представляет собой алоторопную форму углерода, которая характеризуется определенной кристаллической структурой, имеющей своеобразное строение.
В зависимости от структурного строения графиты делятся на:
- явнокристаллические,
- скрытокристаллические,
- графитоиды,
- высокодисперсные графитовые материалы, обычно называемые углями.
В свою очередь, явнокристаллические графиты по величине и структуре кристаллов делятся на: - плотнокристаллические (Боготольское месторождение графита),
- чешуйчатые (Тайгинское месторождение графита).
В чешуйчатых графитах кристаллы имеют форму пластинок или листочков. Чешуйки их жирные, пластичные и имеют металлический блеск.
Важнейшие свойства графита
Электрические свойства
Электропроводность графита в 2,5 раза больше электропроводности ртути. При температуре 0 град. удельное сопротивление электрическому току находится в пределах от 0,390 до 0,602 ом. Низкий предел удельного сопротивления для всех видов графита одинаков и равен 0,0075 ом.
Термические свойства
Графит обладает большое теплопроводностью, которая равняется 3,55вт*град/см и занимает место между палладием и платиной.
Коэффициент теплопроводности 0,041( в 5 раз больше, чем у кирпича). У тонких графитовых нитей теплопроводность выше, чем у медных.
Температура плавления графита — 3845-3890 С при давлении от 1, до 0,9 атм.
Точка кипения доходит до 4200 С.
Температура воспламенения в струе кислорода составляет для явнокристаллических графитов 700-730С. Количество тепла, получаемого при сжигании графита, находится в пределах от 7832 до 7856 ккал.Магнитные свойства
Графит считается диамагнитным.
Растворимость графита
Химически инертен и не растворяется ни в каких растворителях, кроме расплавленных металлов, особенно тех, у которых высокая точка плавления. При растворении образуются карбиды, наиболее важными свойствами которых являются карбиды вольфрама, титана, железа, кальция и бора.
При обычных температурах графит соединяется с другими веществами весьма трудно, но при высоких температурах он дает химические соединения со многими элементами.Упругость графита
Графит не обладает эластичностью, но тем не менее он может быть подвергнут резанию и изгибанию. Графитовая проволока легко сгибается и закручивается в спираль, а при вальцевании дает удлинение около 10%. Сопротивление на разрыв такой проволоки равно 2 кг/мм 2 , а модуль изгиба равен 836 кг/мм2.
Оптические свойства
Коэффициент светопоглощения графита постоянен для всего спектра и не зависит от температуры лучеиспускания тела; для тонких графитовых нитей он равен 0,77, с увеличением кристаллов графита светопоглащение уже находится в пределах 0,52-0,55.
Жирность и пластичность графита являются важнейшими свойствами, которые дают возможность широко применять его в промышленности. Чем выше жирность графита, тем меньше коэффициент трения. От жирности графита зависит использование его в качестве смазочного материала, а также способность прилипания к твердым поверхностям.
Благодаря этим свойствам имеется возможность создавать тонкие пленки при натирании графитом поверхности твердых тел.
Низкий коэффициент теплового расширения графита и связанная с этим высокая стойкость к температурным напряжениям, является решающим фактором применения его, как важного и незаменимого вспомогательного материала в металлообрабатывающей, чугунолитейной и сталелитейной промышленности, т.е. всюду, где рабочие поверхности должны предохраняться от прямого воздействия расплавленного металла. Важным преимуществом при таком использовании является также его несмачиваемость, полностью восстановленными металлами и нейтральными шлаками, прочность при высоких температурах. Применение графита при отливе деталей повышает качество отливов, уменьшает количество брака, и предупреждает образование пригара, на удаление которого требуется большие усилия и затраты.
Сырые литейные формы и стержни покрываются слоем сухого графитового порошка. Чистый графит имеет низкий коэффициент поглощения нейтронов и самый высокий коэффициент замедления, благодаря чему он незаменим в атомных реакторах. Без графитовых электродов немыслимо развитие черной и цветной, химической промышленности.
Графит прекрасный футеровочный материал электролизеров для получения алюминия. Углеродосодержащие материалы применяются для строительства электропечей и других тепловых агрегатов.
Из графита готовятся тигли, лодочки для производства сверхтвердых сплавов.
В химической промышленности материалы из графита незаменимы для производства теплообменников, работающих в агрессивных средах.А так же для изготовления нагревателей, конденсаторов, испарителей, холодильников, скрубберов, дистилляционных колонн, форсунок, сопел, кранов, деталей для насосов, фильтров.
Отечественная промышленность в большом ассортименте выпускает графитовые электрощетки для различных электрических машин, электрические осветительные угли для прожекторов и для демонстрации и съемок кинофильмов, элементные — гальванических батарей, сварочные и для спектрального анализа, изделия для электровакуумной техники и техники связи.В машиностроении графит используется как антифрикционный материал для подшипников, колец трения, торцевых и поршневых уплотнений, подпятников.
Источник: catalogmineralov.ru
Какая химическая формула графита и где применяют минерал?
Графит относится к природным минералам, является прочным элементом и широко применяется в сфере промышленности.

Молярная масса равна г/моль.
Физические свойства – это относительно мягкое твёрдое вещество с плотностью 2,08—2,23 г/см
, жирное на ощупь черного или серо-черного цвета с металлическим блеском.
Хорошо проводит электрический ток. Имеет низкую твёрдостью (1 по шкале Мооса). Не плавится, сублимируется при , устойчив при нагревании в отсутствие кислорода.

Кристаллическая решетка графита гексагональная (а = 0,24612 нм, с = 0,67079 нм, z = 4). Она состоит из параллельных слоев, которые образованны из правильных шестиугольников, состоящих из атомов углерода. Атомы С каждого слоя находятся напротив центров шестиугольников, которые располагаются в соседних слоях; положение этих слоев повторяется через один, а каждый из них сдвинут относительно друг друга в горизонтальном направлении на 0,1418 нм.
На рисунке ниже показана кристаллическая решетка графита (А, В – это углеродные слои; пунктирными линиями показана элементарная кристаллическая ячейка).

Химические свойства графита
Графит взаимодействует с окислителями и с сильными восстановителями:

Графит в природе
В природе содержится в гранитах, пирите. Он образуется в магматических и вулканических горных породах, скарнах и пегматитах при высоких температурах, встречается в кварцевых жилах с различными материалами, широко распространен в мраморе, кристаллических сланцах, гнейсах. В результате пиролиза под воздействием на каменноугольные отложения траппов образуются крупные залежи природного минерала.
- Содержание минералов 2.0%
- Содержание углерода > 98.0%
- Содержание серы 550 ppm
- Температурный диапазон -200…3000°C
- Выщелачиваемый хлорид 50 ppm
- Сжимаемость 40%
- Регенерация 15%
- pH диапазон 0-14
- Проседание под нагрузкой
Виды природного графита:
- тигельный (используется для производства огнеупорных изделий. Он отличается повышенной теплопроводностью и стойкостью к резким температурным перепадам),
- литейный кристаллический (имеет низкий коэффициент расширения, характеризуется прочностью при высоких температурах, используется при отливе деталей),
- аккумуляторный (применяется как добавка, графит используется для производства электродов, отличается повышенными техническими и химическими свойствами),
- для производства стержней для карандашей (тонкодисперсный, мягкий, не содержит примесей железа),
- элементный (графит используется для производства гальванических элементов, отличается повышенной тепло- и электропроводностью),
- электроугольный,
- для изготовления смазок и электропроводящей резины.
Получение графита
В промышленности графит получают с помощью нагревания смеси кокса и пека до
Другой способ – это нагревание газообразных углеводородов до в вакууме с получением пироуглерода, который далее нагревают до при давлении 50 МПа с образованием пирографита.
Искусственный графит — область применения
Искусственно производится конструкционный, мелкозернистый, антифрикционный и литейный графит. Область применения материала достаточно широкая. Графит используется для изготовления огнеупорных материалов, электрических машин и установок, в химической, горнодобывающей промышленности, а также на производстве. Из него также изготавливают стержневые карандаши, краски, покрытия и аккумуляторные батареи. Графит незаменим в ядерной промышленности и в других узконаправленных областях.
Источник: vseprokamni.ru