Графит (от греч. γραφειν — пишу) — минерал из класса самородных элементов, одна из аллотропных модификаций углерода. Графит представляет собой распространенный природный минерал, залегающий в виде зернистых, чешуйчатых или пластинчатых масс, содержащих иногда до 20 % минеральных примесей (Si, Al, Fe, Mg и др.). Его происхождение в природе связано с воздействием высоких температур и давлений на породы типа каменных углей и битумов.
Условия нахождения в природе. Сопутствующие минералы: пирит, гранаты, шпинель. Образуется при высокой температуре в вулканических и магматических горных породах, в пегматитах и скарнах. Встречается в кварцевых жилах с вольфрамитом и др. минералами в среднетемпературных гидротермальных полиметаллических месторождениях.
Широко распространён в метаморфических породах — кристаллических сланцах, гнейсах, мраморах. Крупные залежи образуются в результате пиролиза каменного угля под воздействием траппов на каменноугольные отложения (Тунгусский бассейн). Акцессорный минерал метеоритов.
Типы кристаллических решеток. 8 класс.
Структура. Структура слоистая. Слои кристаллической решетки могут по разному располагаться относительно друг друга, образуя целый ряд политипов, с симметрией от гексагональной сингонии (дигексагонально-дипирамидальный), до тригональной (дитригонально-скаленоэдрический). Слои слабоволнистые почти плоские, состоят из шестиугольных слоев атомов углерода (рисунок 9.1). Кристаллы пластинчатые, чешуйчатые.
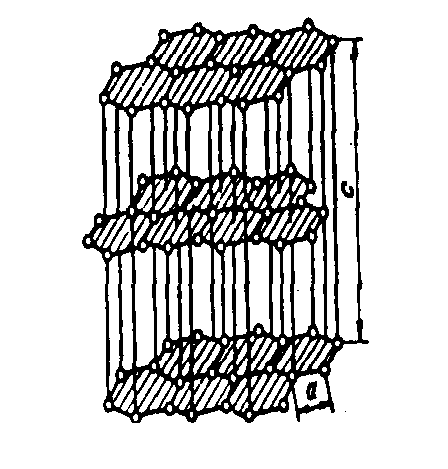
с – расстояние между плоскостями
Рисунок 9.1 — Структура графита.
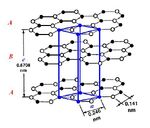
Гексагональная ячейка графита относится к пространственной группе с четырьмя атомами, приходящимися на элементарную ячейку. Последняя представляет собой призму высотой 0,671 нм с ромбом в основании. Стороны ромба равны 0,246 нм с углом 60°. В каждой плоскости углеродные атомы образуют сетку правильных шестигранников (рисунок 8.1).
При этом атомы углерода расположены в вершинах правильных плотноупакованных шестиугольников (гексагонов); эти плоскости называются базисными. Каждый атом в базисной плоскости связан с тремя соседними, расположенными от него на расстоянии 0,1415 нм. Энергия связи между атомами составляет 710 кДж/моль.
Существуют гексагональная и ромбоэдрическая кристаллические модификации графита. Силы взаимодействия между базисными плоскостями малы и являются силами Ван-дер-Ваальса. Энергия связи между плоскостями от 4,2 до 18,2 кДж/моль, расстояние 0,3354 нм. Внутри слоя атомы углерода связаны между собой ковалентными sp 2 -связями.
Графиту соответствует «паркетный» полимер, состоящий из атомов углерода sp 2 -гибридизации, расположенных в одной плоскости (решетка двухмерная). В кристаллах графита и алмаза атомы углерода находятся в разных гибридных состояниях. Стабильность этих кристаллических форм изменяется в зависимости от окружающих условий.
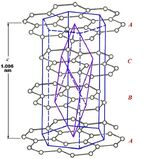
Кристаллографическая структура идеального кристалла графита показана на рисунке 9.2, а. Форма и размер кристаллов графита характеризуют толщиной пакета Lс, определяется числом слоев в пакете; шириной углеродного слоя Lа, ширина слоя в направлении «а» (рисунок 8.1); межплоскостным расстоянием d002 = с/2. Расстояние между плоскостями идеального кристалла графита d002 составляет 3,35 Å. Параметры кристаллической решетки графита различны для различных графитов:
Типы кристаллических решеток
Графит:
Средний размер кристаллита Lа, Å

Рисунок 9.2 — Кристаллографическая структура идеального кристалла графита (а) и графита с турбостратной структурой (б).
В базовых плоскостях атомы углерода соединены очень прочными ковалентными связями. Теоретический предел прочности и теоретический модуль упругости кристалла графита при растяжении вдоль плоскости слоев составляют соответственно 100 и 1000 ГПа. Межплоскостное взаимодействие определяется относительно слабыми Ван-дер-Ваальсовыми силами, что приводит к низким значениям механических свойств кристалла в направлении, перпендикулярном к слоям. Так, например, теоретический модуль упругости поперек слоев составляет только 35 ГПа.
Ценную информацию о термодинамических параметрах (Т, Р), при которых устойчивы кристаллические модификации углерода — графит и алмаз, дает диаграмма состояния углерода.
На рисунке 9.3 представлена общепринятая диаграмма состояний углерода. На ней указаны области температуры и давления, где стабильна та или иная фаза углерода.

Рисунок 9.3 — Схематическое изображение диаграммы состояния углерода.
Из приведенной диаграммы следует, что при обычных температурах и давлениях графит устойчив в термодинамическом отношении, а алмаз нет. Однако скорость превращения алмаза в графит при температурах до 1300 К и атмосферном давлении практически равна нулю. В этих условиях, как показывают наблюдения над природными алмазами, последние могут сохраняться бесконечно долго.
Свойства. Кроме природного, известны искусственные графиты, получаемые различными способами. Для всех видов искусственного и природного графитов свойственны различные устойчивые дефекты структуры (дефекты слоевой укладки, двойники, винтовые и краевые дислокации, «дырочные» дефекты), что обусловливает изменение в весьма широком диапазоне механических, теплофизических, полупроводниковых и других свойств углеродных материалов.
Теоретическая плотность графита — 2270 кг/м 3 ; искусственные графиты из-за дефектов структуры и пористости имеют более низкую плотность. Дефекты структуры увеличивают межслоевой расстояние, что приводит к снижению плотности. Промышленные графиты имеют плотность 1,5 — 2,23 г/см 3 .
Плоскости в графите представляют собой систему сопряженных связей углерода, вследствие чего графит имеет высокую теплостойкость.
Сочетание ковалентных (в плоскости слоя) и Ван-дер-Ваальсовых сил между слоями предопределяет сильную анизотропию физико-механических свойств вдоль параллельных и перпендикулярных направлений к поверхности чешуек графита. Так, например, прочность при сжатии для конструкционного графита марки ГМЗ вдоль плоскости чашуек составляет 35 МПа, а поперек 37 МПа; для пиролитического графита 120 и 470 МПа соответственно. Физико-механические свойства графитов различных марок представлены в таблице 9.1.
Таблица 9.1 — Физико-механические свойства графитов различных марок.
Показатель
Электродный
Реакторный
Пирографит*
Плотность, г/см 3
Прочность при, МПа
Модуль Юнга, ГПа
Коэффициент теплопроводности, Вт/(смК)
Удельное объемное электросопротивление, оммм 2 /м
Примечание: * числитель – параллельно оси «с» кристалла; знаменатель – перпендикулярно оси «с» кристалла.
Графит хорошо проводит электрический ток. В отличие от алмаза обладает низкой твёрдостью (1-2 по шкале Мооса). Цвет серый, блеск металлический.
Неплавок, устойчив при нагревании в отсутствии воздуха, интенсивное окисление на воздухе начинается при Т выше 500 0 С. По магнитным свойствам графит относится к группе «аномальных» диамагнетиков, хорошо поглощает жесткое радиационное излучение. В кислотах не растворяется. Жирный на ощупь. Природный графит содержит 10—12 % примесей глин и окислов железа.
В различных кристаллографических направлениях термическое расширение графита анизотропно. Для кристаллов графита различают два компонента термического расширения: в направлении гексагональной оси (с) и перпендикулярно оси (а) (рисунок 9.4).

1 – природный графит; 2 – пиролитический графит.
Рисунок 9.4 – Зависимость термических коэффициентов расширения
графита от температуры.
Графит обладает высокими самосмазывающими свойствами, обусловленными его высокой адгезией к различным поверхностям и легкостью скольжения по плоскостям спайности. Высокие антифрикционные свойства графита определяются образованием на скользящих поверхностях защитного слоя из гексагональных сеток атомов углерода. Коэффициент трения при скольжении полированного алюминия по графиту равен 0,18, полированной стали по реакторному графиту равен 0,2; графита по графиту 0,22.
Искусственный синтез. Получают нагреванием смеси кокса и пека до 2800°C; из газообразных углеводородов при температуре 1400—1500°С в вакууме с последующим нагреванием образовавшегося пироуглерода до температуры 2500—3000°С при давлении 50 МПа (образовавшийся продукт — пирографит).
Применение. Использование графита основано на ряде его уникальных свойств. Основные области применения графита: для изготовления плавильных тиглей, футеровочных плит — применение основано на высокой температурной стойкости графита (в отсутствие кислорода), на его химической стойкости к целому ряду расплавленных металлов; для электродов, нагревательных элементов — благодаря высокой электропроводности и химической стойкости к практически любым агрессивным водным растворам (намного выше, чем у благородных металлов); для получения химически активных металлов методом электролиза расплавленных соединений. В частности, при получении алюминия используются сразу два свойства графита: хорошая электропроводность, и как следствие — его пригодность для изготовления электрода; газообразность продукта реакции, протекающей на электроде — это углекислый газ. Газообразность продукта означает, что он выходит из электролизера сам, и не требует специальных мер по его удалению из зоны реакции; для твёрдых смазочных материалов, в комбинированных жидких и пастообразных смазках; в качестве наполнителя пластмасс; как замедлитель нейтронов в ядерных реакторах; как компонент состава для изготовления стержней для чёрных графитовых карандашей (в смеси с каолином); для получения синтетических алмазов.
1. Конкин А.А. Углеродные и другие жаростойкие волокнистые материалы. – М.: Химия, 1974. -376 с.
2. Рогайлин М.И., Чалых Е.Ф. Справочник по углеграфитовым материалам. – Л.: Химия, 1974 .- 208 с.
3. Бушуев Ю.Г., Персин М.И., Соколов В.А. Углерод-углеродные композиционные материалы: Справочник. – М.: Металлургия, 1994. – 128 с.
Источник: studfile.net
Графит

Хорошо проводит электрический ток. В отличие от алмаза обладает низкой твёрдостью (1-2 по шкале Мооса). Плотность 2,08 — 2,23 г/см³. Цвет серый, блеск металлический. Неплавок, устойчив при нагревании в отсутствие воздуха. В Структура [ ]
Каждый атом углерода Условия нахождения в природе [ ]
Сопутствующие минералы: пирит, шпинель. Образуется при высокой температуре в вулканических и магматических кварцевых жилах с гидротермальных полиметаллических месторождениях. Широко распространён в метаморфических породах — кристаллических сланцах, мраморах. Крупные залежи образуются в результате каменного угля под воздействием траппов на каменноугольные отложения (Тунгусский бассейн). метеоритов.
Искусственный синтез [ ]
Получают нагреванием смеси вакууме с последующим нагреванием образовавшегося пироуглерода до температуры 2500—3000 °С при давлении 50 МПа (образовавшийся продукт — пирографит).
Применение [ ]
C в α-железе с объемно-центрированной кубической решеткой)
C в γ-железе с гранецентрированной кубической решеткой)
Графит стабильная высокоуглеродистая фаза
- замедлитель нейтронов в ядерных реакторах
- компонент состава для изготовления стержней для чёрных графитовых каолином)
- для получения синтетических алмазов
- Klein, Cornelis and Cornelius S. Hurlbut, Jr. (1985) Manual of Mineralogy: after Dana 20 th ed. ISBN 0-471-80580-7
Ссылки [ ]
- о минерале графит (рус.)
- The Graphite Page (англ.)
- Mineral galleries (англ.)
- Графит в базе webmineral.com (англ.)
- (англ.)
- Intumescent graphite for fireproofing (англ.)
- Терморасширенный (гибкий) графит (рус.)
- Производство и поставка графита, графит, графитная смазка, конструкционный графит (рус.)
- Графит, виды графита (рус.)
См. также [ ]
| Аллотропные формы углерода |
| Алмаз | Графен | Графит | Карбин | Технический углерод | Углеродные нанотрубки | Фуллерены |
Источник: science.fandom.com
Таблица типов кристаллических решёток: йода, алмаза, графита, натрия

Химия — удивительная наука. Столько невероятного можно обнаружить в, казалось бы, обычных вещах.
Всё материальное, что окружают нас повсюду, существует в нескольких агрегатных состояниях: газы, жидкости и твёрдые тела. Учёные выделили ещё и 4-е — плазму. При определённой температуре какое-либо вещество может переходить из одного состояние в другое. Например, вода: при нагревании свыше 100, из жидкой формы, превращается в пар. При температуре ниже 0 переходит в следующее агрегатную структуру — лёд.
Оглавление:
Весь материальный мир имеет в своём составе массу одинаковых частиц, которые между собой связаны. Эти мельчайшие элементы строго выстраиваются в пространстве и образуют так называемый пространственный каркас.
Это интересно: анионы и катионы в химии, таблица растворимости.
Определение

Кристаллическая решётка — особая структура твёрдого вещества, при которой частицы стоят в геометрически строгом порядке в пространстве. В ней можно обнаружить узлы — места, где расположены элементы: атомы, ионы и молекулы и межузловое пространство.
Твёрдые вещества, в зависимости от диапазона высоких и низких температур, являются кристаллическими или аморфными — они характеризуются отсутствием определённой температуры плавления. При воздействии повышенных температур они размягчаются и постепенно переходят в жидкую форму. К такого рода веществам относятся: смола, пластилин.
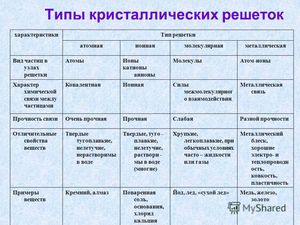
В связи с этим можно поделить на несколько видов:
- атомную;
- ионную;
- молекулярную;
- металлическую.
Но при различных температурах одно вещество может иметь различные формы и проявлять многообразные свойства. Это явление называется аллотропной модификацией.
Это интересно: металлы и неметаллы в периодической таблице Менделеева.
Атомный тип
В этом типе в узлах расположены атомы того или иного вещества, которые связаны ковалентными связями. Этот вид связи образован парой электронов двух соседних атомов. Благодаря этому они связываются равномерно и в строгом порядке.
Вещества с атомной кристаллической решёткой характеризуются следующими свойствами: прочность и большая температура плавления. Такой тип связи представлен у алмаза, кремния и бора.
Ионный тип
Противоположно заряженные ионы находятся на узлах, которые создают электромагнитное поле, характеризующее физические свойства вещества. К таковым будут относиться: электропроводность, тугоплавкость, плотность и твёрдость. Поваренная соль и нитрат калия характеризуются наличием ионной кристаллической решётки.
Не пропустите: механизм образования металлической связи, конкретные примеры.
Молекулярный тип
В узлах такого типа находятся ионы, связанные между собой ван-дер-ваальсовыми силами. Благодаря слабым межмолекулярным связям такие вещества, например, лёд, двуокись углерода и парафин, характеризуются пластичностью, электро- и теплопроводностью.
Металлический тип
В своём строении напоминает молекулярную, но имеет всё же более прочные связи. Отличие данного типа в том, что на её узлах находятся положительно заряженные катионы. Электроны, которые находятся в межузловом пространстве, участвуют в образовании электрического поля. Они ещё носят название электрического газа.
Простые металлы и сплавы, характеризуются металлическим типом решётки. Для них характерно наличие металлического блеска, пластичность, тепло- и электропроводность. Они могут плавиться при различных температурах.
| Виды | Вещества | Свойства |
| Атомная | Алмаз, графит, кремний, бор | Твёрдые, тугоплавкие, не растворяются в воде |
| Молекулярная | Йод, сера, белый фосфор, органические вещества | Нетвёрдые, легко плавятся, летучие |
| Ионная | Соли, оксиды и гидроксиды тяжёлых металлов | Твёрдые, хрупкие, легкоплавкие, электропроводны |
| Металлическая | Металлы и сплавы | Блестящие, ковкие, тепло- и электропроводны. |
Различные вещества
Источник: obrazovanie.guru