I. Периодический закон в свете теории строения атомов
| Понятие | Физ. смысл | Характеристика понятия |
| Заряд ядра | Равен порядковому номеру элемента | Основная характеристика элемента, определяет химические свойства, так как с ростом заряда ядра увеличивается количество электронов в атоме, в том числе и на внешнем уровне. Следовательно, изменяются свойства |
| Периодичность | С увеличением заряда ядра наблюдается периодическая повторяемость строения внешнего уровня, следовательно, периодически изменяются свойства (внешние электроны – валентные) |
II. Периодическая система в свете теории строения атома
Равен числу протоновв ядре.
Равен числу электронов в атоме.
Горизонтальный ряд элементов.
1,2,3 – малые; 4,5,6 – большие; 7 – незавершенный.
В 1 периоде всего два элемента и больше быть не может. Это определяется формулой N = 2n 2
Характеристика элемента по положению в Периодической системе и строению атома. 2 часть. 8 класс.
Каждый период начинается щелочным металлом и заканчивается инертным газом.
Первые два элемента любого периода s — элементы, последние шесть р – элементы, между ними d — и f – элементы.
В периоде слева направо:
1.относит. атомная масса – увеличивается
2.заряд ядра – увеличивается
3.количество энерг. уровней – постоянно
4.кол-во электронов на внеш.уровне — увеличивается
5.радиус атомов – уменьшается
Следовательно, внешние электроны удерживаются сильнее, и металлические свойства ослабевают, а неметаллические усиливаются
В малых периодах этот переход происходит через 8 элементов, в больших – через 18 или 32.
В малых периодах валентность увеличивается от 1 до 7 один раз, в больших – два раза. В том месте, где происходит скачок в изменении высшей валентности, период делится на два рядя.
От периода к периоду происходит резкий скачок в изменении свойств элементов, так как появляется новый энергетический уровень.
Вертикальный ряд элементов.
Каждая группа делится на две подгруппы: главную и побочную. Главную подгруппу составляют s – ир – элементы, побочную -d — и f– элементы.
Подгруппы объединяют наиболее сходные между собой элементы.
В группе, в главной подгруппе сверху вниз:
1.относит. атомная масса – увеличивается
2.число электронов на внеш. уровне – постоянно
3.заряд ядра – увеличивается
4.кол – во энерг. уровней – увеличивается
5.радиус атомов — увеличивается
Следовательно, внешние электроны удерживаются слабее, и металлические свойства элементов усиливаются, неметаллические- ослабевают.
Элементы некоторых подгрупп имеют названия:
1а группа – щелочные металлы
2а – щелочноземельные металлы
8а – инертные газы (имеют завершённый внешний уровень)
Выводы:
1. Чем меньше электронов на внешнем уровне и больше радиус атома, тем меньше электроотрицательность и легче отдавать внешние электроны, следовательно, тем сильнее выражены металлические свойства
Характеристика элемента по положению в Периодической системе и строению атома. 1 часть. 8 класс.
Чем больше электронов на внешнем уровне и меньше радиус атома, тем больше электроотрицательность и тем легче принимать электроны, следовательно, тем сильнее неметаллические свойства.
2. Для металлов характерна отдача электронов, для неметаллов – прием.
III. Особое положение водорода в периодической системе
Водород в периодической системе занимает две клетки (в одной из них заключен в скобки) – в 1 группе и в 7 – ой.
В первой группе водород стоит потому, что у него, как и у элементов первой группы, на внешнем уровне один электрон.
В седьмой группе водород стоит потому, что у него, как и у элементов седьмой группы, до завершения энергетического уровня.
IV. План – алгоритм характеристики элемента по его положению в ПСХЭ Д. И. Менделеева
4.Номер периода (большой 4-7 или малый 1-3)
5.Номер группы, подгруппа (главная «А» или побочная «Б»)
6.Состав атома: число электронов, число протонов, число нейтронов
Подсказка!
Число электронов = числу протонов = порядковому номеру;
Число нейтронов = атомная масса (Ar из таблицы Менделеева) – число протонов.
7. Вид элемента (s, p, d, f)
Подсказка!
s-элементы: это первые два элемента в 1-7 периодах;
p-элементы: последние шесть элементов1-6 периодов;
d-элементы: это элементы больших периодов (по 10 штук) между s- и p-элементами;
f-элементы: это элементы 6 и 7 периодов – лантаноиды и актиноиды, они вынесены вниз таблицы.
8.Схема строения атома (распределение электронов по энергоуровням), завершённость внешнего уровня.
Подсказка! Внешний уровень завершён у элементов VIII группы главной подгруппы «А» — Ne, Ar, Kr, Xe, Rn.
Подсказка! Для написания схемы нужно знать следующее:
Заряд ядра атома = порядковому номеру атома;
Число энергетических уровней определяют по номеру периода, в котором находится элемент;
У s- и p-элементов на последнем (внешнем) от ядра энергетическом уровне число электронов равно номеру группы, в которой находится элемент.
У d- элементов на последнем уровне число электронов всегда равно 2 (исключения – хром, медь, серебро, золото и некоторые другие на последнем уровне содержат 1 электрон).
Максимальное возможное число электронов на уровнях определяют по формуле Nэлектронов = 2n 2 , где n – номер энергоуровня.
Например, I уровень – 2 электрона, II – 8 электронов, III – 18 электронов, IV – 32 электрона и т.д.
9.Электронная и электронно-графическая формулы строения атома
Подсказка!
Для написания электронной формулы используйте шкалу энергий:
Помните! На s – орбитали максимум может быть 2 электрона, на p – 6, на d – 10, на f – 14 электронов.
Например, +11Na 1s 2 2s 2 2p 6 3s 1 ; +22Ti 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2
10.Металл или неметалл
Подсказка!
К неметаллам относятся: 2 s-элемента — водород и гелий и 20 p-элементов – бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат и радон.
К металлам относятся: все d- и f-элементы, все s-элементы (исключения водород и гелий), некоторые p-элементы.
11.Высший оксид (только для s, p)
Подсказка!
Общая формула высшего оксида дана под группой химических элементов (R2O, RO и т.д.)
12.Летучее водородное соединение (только для s, p)
Подсказка!
Общая формула летучего водородного соединения дана под группой химических элементов (RH4, RH3 и т.д.) – только для элементов 4 -8 групп.
V. Задание для самостоятельной работы
Дайте характеристику следующим элементам по плану: кальций, фосфор, медь.
VI. Тренажеры
«Лабиринт по периодической системе химических элементов Д.И.Менделеева»
Необходимо найти верный путь к финишу, отмечая его последовательно цифрами, начиная с 1. (Подсказка: количество ходов – 9.)

Игра-лабиринт №2

Домашнее задание
Источник: kardaeva.ru
ГДЗ Химия 8 класс рабочая тетрадь Габриелян. §33. Характеристика элемента-неметалла. Часть II. Номер №1
Охарактеризуйте серу по приведенному в учебнике плану характеристики элемента−неметалла.
reshalka.com
ГДЗ Химия 8 класс рабочая тетрадь Габриелян. §33. Характеристика элемента-неметалла. Часть II. Номер №1
Решение
1 ) Атомный номер серы 16 (Z = 16 ). Сера расположен в VI А−группе периодической системы Д. И. Менделеева, в третьем периоде.
2 ) Заряд атомного ядра + 16, оно содержит 16 протонов и 16 нейтронов. На электронной оболочке 16 электронов. Схема распределения электронов по энергетическим уровням: 2 e; 8 e; 6 e.
3 ) Сера образует несколько простых веществ − неметаллов, следовательно, для нее характерно явление аллотропии.
4 ) Неметаллические свойства у серы выражены слабее, чем у кислорода, но сильнее, чем у селена.
5 ) Неметаллические свойства у серы выражены сильнее, чем у фосфора, но слабее, чем у хлора.
6 ) Максимальная валентность серы равна VI, так как его атом содержит шесть валентных электронов. Формула высшего оксида фосфора − $SO_$ . Этот кислотный оксид взаимодействует с водой, щелочами и основными оксидами.
7 ) Гидроксид фосфора − фосфорная кислота $H_SO_$ взаимодействует с основаниями, основными оксидами и солями.
8 ) Формула летучего водородного соединения − $H_S$ .
Источник: reshalka.com
Характеристика элемента по его положению в Периодической системе химических элементов Д. И. Менделеева. Химические реакции. 3 уровень — cтраницы 110, 111, 112
ЗАДАНИЕ 1
Дано уравнение реакции получения азотной кислоты: 4N02 + 02 + 2Н20 = 4HN03 + Q.
Дайте характеристику реакции по всем изученным вами классификационным признакам.
Рассмотрите реакцию с точки зрения процессов окисления-восстановления. Укажите окислитель и восстановитель.

ЗАДАНИЕ 2
Дайте характеристику химического элемента магния по его положению в Периодической системе.

ЗАДАНИЕ 3
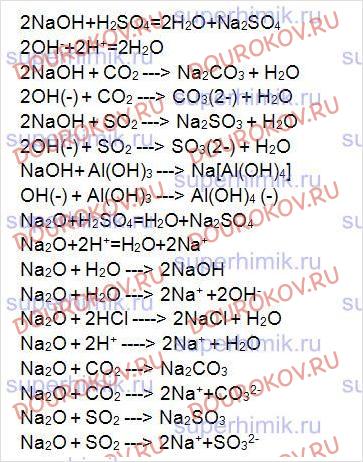
Составьте формулы оксида и гидроксида магния, укажите их характер.
Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.

ВАРИАНТ 2
ЗАДАНИЕ 1
Дано уравнение реакции железа с хлором: 2Fe + 3Сl2 = 2FeCl3 + Q.
Дайте характеристику химической реакции по всем изученным вами классификационным признакам.
Рассмотрите реакцию с точки зрения процессов окисления-восстановления. Укажите окислитель и восстановитель.

ЗАДАНИЕ 2
Дайте характеристику химического элемента натрия по его положению в Периодической системе Д. И. Менделеева.

ЗАДАНИЕ 3
Составьте формулы оксида и гидроксида натрия, укажите их характер. Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.
ВАРИАНТ 3
ЗАДАНИЕ 1
Дано уравнение реакции разложения нитрата калия: 2KN03 = 2KN02 + О2 — Q.
Дайте характеристику реакции по всем изученным вами классификационным признакам.
Рассмотрите реакцию с точки зрения процессов окисления-восстановления. Укажите окислитель и восстановитель.

ЗАДАНИЕ 2
Дайте характеристику химического элемента углерода по его положению в Периодической системе.

ЗАДАНИЕ 3
Составьте формулы оксида и гидроксида углерода, укажите их характер.
Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.

ВАРИАНТ 4
ЗАДАНИЕ 1
Дано уравнение реакции образования гидроксида железа (III): 4Fe(OH)2 + 2Н20 + 02 = 4Fe(OH)3.
Дайте характеристику реакции по всем изученным вами классификационным признакам.
Рассмотрите реакцию с точки зрения процессов окисления-восстановления. Укажите окислитель и восстановитель.

ЗАДАНИЕ 2
Дайте характеристику химического элемента фосфора по его положению в Периодической системе.

ЗАДАНИЕ 3
Составьте формулы оксида и гидроксида фосфора, укажите их характер.
Напишите уравнения всех реакций, характерных для этих веществ, в ионной и молекулярной формах.

Сохраните или поделитесь с одноклассниками:
Источник: dourokovgdz.ru