Железо – один из элементов периодической системы Д.И. Менделеева, и входит в число тех металлов, которые имеют особое значение как в функционировании живых организмов, так и в промышленности.

Инструкция
В таблице Менделеева железо является элементом восьмой группы, атомный номер которого – 26. Обозначается символом Fe, это первые две буквы латинского названия железа, которое пишется как Ferrum.
Железо – это пластичный металл серебристо-белого цвета, но в чистом виде он практически не встречается. В природе его можно найти в составе железо-никелевых соединений, а в промышленности чаще всего используется в сплавах с такими химическими элементами, как хром или углерод. Обладает сильно выраженным магнитным свойством, температура плавления – около полутора тысяч градусов по Цельсию.
На Земле и в Солнечной системе железо очень широко распространено. Считается, что земное ядро практически полностью состоит из железа, а его доля в земной коре более четырех процентов от всей ее массы. На сегодняшний день количество железа в разведанных месторождениях оценивают в двести миллиардов тонн, но для того, чтобы извлечь такое железо из руды, требуется его дополнительная переработка.
Железо — Самый Полезный МЕТАЛЛ НА ЗЕМЛЕ!
На влажном воздухе железо быстро покрывается ржавчиной и разрушается. В результате этого процесса каждый год уничтожается миллионы тонн этого металла. Для того, чтобы этого избежать, в производстве часто применяется способ, который носит название «воронение». В этом случае используется другое свойство железа – при его нагревании в сухой атмосфере выше двухсот градусов по Цельсию, этот металл покрывается оксидной пленкой, которая защищает железо от коррозии в условиях обычных температур.
Физические свойства железа напрямую зависят от примесей других химических элементов в своем составе. Так, сера вызывает красноломкость, когда при горячей обработке металл начинает трескаться, а фосфор – наоборот, приводит к хладноломкости, свойству металлов ломаться при низких температурах. Углерод и азот способствуют тому, чтобы железо теряло свою пластичность, которая свойственна ему при нахождении в чистом виде без примесей.
Одно из особенных химических свойств железа — это то, что оно может иметь несколько степеней окисления. Из нейтрального железа состоит земное ядро, и в таком виде этот металл встречается только там. В мантии содержится уже его видоизмененная форма – закисное железо FeO, а в наиболее окисленных частях земной коры преобладает окисное железо.
Все металлургическое производство планеты на девяносто пять процентов завязано именно на железе, это необычайно ценный металл для человечества, который используется повсеместно. Кроме того, железо входит в состав гемоглобина и других клеток, не только человеческих, обеспечивая функционирование многим живым организмам.
Источник: www.kakprosto.ru
Билет 21
1. Железо: положение в периодической системе химических элементов Д. И. Менделеева, строение атома, возможные степени окисления, физические свойства, взаимодействие с кислородом, галогенами, растворами кислот и солей. Роль железа в современной технике. Сплавы железа.
Железо находится в побочной подгруппе VIII группы периодической системы. Электронная формула атома железа:
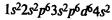
Типичные степени окисления железа +2 и +3. Степень окисления +2 проявляется за счет потери двух 4s-электронов. Степень окисления +3 соответствует также при потере еще одного Зd-электрона, при этом Зd-уровень оказывается заполненным наполовину; такие электронные конфигурации относительно устойчивы.
Физические свойства. Железо – типичный металл, образует металлическую кристаллическую решетку. Железо проводит электрический ток, довольно тугоплавко, температура плавления 1539°С. От большинства других металлов железо отличается способностью намагничиваться.
Химические свойства. Железо реагирует со многими неметаллами:
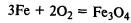
Образуется железная окалина – смешанный оксид железа. Его формулу записывают также так: FeО•Fe2О3.
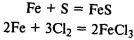
Реагирует с кислотами с выделением водорода:
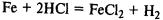
Вступает в реакции замещения с солями металлов, расположенных правее железа в ряду напряжений:
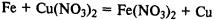
Соединения железа. FeО — основной оксид, реагирует с растворами кислот с образованием солей железа (II). Fe2О3 — амфотерный оксид, реагирует также с рас творами щелочей.
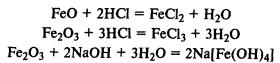
Гидроксиды железа. Fe(ОН)2 — типичный основной оксид, Fe(ОН)3 обладает амфотерными свойствами, реагирует не только с кислотами, но и с концентрированными растворами щелочей.
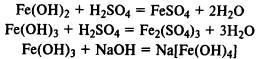
Гидроксид железа (II) легко окисляется до гидроксида железа (III) кислородом воздуха:
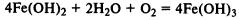
При реакции солей железа (II) и (III) со щелочами в осадок выпадают нерастворимые гидроксиды:
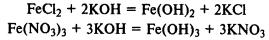
Сплавы железа. Современная металлургическая промышленность производит железные сплавы разнообразного состава.
Все железные сплавы разделяются по составу и свойствам на две группы. К первой группе относятся различные сорта чугуна, ко второй — различные сорта стали.
Чугун хрупок; стали же пластичны, их можно ковать, прокаты^ вать, волочить, штамповать. Различие в механических свойствах чугунов и сталей зависит прежде всего от содержания в них углерода — в чугунах содержится около 4% углерода, а в сталях — обычно менее 1,4%.
В современной металлургии из железных руд получают сначала чугун, а затем из чугуна — сталь. Чугун выплавляют в доменных печах, сталь варят в сталеплавильных печах. До 90% всего выплавленного чугуна перерабатывают в стали.
Стали. Все стали делятся на углеродистые и легированные.
Углеродистые стали содержат в несколько раз меньше углерода, кремния и марганца, чем чугун, а фосфора и серы совсем мало. Свойства углеродистой стали зависят прежде всего от содержания в ней углерода: чем больше в стали углерода, тем она твёрже. Промышленность производит мягкие стали, стали средней твёрдости и твёрдые. Мягкие стали и стали средней твёрдости применяются для изготовления деталей машин, труб, болтов, гвоздей и т. д., а твёрдые стали—для изготовления инструментов.
В сталях должно быть возможно меньше серы и фосфора, так как эти примеси ухудшают механические свойства сталей. В повышенных количествах сера вызывает красноломкость — образование трещин при горячей механической обработке металла. Фосфор вызывает хладноломкость—хрупкость стали при обыкновенной температуре. —
Легированные стали. Физические, химические и механические свойства сталей существенно изменяются от введения в их состав повышенного количества марганца и кремния, а также хрома, никеля, вольфрама и других элементов. Эти элементы называются легирующими, а стали — легированными [от латинского слова ligare – связывать, соединять].
Наиболее широко в качестве легирующего элемента применяется хром. Особенно большое значение для сооружения машин, аппаратов и многих деталей машин имеют хромоникелевые стали. Эти стали обладают высокой пластичностью, прочностью, жаростойкостью и стойкостью к действию окислителей. Азотная кислота любой концентрации не разрушает их даже при температурах кипения.
Хромоникелевые стали не ржавеют в атмосферных условиях и в воде. Блестящие, серебристого цвета, листы хромоникелевой стали украшают арки станции «Маяковская» Московского метро. Из этой же стали делают нержавеющие ножи, ложки, вилки и другие предметы домашнего обихода.
Молибден и ванадий повышают твёрдость и прочность сталей при повышенных температурах и давлениях. Так, хромомолибденовые и хромованадиевые стали применяются для изготовления трубопроводов и деталей компрессоров в производстве синтетического аммиака, авиационных моторов.
При резании с большой скоростью инструмент сильно разогревается и быстро изнашивается. При добавлении вольфрама твёрдость стали сохраняется и при повышенных температурах. Поэтому хромовольфрамовые стали применяются для изготовления режущих инструментов, работающих при больших скоростях ‘
Увеличение содержания в стали марганца повышает её сопротивление трению и удару. Марганцовистые стали применяются для изготовления железнодорожных скатов, стрелок, крестовин, камнедробильных машин.
Применение легированных сталей позволяет значигельно снизить вес металлических конструкций, повысить их прочность, долговечность и надёжность в эксплуатации.
2. Белки как биополимеры. Первичная, вторичная и третичная структуры белков. Свойства и биологические функции белков.
Белки (протеины, полипептиды) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа-аминокислот.
Белки, подобно полисахаридам, являются биологическими полимерами. Большинство белковых молекул достигает гигантских размеров по сравнению с другими органическими соединениями и имеет очень большую молекулярную массу:
Источник: studopedia.ru
Характеристика железа как химического элемента

Железо – один из элементов периодической системы Д.И. Менделеева, и входит в число тех металлов, которыеимеют особое значение как в функционировании живых организмов, так и в промышленности.
В таблице Менделеева железо является элементом восьмой группы, атомный номер которого – 26. Обозначается символом Fe, это первые две буквы латинского названия железа, которое пишется как Ferrum.
Железо – это пластичный металл серебристо-белого цвета, но в чистом виде он практически не встречается. В природе его можно найти в составе железо-никелевых соединений, а в промышленности чаще всего используется в сплавах с такими химическими элементами, как хром или углерод. Обладает сильно выраженным магнитным свойством, температура плавления – около полутора тысяч градусов по Цельсию.
На Земле и в Солнечной системе железо очень широко распространено. Считается, что земное ядро практически полностью состоит из железа, а его доля в земной коре более четырех процентов от всей ее массы. На сегодняшний день количество железа в разведанных месторождениях оценивают в двести миллиардов тонн, но для того, чтобы извлечь такое железо из руды, требуется его дополнительная переработка.
На влажном воздухе железо быстро покрывается ржавчиной и разрушается. В результате этого процесса каждый год уничтожается миллионы тонн этого металла. Для того, чтобы этого избежать, в производстве часто применяется способ, который носит название «воронение». В этом случае используется другое свойство железа – при его нагревании в сухой атмосфере выше двухсот градусов по Цельсию, этот металл покрывается оксидной пленкой, которая защищает железо от коррозии в условиях обычных температур.
Физические свойства железа напрямую зависят от примесей других химических элементов в своем составе. Так, сера вызывает красноломкость, когда при горячей обработке металл начинает трескаться, а фосфор – наоборот, приводит к хладноломкости, свойству металлов ломаться при низких температурах. Углерод и азот способствуют тому, чтобы железо теряло свою пластичность, которая свойственна ему при нахождении в чистом виде без примесей.
Одно из особенных химических свойств железа -это то, что оно может иметь несколько степеней окисления. Из нейтрального железа состоит земное ядро, и в таком виде этот металл встречается только там. В мантии содержится уже его видоизмененная форма – закисное железо FeO, а в наиболее окисленных частях земной коры преобладаетокисное железо.
Все металлургическое производство планеты на девяносто пять процентов завязано именно на железе, это необычайно ценный металл для человечества, который используется повсеместно. Кроме того, железо входит в состав гемоглобина и других клеток, не только человеческих, обеспечивая функционирование многим живым организмам.
Источник: completerepair.ru