Hf (гафний) — элемент с прядковым номером 72 в периодической системе. Находится в VI периоде. Температура плавления: 2150 ℃. Плотность: 13.31 г/см 3 .
Электронная формула атома гафния в порядке возрастания энергий орбиталей:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 2
Электронная формула атома гафния в порядке следования уровней:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 2 6s 2
Сокращенная электронная конфигурация Hf:
[Xe] 4f 14 5d 2 6s 2
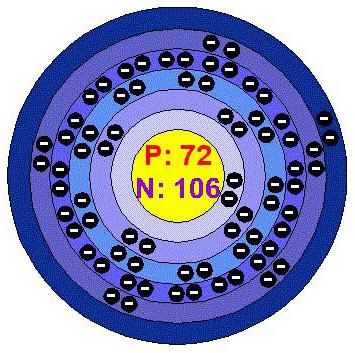
Ниже приведена электронно-графическая схема атома гафния

Распределение электронов по энергетическим уровням в атоме Hf
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 18
4-й уровень (N): 32
5-й уровень (O): 10
6-й уровень (P): 2

Самый редкий элемент на Земле
Валентные электроны гафния
Количество валентных электронов в атоме гафния — 4.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| s | 6 | +1/2 | ||
| s | 6 | -1/2 | ||
| d | 5 | 2 | -2 | +1/2 |
| d | 5 | 2 | -1 | +1/2 |
Степени окисления, которые может проявлять гафний: +2, +3, +4
![]()
Поделитесь информацией с друзьями
![]()
Скачать перечень калькуляторов
Источник: your-online.ru
Гафний: применение и свойства

Ознакомление с данной статьей позволит читателю узнать, что представляет собой гафний (химический элемент), применение которого широко используется человеком во множестве областей его деятельности. А также будут рассмотрены свойства химической и физической природы вещества, способы добычи и нахождение на планете, будет рассмотрена краткая история открытия этого элемента.
Что такое гафний
Гафний – химический элемент таблицы Менделеева. Находится в четвертой группе, шестом периоде, атомный номер равен семидесяти двум. Относится к простому типу веществ, имеет высокую плотность и тугоплавкость, цвет метала серебристо-белый. Гафний может существовать в двух модификациях. Под воздействием температуры около 2016 Кельвинов решетка гексагонального типа, претерпев аллотропические изменения, переходит в состояние объемноцентрированной решетки кубической формы, при комнатных температурах имеет кристаллическую решетку гексагональной сингонии.
Анализатор газов и элементов Bruker G4 ICARUS CS HF

Из истории открытия элемента
Открытие элемента произошло в 1923, совершили его Дьердь де Хешеви и Костер Дирк. Они смогли предсказать валентность и различные качественные характеристики гафния, основываясь на умозаключениях Н. Бора, который, в свою очередь, анализировал работу француза Ж. Урбена, считавшего, что он открыл кельтий – новый элемент. Однако позднее оказалось, что кельтием была смесь малого количества гафния с лютецием и иттербием.
Нильс Бор, изучая эту работу и используя в своей деятельности квантовомеханические расчеты, доказал, что гафний является аналогом элемента под номером 71 в ПТХЭ, а именно циркония. Дьердь де Хешеви и Костер Дирк заявили о нахождении нового элемента гафния, названного в честь города, в котором было совершено открытие, после того как, используя рентгеноспектральный метод, многократно проанализировали цирконы Норвегии и Гренландии. Обнаружение сходства линий рентгенограммы позволило ученым объявить об обнаружении нового х-ского элемента.
Способы получения и мировые запасы
Гафний находится в коре земли, но не имеет собственного минерала, а потому он является «спутником» циркония. Количество Hf в рудах около 2.5%, и годовая добыча составляет около семидесяти тонн. Гафний — довольно дорогое вещество, его основные места нахождения сосредоточены в Австралии, ЮАР, США, Индии и Бразилии. Расположение стран в поочередности перечисления соответствует местам по количеству наличия Hf в стране. Стоит также упомянуть, что Россия и Украина имеют довольно большие запасы этого металла, основное количество которого сосредоточено в циркономе, лопарите и бадделеите.

Физическая характеристика
Часть физических свойств гафния была упомянута выше. К ним можно добавить, что этот металл, который, принимая мелкодисперсное состояние, становится практически черным. Плавится при 2233 градусов по Цельсию, кипение начинается при 4603 о С. Сечение для захвата нейтронов теплового типа очень высокое. Цирконий, в отличие от гафния, имеет уровень сечения на три порядка слабее.
В то время как захват Hf равен 115 барам, у циркония он всего около 0.2 бар. Гафний имеет аналогичный уровень теплоемкости германия (Ge) и является аномальным. Пик теплоемкости находится на уровне 60-80 Кельвинов. Это невозможно объяснить ни одной теорией, связанной с гуковскими силами, что обусловлено неспособностью функции эйнштейновской суперпозиции предоставить кривую с максимумом.
Химические свойства
Гафний имеет х-скую стойкость гораздо сильнее, чем у аналогичного циркония. Сам металл имеет довольно большую инертность, что связано с пленкой оксидов пассивного типа, которая образуется на гафние. Лучше всего Hf растворяется в фтороводородной кислоте, смеси фтороводородной кислоты с азотной кислотой и в царской водке.
При высоких температурах сгорает в кислороде, а на открытом воздухе начинает окисляться. Может вступать в х-ские реакции с галогенами. Обладает свойствами гидрофобного характера.
Соединения двух- трех- и четырехвалентного Hf
У данного элемента значение валентности является переменным и, в соответствии с различными величинами количества возможных х-ских связей, существуют несколько важнейших соединений гафния с другими веществами.
Двухвалентный дибромид гафния имеет темно-зеленый цвет. При температуре 400 градусов по Цельсию начинает процесс разложения с образованием Hf и HfBr4. В промышленности добывают диспропорционированием в вакууме HfBr3 под термическим воздействием.
Трехвалентный Hf представлен трибромидом (HfBr3) – это вещество черно-синего цвета, довольно твердое. Под воздействием температуры, равной 400 градусам по Цельсию, начинает диспропорционировать на два компонента тетрабромбиты гафния и дибромбиды. Способ получения заключается в восстановлении HfBr4 путем нагревания в водороде, возможно с добавлением алюминия.
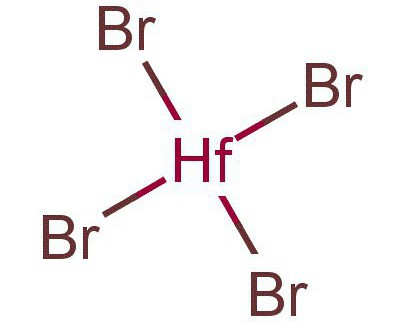
К соединениям четырехвалентного гафния относится довольно большое количество соединений, а именно HfO2 – его диоксид, а также гидроксид с х-ской формулой Hf(OH)4. Тут же находятся третрахлорид (HfCl4), тетрафторид (HfF4), тетраиодид (HfI4) и вышеупомянутый тетрабомид гафния (HfBr), еще есть гидрофосфаты гафния (Hf(HPO4)2).
Применение в быту и связь с медициной
Гафний применение свое находит во множестве сфер деятельности людского рода. Это связано с множеством качественных характеристик, свойств, которые делают его незаменимым материалом, веществом во множестве отраслей промысла человека, военном деле и даже в ядерной промышленности.
Так как же используется гафний? Применение в медицине – это один из множества вариантов, где можно задействовать свойства этого металла. Так как карбиды Hf сверхпрочные, практически не подвергающиеся коррозии, они могут использоваться для изготовления режущих предметов, используемых врачами, также их используют при изготовлении рентгеновского зеркала.

Элемент с исключительными свойствами как химической, так и физической природы – это гафний. Применение в быту он находит в качестве материала при изготовлении радиотехники, радиоламп и телевизионных трубок. Его широко используют в металлургической промышленности с целью придания другим металлам более качественных физико-технических и механических свойств. Гафний применение также находит в х-ском машиностроении, но используется редко в силу своего дефицита и более важных способов применения.
Использование гафния в военном ремесле
Каким образом еще можно использовать гафний? Применение в вооружении – это очередная сфера деятельности человека, в которой не обходится без этого элемента. Окиси, силициды, бориды и карбиды гафния являются чрезвычайно тугоплавкими соединениями, по этой причине в военном ремесле их можно использовать в качестве защитного покрытия. Он также является чрезвычайно сверхжаропрочным, что позволяет использовать Hf и его соединения для производства деталей, предназначенных сверхскоростным самолетам и ракетам, включая космические.

Начиная с 1998 года совершались попытки создать «гафниевую бомбу», базирующуюся на изомере 187m2Hf. Но в результате исследований и испытаний идея оказалась несостоятельной, это связано с отсутствием возможности при нынешних технологиях добиться высвобождения избыточного вида энергии из ядра данного изомера.
Другие области применения простого вещества Hf
В атомной энергетике, наряду с вышеупомянутыми сферами, но даже в еще большем количестве, также используют гафний. Где применяется этот металл? Из-за его способности к нейтронному захвату из Hf изготавливают стержни для регуляции, специализированное стекло и керамику.
У гафния относительно низкий показатель работы электронного выхода (3,53эВ) и по этой причине его могут использовать при производстве катодов и электронных пушек. В ядерных реактивных газофазных двигателях можно найти бориды и карбиды гафния, а точнее в некоторых структурных элементах.

Гафний применение находит даже при изготовлении электрогенераторов термоэмиссионного типа и часто встречается в ионных двигателях. На основе HfO2 создаются диэлектрики, имеющие высокий уровень диэлектрической проницаемости. В будущем планируется замена привычного всем оксид кремния в микроэлектронике на оксид HfO2. Эта замена позволит повысить показатель плотности элементов в чипе.
В заключение можно сказать, что гафний, применение которого имеет место во множестве отраслей человеческой деятельности, начиная повседневной и заканчивая военной и атомной, является чрезвычайно важным элементом. Это очень востребованный металл и в природе всегда сопутствует цирконию. Редкость и его особенности качественных характеристик обусловливают довольно высокую стоимость.
Источник: fb.ru
Гафний

Области знаний: Общие вопросы химии Символ: Hf Атомный номер: 72 Группа элементов: Переходные металлы Относительная атомная масса: 178,49 а. е. м. Радиус атома: 156 пм Электроотрицательность: 1,3 ед. по шкале Полинга Агрегатное состояние: Твёрдое Плотность при н. у.: 13,31 г/см³ Температура плавления: 2230 °C Температура кипения: 4600 °C
Химические элементы Химические элементы
Гафний
Га́фний (лат. Hafnium), Hf, химический элемент IV группы короткой формы (4-й группы длинной формы) периодической системы , переходный металл , атомный номер 72, атомная масса 178,49. Природный гафний состоит из шести изотопов – слаборадиоактивного 174 Hf (0,16 %, α-излучатель, период полураспада Т1/2 2·10 15 лет) и стабильных: 176 Hf 5,26 %), 177 Hf (18,60 %), 178 Hf (27,28 %), 179 Hf (13,62 %) и 180 Hf (35,08 %). Искусственно получены радиоактивные изотопы с массовыми числами 151, 154–185.
Историческая справка
Положение гафния в периодической системе предсказано Д. И. Менделеевым в 1870 г. Элемент был обнаружен Г. К. фон Хевеши и нидерландским физиком Д. Костером в 1923 г. при рентгеноспектральном анализе руд циркония ; название происходит от позднелатинского Hafnia, что означает Копенгаген – место открытия элемента. В ковком состоянии впервые получен нидерландскими химиками Я. Х. де Буром и А. ван Аркелом в 1925 г.
Распространённость в природе
Содержание гафния в земной коре 3,2·10 –4 % (по массе); гафний принадлежит к рассеянным элементам , не имеет собственных минералов и в природе сопутствует цирконию . Наиболее богаты гафнием редкие минералы наэгит, малакон (оба содержат до 7,0 % по массе гафния) и альвит (до 15 % по массе).

Образец гафния. Образец гафния.
Свойства
Конфигурация внешней электронной оболочки атома 5d 2 6s 2 ; в соединениях проявляет степень окисления +4, редко +3, +2; электроотрицательность по Полингу 1,3; атомный радиус 156 пм, ионный радиус Hf 4+ 82 пм ( координационное число 6).
Гафний – серебристо-белый (в виде порошка – тёмно-серый) пластичный металл , tпл 2230 °C, tкип около 4600 °C, плотность 13 310 кг/м 3 ; ниже 1740 °C устойчива гексагональная плотноупакованная α-модификация, выше – кубическая β-модификация. Теплоёмкость (при постоянном давлении, в стандартном состоянии) 25,7 Дж/(моль·К), теплопроводность при нагревании от 50 до 500 °C уменьшается от 22,3 до 20,5 Вт/(м·К), удельное электрическое сопротивление составляет 40,0·10 –8 Ом·м (20 °C) и 170·10 –8 Ом·м (1500 °C).
Гафний обладает высокими поперечным сечением захвата тепловых нейтронов 115·10 –28 м 2 и эмиссионной способностью – работа выхода электрона для α alpha α -модификации 3,53 эВ. Модуль Юнга равен 78 ГПа, коэффициент Пуассона 0,37, твёрдость по Бринеллю 1700 МПа. Механические свойства гафния зависят от содержания примесей и определяются способом его получения и рафинирования. Чистый гафний поддаётся прокатке, ковке, штамповке.
В компактном виде гафний устойчив на воздухе и лишь при нагревании до 500–600 °C начинает медленно окисляться, выше 700 °C образуется диоксид HfO2. Порошкообразный гафний пирофорен . До температуры 300 °C устойчив к действию паров воды. Не взаимодействует с растворами щелочей, до 100 °C – с HCl, H2SO4 и HNO3, но растворяется в смесях минеральных кислот, особенно в присутствии фторид-ионов. При нагревании взаимодействует с галогенами , образуя тетрагалогениды. Образует нитрид HfN, карбид HfC, силициды HfSi, HfSi2 и другие, которые принадлежат к тугоплавким соединениям.
К важнейшим соединениям гафния относятся диоксид HfO2, тетрафторид HfF4, тетрахлорид HfCl4, тетраиодид HfI4, гидроксиды общей формулы HfO2·xH2O, гидроксонитрат Hf(OH)2(NO3)2·H2O, гафнаты (соли гидроксидов), фторогафнаты (комплексы тетрафторида гафния с фторидами металлов).
Получение
Гафний получают попутно с цирконием из концентратов циркониевых руд, обогащённых гафнием; от соединений Zr отделяют методами жидкостной экстракции в нитратных средах или солевой ректификацией тетрахлоридов. Металлический гафний в виде губки производят восстановлением тетрахлорида гафния магнием, в виде слитка – тетрафторида гафния кальцием. В виде порошка гафний получают восстановлением диоксида кальцием при 1000–1100 °C или гексафторогафната калия K2HfF6 натрием в расплаве NaCl – KCl при 700–800 °C, а также электролитическим восстановлением K2HfF6 и других солей в расплаве NaCl – KCl при 700–900 °C. Чистый гафний получают методом иодидного рафинирования по обратимой транспортной химической реакции образования и термического разложения HfI4 в атмосфере паров иода. Особо чистый гафний получают электронно-лучевой плавкой иодидного гафния.
Применение
Соединения гафния применяют при изготовлении органов регулирования ядерных реакторов , защитных контейнеров, боксов и экранов при хранении, транспортировке и переработке ядерного топлива . Гафний используют для легирования жаропрочных сплавов в авиационной и судостроительной промышленности, в качестве материала катодов плазменных установок. Интерметаллические соединения гафния с Со и Ni – основа катализаторов гидрогенизации и гидрогенолиза органических соединений. Диоксид гафния используют при изготовлении керамики , тетрафторид гафния – как компонент фторидных стёкол. Тугоплавкие соединения гафния применяют в виде износостойких покрытий инструментов, лопаток газовых турбин.
Раков Эдуард Григорьевич . Первая публикация: Большая российская энциклопедия, 2006.
Источник: bigenc.ru