Химический элемент используемый на водосточных установках
Ответы на вопрос Химический элемент используемый на водосточных установках
- Ванадий — Элемент побочной подгруппы пятой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 23. Обозначается символом V. Простое вещество ванадий 7 букв
- Кальций — Элемент главной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 20. Обозначается символом Ca. Простое вещество кальций 7 букв
- Палладий — Элемент побочной подгруппы восьмой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 46. Обозначается символом Pd. Простое вещество палладий 8 букв
- Цирконий — Элемент побочной подгруппы четвёртой группы пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 40. Простое вещество цирконий 8 букв
- Технеций — Элемент побочной подгруппы седьмой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 43. Обозначается символом Tc. Простое вещество технеций 8 букв
- Технеций — Химический элемент, радиоактивный элемент, металл 8 букв
- Кислород — Элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Обозначается символом O. Кислород 8 букв
- Криптон — Элемент главной подгруппы восьмой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 36. Обозначается символом Kr. Простое вещество криптон 7 букв
- Кремний — Элемент главной подгруппы четвертой группы третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 14. Обозначается символом Si 7 букв
- Стронций — Элемент главной подгруппы второй группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 38. Обозначается символом Sr. Простое вещество стронций 8 букв
- Сера — Элемент шестой группы третьего периода главной подгруппы периодической системы химических элементов Д. И. Менделеева, с атомным номером 16. Проявляет неметаллические свойства. Обозначается символом S. В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде 4 буквы
- Литий — Элемент главной подгруппы первой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 3. Простое вещество литий 5 букв
- Радон — Элемент главной подгруппы восьмой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 86. Обозначается символом Rn. Простое вещество радон в нормальных условиях 5 букв
- Серебро — Элемент побочной подгруппы первой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 47. Обозначается символом Ag 7 букв
- Натрий — Элемент главной подгруппы первой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 11. Обозначается символом Na. Простое вещество натрий 6 букв
- Азот — Химический элемент, газ без цвета и запаха, составляющий основную часть воздуха и являющийся одним из главных элементов питания растений 4 буквы
- Азот — Элемент главной подгруппы пятой группы второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 7. Обозначается символом N. Простое вещество азот 4 буквы
- Бор — Элемент главной подгруппы третьей группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 5. Обозначается символом B. В свободном состоянии бор 3 буквы
- Сплав — Макроскопически однородная смесь двух или большего числа химических элементов с преобладанием металлических компонентов. Основной или единственной фазой сплава, как правило, является твёрдый раствор легирующих элементов в металле, являющемся основой сплава 5 букв
- Свинец — Элемент главной подгруппы четвёртой группы, шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 82. Обозначается символом Pb. Простое вещество свинец 6 букв
Источник: wordparts.ru
ЯНТАРЬ🔥Состав и Свойства💥Календарь Камней💎Ювелирная Страничка✅Энциклопедия Драгоценных Камней✅💥
ПОЛУДРАГОЦЕННЫЕ КАМНИ,СВОЙСТВА И ОПИСАНИЕ (Алмаз,Изумруд,рубин,сапфир,коралл)# натуральные камни#
Стелланин мазь: инструкция по применению

Если приготовление пирога по бабушкиному рецепту для вас обернулось ожогом, не стоит мазать его маслом (пирог — можно). Мы рекомендуем промыть травмированное место проточной холодной водой и обратиться к врачу за заживляющим средством.
После осмотра пострадавшего места доктор выписывает рецепт на мазь Стелланин. Что это за мазь, какой у нее состав, чем она отличается от Стелланина ПЭГ и Левомиколя, мы спросили у провизора Анны Суменковой.
Стелланин: состав
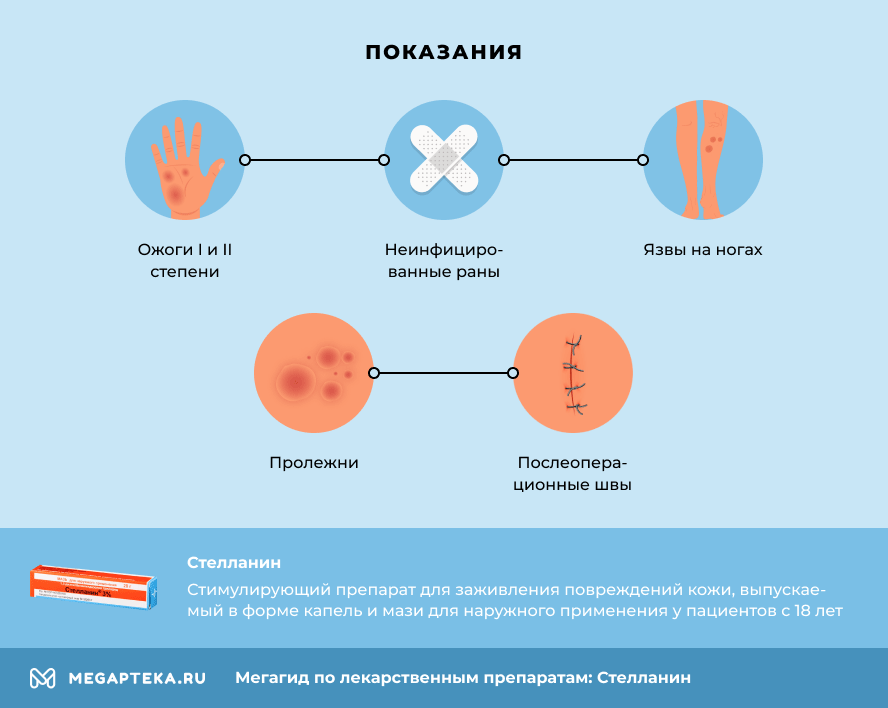
Стелланин — это мазь для наружного применения. Ее применяют для помощи и ускорения заживления поврежденной кожи.
- ожоги I и II степени
- неинфицированные, то есть чистые, но долго заживающие раны, порезы, царапины
- язвы на ногах
- пролежни
- послеоперационные швы
В состав Стелланина входит действующее вещество — диэтилбензимидазолия трийодид (1,3-диэтилбензимидазолия трийодид). Вспомогательные компоненты: повидон К17, димексид, глицерол, вазелин.
Вам может быть интересно: Лучшее средство от ожогов кипятком, чем лечить химический ожог
Стелланин и Стелланин ПЭГ — чем отличаются
Отличия Стелланин от Стелланин ПЭГ заключаются в том, что первый препарат применяют для заживления «чистых» ран, а второй для ран с гнойным поражением. Так Стелланин ПЭГ относится к группе антисептических средств с антибактериальным действием.
Стелланин мазь: аналоги
Стелланин не имеет аналогов по действующему веществу. Но по оказываемому действию их можно насчитать более 50 видов.
- Корнерегель
- Бепантен
- Д-Пантенол
- Ретиналамин
- Метилурацил и другие.
Хотите разбираться в аналогах лекарств, чтобы умело подбирать препараты на свой бюджет? Наша методичка от экспертов-провизоров «Аналоги популярных лекарств» поможет вам в этом! Получить методичку просто: подпишитесь на наши соцсети и напишите в сообщения «аналоги».
Мегаптека в соцсетях: ВКонтакте, Telegram, OK, Viber
Источник: megapteka.ru
Серная кислота
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.

Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.


Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
- температура: оптимальной температурой для протекания прямой реакции с максимальным выходом SO3 является температура 400-500 о С. Для того чтобы увеличить скорость реакции при столь низкой температуре в реакцию вводят катализатор – оксид ванадия (V) V2O5.
- давление: прямая реакция протекает с уменьшением объемов газов. Для смещения равновесия вправо процесс проводят при повышенном давлении.
Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3.
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота .
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , серная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например , серная кислота взаимодействует с гидрокарбонатом натрия:
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например , хлорида натрия:
4. Т акже серная кислота вступает в обменные реакции с солями.
Например , серная кислота взаимодействует с хлоридом бария:
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , серная кислота реагирует с железом. При этом образуется сульфат железа (II):
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Концентрированная серная кислота является сильным окислителем . При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например , концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
Источник: chemege.ru
В России усовершенствовали правовое регулирование в сфере драгоценных металлов и камней
Новым законом вводится термин «художник-ювелир» — сообщает «Парламентская газета». Будут установлены соответствующие требования к изготовителям ювелирных украшений.
Данный закон направлен на совершенствование правового регулирования в сфере драгоценных металлов и драгоценных камней.
Документом также предусматривается разделение лицензированной деятельности на скупку ювелирных изделий и на заготовку ювелирной продукции.

Ранее стало известно, что представлен логотип Социального фонда, который заменит ПФР с 1 января 2023 года.
Источник: ivbg.ru