Важнейшей задачей потенциометрии является измерение рН водных растворов. Ясно, что для этой цели в принципе подходит любой электрод, потенциал которого зависит от концентрации (активности) ионов водорода. Можно использовать, например, водородный электрод, стеклянный электрод
Представляет собой платиновую пластину, покрытую платиновой чернью (рыхлой платиной) и опущенную в раствор кислоты, в которой активность ионов водорода равна 1 моль/л и через который все время пропускается чистый газообразный водород под давлением 1 атм (101, 3 кПа).
Условное обозначение Н + | ½ Н2, Pt
На водородном электроде протекают обратимые процессы
Н2 «2H «2 Н + + 2 ē
Потенциал стандартного водородного электрода принят за нуль при любой температуре:
j 0 (Н + | ½ Н2) = 0 В.
Водородный электрод не очень удобен в работе, но важен в термодинамическом отношении, поскольку он служит первичным стандартом, относительно которого определяются потенциалы других электродов. На практике в качестве электрода сравнения используют хлорсеребряный электрод.
Тавровое соединение. Козыряние электрода. Поиск причин…
Состоит из серебряной проволоки, покрытой слоем малорастворимой соли AgCl, опущенной в насыщенный раствор КСl и солевого мостика соединяющего этот раствор с исследуемым раствором.
Электрохимическая цепь хлорсеребряного электрода записывается так:
Ag | AgCl, КСl (нас.)
В хлорсеребряном электроде на межфазной границе протекает реакция:
AgCl (т) + ē «Ag (т) + Cl –
Т.к. активность твердых веществ AgCl и Ag постоянна, то потенциал хлорсеребряного электрода зависит только от активности ионов хлора в растворе.
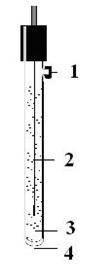
1 – отверстие для заливки раствора электролита
2 – серебряная проволочка, покрытая слоем AgCl
3 – раствор KCl
Рис. 3. Устройство хлорсеребряного электрода сравнения.
Потенциал хлорсеребряного электрода постоянен, легко воспроизводим и практически не зависит от протекания побочных реакций.
Источник: studopedia.su
Большая Энциклопедия Нефти и Газа
Наличие хлоридного аниона в мембранной фазе должно обеспечить стабильный во времени потенциал хлорсеребряного электрода , а проведенное нами исследование пленочной мембраны такого же состава показало, что двукратного избытка валиномицина и тетрафенилбората калия над хлоридом тетрадециламмония достаточно для того, чтобы избежать влияния анионооб-менника на калиевую функцию. Хлоридный анион не липофилен, но CDB-ды, в которых должен работать миниатюрный калиевый ИСЭ, отличаются высокой концентрацией хлоридов при низком содержании других анионов. Поэтому можно надеяться, что скорость вымывания хлоркдны: -: иг — нов из мембраны не будет превышать скорость вымывание тетгадетдл-аммония и, следовательно, будет мала. Исследование подученных электродов с твердым контактом показало, что по пределам функ: шонир — вания, крутизне и селективности они не уступают электродам с внутренним водным раствором. [20]
Лекция 2 Электрохимическое равновесие
Кроме того, в растворе не должны находиться вещества, искажающие потенциал хлорсеребряного электрода . Однако экспериментальные трудности, связанные с водородным электродом, могут быть устранены, путем замены последнего стеклянным электродом. [21]
Если концентрация хлор-ионов в исследуемом растворе строго постоянна, то в трубку втягивают испытуемый раствор и определяют потенциал хлорсеребряного электрода 3, сравнивая его с каломельным или водородным. [22]
Электропроводно-удельное электрическое сопротивление в зависимости от применяемого состава равно 100 — 1000 Ом — см. Осуществляет протекторную защиту — первоначальный потенциал относительно хлорсеребряного электрода составляет минус 0 85 — 0 95 В. Для реализации эффекта протекторной защиты рекомендуется наносить покрытие ЦВЭС на всю поверхность резервуара, включая днище, стенку и кровлю.
Покрытие не накапливает статического электричества; не образует искр при ударе о посторонние предметы. Прочность покрытия на растяжение идентична прочности защищаемого металла, в результате чего сохраняется сплошность покрытия при деформациях резервуаров в процессе эксплуатации. Покрытие не горючее, содержит в своем составе 90 — 95 % металлического цинка. Покрытие экологически безопасно и ремонтопригодно. Поврежденные места зачищаются, обезжириваются и закрашиваются. [23]
К — постоянная, которая зависит от сорта стекла, из которо: го изготовлен шарик электрода, и потенциала хлорсеребряного электрода . [25]
Исследуемый раствор должен содержать ион хлора в количестве, известном с точностью до 1 %, если необходимо иметь точность в несколько тысячных единицы р ( ан а) — Кроме того, в растворе не должны находиться вещества, искажающие потенциал хлорсеребряного электрода . Однако экспериментальные трудности, связанные с водородным электродом, могут быть устранены, путем замены последнего стеклянным электродом. [26]
Электропроводно-уделмюе электрическое сопротивление в зависимости от применяемого состава равно 100 — 1000 Омхм. Осуществляет протекторную защиту — первоначальный потенциал относительно хлорсеребряного электрода составляет минус 0 85 — 0 95 В. Для реализации эффекта протекторной защиты рекомендуется наносить покрытие ЦВЭС на всю поверхность резервуара, включая днище, стенку и кровлю.
Покрытие не накапливает статического электричества; не образует искр при ударе о посторонние предметы. Прочность покрытия на растяжение идентична прочности защищаемого металла, в результате чего сохраняется сплошность покрытия при деформациях резервуаров в процессе эксплуатации. Покрытие не горючее, содержит в своем составе 90 — 95 % металлического цинка. Покрытие экологически безопасно и ремонтопригодно. Поврежденные места зачищаются, обезжириваются и закрашиваются. [27]
При погружении электродов в измерительную среду элементарный хлор восстанавливается на индикаторном электроде. Процесс восстановления происходит при постоянном потенциале, близком к потенциалу хлорсеребряного электрода . Возникающий в результате восстановления ток прямо пропорционален концентрации хлора в воде. [28]
В качестве электродов сравнения наиболее распространен хлорсеребряный электрод ( Ag, AgCl / KCl), который изготовляют электролитическим нанесением хлорида серебра на серебряную проволочку. Электрод погружают в раствор хлорида калия, который находится в сосудах, связанных солевым мостиком с анализируемым раствором. Потенциал хлорсеребряного электрода постоянен и не зависит от состава анализируемого раствора. Постоянство потенциала электрода сравнения достигается поддержанием в контактирующем внутреннем растворе постоянной концентрации веществ, на которые реагирует электрод. [29]
Хлорсеребряный электрод обычно изготавливают из серебряной проволоки, которую путем анодной обработки в хлоридном растворе покрывают тонким слоем хлорида серебра. Вместо серебряной проволоки иногда используют платиновую проволоку, электролитически покрытую серебром. Потенциал хлорсеребряного электрода является линейной функцией логарифма активности хлорид-ионов в растворе. [30]
Источник: www.ngpedia.ru
Хлорсеребряный электрод сравнения
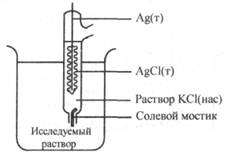
Хлорсеребряный электрод (рис. 25.7) состоит из серебряной проволоки, покрытой слоем малорастворимой соли AgCl, опущенной в раствор КСl определенной концентрации (обычно насыщенный раствор КСl) и солевого мостика, соединяющего этот раствор с исследуемым раствором. Электрохимическая цепь хлорсеребряного электрода записывается так: Ag | AgCl, КСl(нас).
 |
В хлорсеребряном электроде на межфазной границе протекает следующая реакция:
Так как активность твердых веществ AgCl и Ag постоянна, то потенциал хлорсеребряного электрода зависит только от активности ионов Сl- в растворе. Если активность ионов Сl- поддерживать постоянной, то и потенциал хлорсеребряного электрода будет постоянной величиной. Проще всего поддерживать постоянной активность ионов хлора в растворе, используя насыщенный раствор КСl, в котором а(Сl-) = const. В этом случае потенциал хлорсеребряного электрода по отношению к стандартному водородному электроду при 25 °С фхл.сер = 0,197 В.
 |
В гальваническом элементе хлорсеребряный электрод в зависимости от потенциала второго электрода может быть как анодом, так и катодом. В случае анода протекают реакции окисления серебра и взаимодействия его катиона с
Рис. 25.7. Хлорсеребряный электрод сравнения
анионом хлора с образованием осадка AgCl:

В случае катода в системе происходит растворение осадка AgCl и восстановление катионов Ag + :

Потенциал хлорсеребряного электрода постоянен, легко воспроизводим и практически не зависит от протекания побочных реакций.
До недавнего времени в качестве электрода сравнения широко использовался каломельный электрод Hg | Hg2Cl2, Сl-, который устроен аналогично хлорсеребряному электроду. На поверхность ртути нанесен слой малорастворимой соли Hg2Cl2 (каломель). Над поверхностью каломели находится насыщенный раствор КСl, который определяет растворимость Hg2Cl2, а следовательно, и концентрацию ионов Hg2 +2 в системе. При этих условиях потенциал каломельного электрода постоянен и равен 0,241 В. В настоящее время каломельный электрод стараются не использовать из-за высокой токсичности ртути и ее солей.
Воспользуйтесь поиском по сайту:

studopedia.org — Студопедия.Орг — 2014-2023 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.011 с) .
Источник: studopedia.org