Хлорат серебра — неорганическое соединение, соль металла серебра и хлорноватой кислоты с формулой AgClO3, бесцветные кристаллы, растворяется в воде.
Получение
- Растворение оксида или карбоната серебра I:
- Пропускание хлора через суспензию оксида серебра I:
- Обработка раствора нитрата серебра I хлоратом калия:
Физические свойства
Хлорат серебра образует бесцветные кристаллы тетрагональной сингонии, пространственная группа I 4/mmm, параметры ячейки a = 0,8486 нм, c = 0,7894 нм, Z = 8.
Растворяется в воде, слабо растворяется в этаноле.
Химические свойства
- Разлагается при нагревании:
Применение
- Смесь хлората серебра с серой взрывается при ударе, трении или нагревании.
Соединения серебра
- Серебро (Ag)
- Азид серебра (AgN3) Тринитрид серебра
- Амид серебра (AgNH2)
- Антимонид серебра I (Ag3Sb)
- Арсенат серебра I (Ag3AsO4) Арсенат серебра
- Арсенид серебра I (Ag3As) Арсенид трисеребра
- Ацетат серебра (AgC2H3O2) Серебро уксуснокислое
- Ацетиленид серебра (Ag2C2)
- Бензоат серебра (AgC7H5O2) Серебро бензойнокислое
- Бромат серебра I (AgBrO3) Серебро бромноватокислое
- Бромид серебра I (AgBr) Серебро бромистое
- Вольфрамат серебра (Ag2WO4) Серебро вольфрамовокислое
- Гексафторогерманат серебра (Ag2[GeF6])
- Гидроксид серебра (AgOH) Гидроокись серебра
- Гидрофосфат серебра (Ag2HPO4) Фосфорнокислое серебро кислое
- Гипонитрит серебра (Ag2N2O2) Серебро азотноватистокислый
- Диборид серебра (AgB2) Серебро бористое
- Дигидрофосфат серебра (AgH2PO4)
- Дихромат серебра (Ag2Cr2O7) Бихромат серебра (Серебро двухромовокислое)
- Йодат серебра (AgIO3) Серебро йодноватокислое
- Йодид серебра I (AgI) Серебро йодистое
- Карбонат серебра I (Ag2CO3) Серебро углекислое
- Лактат серебра (AgC3H5O3) Серебро молочнокислое
- Лаурат серебра (AgC12H23O2) Серебро лауриновокислое
- Метафосфат серебра (AgPO3) Серебро фосфорнокислое
- Молибдат серебра (Ag2MoO4) Серебро молибденовокислое
- Нитрат серебра I (AgNO3) Серебро азотнокислое (Ляпис или адский камень)
- Нитрат серебра II (Ag(NO3)2) Азотнокислое серебро
- Нитрид серебра I (Ag3N)Серебро азотистое
- Нитрит серебра I (AgNO2) Серебро азотистокислое
- Оксалат серебра (Ag2C2O4) Серебро щавелевокислое
- Оксид серебра I (Ag2O) Окись серебра
- Оксид серебра III (Ag2O3)
- Оксид серебра I,III (Ag2O2) Серебро окись
- Ортоарсенит серебра I (Ag3AsO3) Арсенит серебра
- Ортофосфат серебра I (Ag3PO4)
- Пальмитат серебра (AgC16H31O2) Серебро пальмитиновокислое
- Периодат серебра (AgIO4) Серебро йоднокислое
- Перманганат серебра (AgMnO4) Серебро марганцовокислое
- Перренат серебра (AgReO4) Серебро рениевокислое
- Перхлорат серебра (AgClO4) Серебро хлорнокислое
- Пирофосфат серебра (Ag4P2O7) Дифосфат серебра
- Пропионат серебра (AgC3H5O2) Серебро пропионовокислое
- Реактив Толленса ([Ag(NH3)2]ОН)
- Селенат серебра (Ag2SeO4) Серебро селеновокислое
- Селенид дисеребра (Ag2Se) Серебро селенистое
- Селенит серебра (Ag2SeO3) Серебро селенистокислое
- Субфторид серебра (Ag2F) Гемифторид серебра
- Сульфат серебра (Ag2SO4) Серебро сернокислое
- Сульфид серебра I (Ag2S) Серебро сернистое
- Сульфид серебра II (AgS) Сернистое серебро
- Сульфит серебра (Ag2SO3) Серебро сернистокислое
- Тартрат серебра (Ag2C4H4O6) Серебро виннокислое
- Теллурид серебра (AgTe) Серебро теллуристое
- Теллурид серебра I (Ag2Te) Теллурид дисеребра
- Теллурит серебра (Ag2TeO3) Серебро теллуристокислое
- Тетрафтороборат серебра (Ag[BF4]) Тетрафторобориат серебра
- Тиоантимонит серебра (Ag3SbS3) Серебро тиосурьмянистокислое
- Тиосульфат серебра (Ag2S2O3) Серебро тиосернокислое
- Тиоцианат серебра I (AgSCN) Серебро роданистое
- Фосфид серебра (Ag3P) Серебро фосфористое
- Фторид серебра I (AgF) Серебро фтористое
- Фторид серебра II (AgF2) Фтористое серебро
- Фульминат серебра (AgONC) Гремучее серебро
- Хлорат серебра (AgClO3) Серебро хлорноватокислое
- Хромат серебра (Ag2CrO4) Серебро хромовокислое
- Хлорид серебра I (AgCl) Серебро хлористое
- Хлорит серебра (AgClO2) Серебро хлористокислое
- Цианамид серебра (Ag2CN2)
- Цианат серебра (AgOCN) Серебро циановокислое
- Цианид серебра I (AgCN) Серебро цианистое
- Цитрат серебра (Ag3C6H5O7) Серебро лимоннокислое
Источник: chem.ru
Большая Энциклопедия Нефти и Газа
Так как хлорат серебра слегка разлагается на свету ( темнеет), то его следует хранить в темной склянке. Хлорат серебра безопасен в употреблении, однако ввиду того, что хлораты являются энергичными окислителями, хлорат серебра следует хранить вдалеке от легко окисляющихся веществ. [2]
В общем случае хлораты серебра и бария дают лучшие выходы син-вицннальных диолов и легче удаляются после за-иершення реакции, хотя и комбинация тетраоксид осмии-хлорат натрия, иногда тгазынаемая реагентом Гофмана, также широко применяется, несмотря на некоторые недостатки. [3]
Что происходит при введении хлората серебра в раствор азотистой кислоты. [4]
Бромат серебра AgBr03 — растворим труднее хлората серебра , его растворимость составляет 0 009 моля соли в 1 л воды. [5]
Получают путем обменной реакции хлорида с хлоратом серебра . Выделяется из маточного раствора при медленном испарении в виде мелких бесцветных кристаллов моно-клинно-призматической системы. [7]
Термические электроды изготавливают путем разложения смеси оксида серебра и хлората серебра . Для образования однородной массы к указанной смеси добавляют воду. Полученной пастой покрывают спираль из платиновой проволоки и нагревают ее до 650 С, после чего медленно охлаждают. [8]
Описанная ниже методика основана на различных растворимостях нитрата и хлората серебра и соответствующих солей натрия. Хлорат серебра получается в результате взаимодействия концентрированных растворов нитрата серебра и хлората натрия. [9]
Синтезирован каталитическим гидрированием аллозы; получен также окислением 1 2-дивинилэтиленгликоля хлоратом серебра и осмиевой кислотой. [10]
Промежуточное образование ацилоний-иона следует еще и из того факта, что при обработке раствора хлористого ацетила в бензоле хлоратом серебра образуется ацетофенон. [11]
Промежуточное образование ацилоний-иона следует еще и из того факта, что при обработке раствора хлористого ацетила в бензоле хлоратом серебра образуется ацетофенон. [12]
Иодиафталин был получен также иодированием нафтали на S2J2 в присутствии HNO3; иодом в уксусной кислоте в при сутствии нитрозилсернон кислоты и дымящей НМОз; иодом в присутствии хлората серебра и окиси магния. Он был получен также из иодозонафталина; из диазотированного сс-нафтклами-на и HJ; из 1 1-дипафтилртути. [13]
Другими методами, применяемыми для синтеза некоторых ацвлоииов, являются следующие: 1) дейстние реактива 1 риньяра па а-оксинитрил и на карбопил никеля, 2) гидролиз й-галоид-кетопов, 3) окисление аллсна с помощью хлората серебра в присутствии четырехокисв осмия, 4) взаимодействие зтинилнарби нола с уксусной кислотой или итилспгликолем и присутствии окиси ртути и трехфтористого Сора с 1Госледующим гидролизом образующегося ацетата или диоксолана, 5) реакция глиоксалн с ароматическим углеводородом н присутствии хлористого алюминия, ( i) парциальное восстановление 1 2-дикетопов, 7 окисление 1 2-гликолей и 8) фотохимические и биологические синтезы. [14]
Описанная ниже методика основана на различных растворимостях нитрата и хлората серебра и соответствующих солей натрия. Хлорат серебра получается в результате взаимодействия концентрированных растворов нитрата серебра и хлората натрия. [15]
Источник: www.ngpedia.ru
Хлорат серебра осадок или нет

Хлорид серебра I (хлористое серебро) — AgCl, неорганическое бинарное соединение серебра с хлором, серебряная соль хлороводородной (соляной) кислоты. В нормальных условиях представляет собой белый порошок или бесцветные кристаллы. Встречается в природе в виде минерала хлораргирита.
Молекулярная и кристаллическая структура
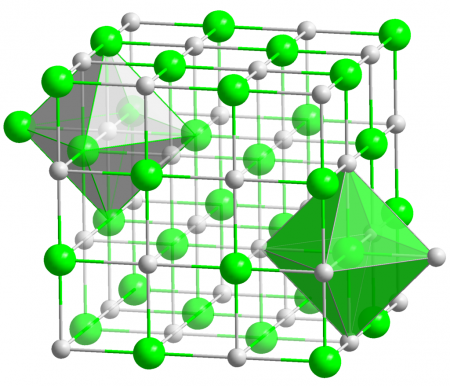
Хлорид серебра имеет следующий элементный состав: Ag (75,26 %), Cl (24,74 %). Атом серебра в молекуле находится в состоянии sp 3 d 2 -гибридизации. Энергия разрыва связи в соединении (Есв.): 313 кДж/моль, длина связи Ag—Cl: 0,228 нм.
Кристаллы AgCl принадлежат к кубической сингонии, структура типа NaCl, пространственная группа Fm3m, параметры элементарной ячейки a = 0,5549 нм, Z = 4. Центральный атом образует с соседями октаэдр, координационное число равно 6.
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера.
Физические свойства
Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро».
Хлорид серебра чрезвычайно мало растворим в воде: при 25 °C произведение растворимости (ПР) составляет 1,77⋅10 −10 . С повышением температуры растворимость соединения повышается: при 100 °C ПР = 2,81⋅10 −8 . Нерастворим в минеральных кислотах, этиловом и метиловом спирте, ацетоне. Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке. Из-за образования комплексных соединений хлорид серебра заметно растворим в концентрированной соляной кислоте и растворах хлоридов.
- стандартная энтальпия образования, ΔH°298: −127 кДж/моль;
- стандартная энтропия, S°298: 96 Дж/(моль·K);
- стандартная энергия Гиббса, ΔG°298: −110 кДж/моль.
- стандартная мольная теплоемкость, Cp°298: 50,79 Дж/(моль·K);
- энтальпия плавления, ΔHпл: 13,2 кДж/моль;
- энтальпия кипения, ΔHкип: 184 кДж/моль.
Зависимость давления насыщенного пара (P, в барах) для соединения в диапазоне температур (T) от 1185 до 1837 K выражается следующим уравнением:
log10 P = 4,95155 − 8775,980/T−62,718
Получение
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы):

Химические свойства
- Разлагается при комнатной температуре под действием света:
2 AgCl = 2 Ag + Cl2
- Образует с гидратом аммиака, тиосульфатами и цианидами щелочных металлов растворимые комплексные соединения:
- Вступает в окислительно-восстановительные реакции, восстанавливаясь до металлического серебра:
4 AgCl + 2 BaO → >324oC 2 BaCl2 + 4 Ag + O2 2 AgCl + Zn = ZnCl2 + 2 Ag ↓ 2 AgCl + 2 KOH + H2O2 = 2 KCl + 2 Ag ↓ + O2 ↑ + 2 H2O Окислительные свойства хлорида серебра используется для извлечения металла из серебросодержащих отходов: 4 AgCl + 2 Na2CO3 → 850−900oC 4 NaCl + 4 Ag + 2 CO2 + O2 4 AgCl + CH2O + 6 NaOH = 4 Ag ↓ + Na2CO3 + 4 NaCl + 4 H2O
- Растворяется в концентрированных растворах хлоридов и соляной кислоты, образуя комплексы:
- Медленно реагирует с концентрированной серной кислотой при кипячении:
- В растворах жидкого аммиака из-за растворимости в нём соли можно провести обменные реакции, недоступные в водных растворах:
Применение
- Светочувствительный компонент фотографических эмульсий различных фотографических материалов;
- Компонент электродов химических источников тока на основе систем Ag/AgCl/Cl − ;
- Компонент электропроводящих стёкол;
- Материал для линз в ИК-спектроскопии;
- Промежуточный продукт, образующийся при извлечении серебра из сульфидной руды:
- Реагент для получения сереброорганических соединений:
AgCl + R−MgBr = R−Ag + MgBrCl
- Входит в состав антимикробных композиций на основе ионов серебра.
Безопасность
Соединение может вызвать раздражающий эффект при контакте с кожей и слизистыми оболочками.
Хлорат серебра
 |
|
| Хлорат серебра | |
| Хлорноватокислое серебро | |
| AgClO3 | |
| бесцветные кристаллы | |
| 191,32 г/моль | |
| 4,430 г/см³ | |
| Температура | |
| 230 °C | |
| 270 °C | |
| Растворимость | |
| 10 15 ; 50 80 г/100 мл | |
| 7783-92-8 | |
| 9815505 | |
| 232-034-9 | |
Хлорат серебра — неорганическое соединение, соль металла серебра и хлорноватой кислоты с формулой AgClO3, бесцветные кристаллы, растворяется в воде.
- Пропускание хлора через суспензию оксида серебра I:
- Обработка раствора нитрата серебра I хлоратом калия:
Физические свойства
Хлорат серебра образует бесцветные кристаллы тетрагональной сингонии, пространственная группа I 4/mmm, параметры ячейки a = 0,8486 нм, c = 0,7894 нм, Z = 8.
Растворяется в воде, слабо растворяется в этаноле.
Источник: ollimpia.ru