Хлорид натрия: способы получения и химические свойства
Хлорид натрия NaCl — соль щелочного металла натрия и хлороводородной кислоты. Белое кристаллические вещество. Плавится и кипит без разложения. Умеренно растворяется в воде (гидролиза нет);
Относительная молекулярная масса Mr = 58,44; относительная плотность для ж. и тв. состояния d = 2,165; tпл = 800,8º C; tкип = 1465º C;
Способ получения
1. Хлорид натрия можно получить путем взаимодействия натрия и разбавленной хлороводородной кислоты, образуются хлорид натрия и газ водород:
2Na + 2HCl = 2NaCl + H2↑.
2. При комнатной температуре, в результате взаимодействия натрия и хлора, образуется хлорид натрия:
2Na + Cl2 = 2NaCl
3. Концентрированный раствор гидроксида натрия реагирует с концентрированным раствором хлорида аммония при кипении. При этом образуются хлорид натрия, газ аммиак и вода:
NaOH + NH4Cl = NaCl + NH3↑ + H2O
4. При взаимодействии с разбавленной и холодной хлороводородной кислотой пер окси д натрия образует хлорид натрия и пероксид водорода:
5. Разбавленная хлороводородная кислота реагирует с гидроксидом натрия . Взаимодействие хлороводородной кислоты с гидроксидом натрия приводит к образованию хлорида натрия и воды:
NaOH + HCl = NaCl + H2O
6. В результате взаимодействия сульфата натрия и хлорида бария образуется сульфат бария и хлорид натрия:
Качественная реакция
Качественная реакция на хлорид натрия — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра , хлорид натрия образует нитрат натрия и осадок хлорид серебра:
NaCl + AgNO3 = NaNO3 + AgCl↓
Химические свойства
1. Хлорид натрия вступает в реакцию со многими сложными веществами :
2.1. Хлорид натрия взаимодействует с кислотами :
2.1.1. Хлорид натрия в твердом состоянии при кипении реагирует с концентрированной серной кислотой с образованием сульфата натрия и газа хлороводорода:
а если температуру опустить до 50º С, то твердый хлорид натрия и концентрированная серная кислота образуют гидросульфат натрия и газ хлороводород:
2.2. Хлорид натрия способен вступать в реакцию обмена со многими солями :
2.2.1. Твердый хлорид натрия реагирует с концентрированной и горячей серной кислотой и твердым перманганатом калия . Взаимодействие хлорида натрия с перманганатом калия и серной кислотой приводит к образованию сульфата марганца, натрия, калия, газа хлора и воды:
2.2.2. Хлорид натрия взаимодействует с гидросульфатом натрия при температуре 450–800º C . При этом образуются сульфат натрия и хлороводородная кислота:
2.2.3. При взаимодействии холодного хлорида натрия с насыщенным нитритом серебра выделяются нитрат натрия и осадок хлорид серебра:
NaCl + AgNO2 = NaNO2 + AgCl↓
Лаб. 2
Раствор вещества – хлороводородная кислота
Реактив – нитрат серебра (I)
Химия 8 класс нитрат серебра с хлоридом аммония
левая пробирка – HCl
верхняя пробирка – AgNO3
правая пробирка – AgCl
Признак реакции: выпадение белого осадка хлорида серебра (I).
Раствор вещества – хлорид натрия
Реактив – нитрат серебра (I)
левая пробирка – NaCl
верхняя пробирка – AgNO3
правая пробирка – AgCl
Признак реакции: выпадение белого осадка хлорида серебра (I).
Минеральная вода совсем немного помутнела. Это значит, что в минеральной воде есть хлорд-ионы.
а) хлороводородная кислота + нитрат серебра (I)
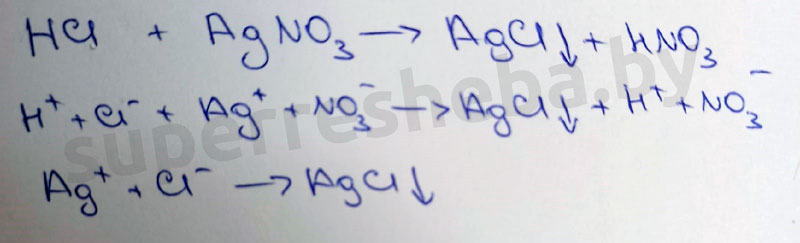
б) хлорид натрия + нитрат серебра (I)

Обнаружить хлорид-ионы в растворах можно при помощи нитрата серебра (I) – это качественная реакция на ионы хлора. Выпадение осадка обусловлено связыванием ионов хлора с ионами серебра, которые вместе образуют нерастворимый осадок.
1.Из приведённых формул CO3 2- , Cl — , NO3 — , K + , I — , Br — выберите и подчеркните формулы галогенид-ионов.
2.Из приведённых формул ионов H + , Cl — , Na + , F — выберите и подчеркните ион, который можно обнаружить в растворе с помощью нитрата серебра (I).
3.Укажите правильное утверждение:
г) в растворах можно обнаружить по реакции с ионами серебра
4.Укажите формулу иона: «В строении иона ан 17 протонов приходится 18 электронов, в электрическом поле он перемещается к аноду, не изменяет окраску индикаторов, в растворе с ионами серебра образует белый творожистый осадок». Это Cl — .
5.Имеется раствор, содержащий нитрат натрия и хлорид натрия. Предложите порядок действий, который позволит оставить в растворе только одну соль. Какую?
В раствор добавим нитрат серебра (I). В результате произойдет реакция между нитратом серебра (I) и хлоридом натрия. В результате выпадет осадок хлорида серебра (I). В растворе останется соль нитрата натрия.
Ионные уравнения реакций
Урок 37. Химия 8 класс


В данный момент вы не можете посмотреть или раздать видеоурок ученикам в личном кабинете
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно его приобрести.
Получите невероятные возможности



Конспект урока «Ионные уравнения реакций»

Основным из условий протекания ионных реакций является образование малодиссоциирующего вещества (слабого электролита), осадка или газа. Эти вещества записываются в молекулярном виде. Если выпадает осадок, то рядом с его формулой ставят стрелку, направленную вниз (↓), если образуется газ, то рядом с его формулой ставят стрелку, направленную вверх (↑).
Если к раствору хлорида натрия добавить раствор нитрата серебра, то образуется белый творожистый осадок хлорида серебра.
После записи молекулярного уравнения следует записать ионное уравнения, записав сильные электролиты в виде ионов, а образовавшийся осадок нужно записать в молекулярном виде. Две соли: хлорид натрия и нитрат серебра являются растворимыми и полностью распадаются на ионы, как и образующаяся соль – нитрат натрия, а хлорид серебра – осадок, поэтому его нужно записать в виде молекулы. Если вы забыли, как определяются заряды ионов, то нужно обратиться к таблице растворимости, в ней всегда указаны заряды ионов, а также по ней можно определить растворимо или нет вещество в воде.
Na + + Cl — + Ag + + NO3 — = Na + + NO3 — + AgCl↓
Выполнение работы. Налить в пробирку 1-2 мл раствора хлорида натрия и добавить несколько капель раствора нитрата серебра
Налить в пробирку 1-2 мл раствора хлорида натрия и добавить несколько капель раствора нитрата серебра. Что наблюдается?
Опыт 2. Реакция на ион
Налить в три пробирки по 1-2 мл растворов: в одну – серной кислоты, в другую – сульфата натрия, в третью – сульфата меди. В каждую пробирку добавить 1-2 мл раствора хлорида бария BaCl2. Что наблюдается?
Опыт 3. Реакция на ион
Налить в пробирку 1-2 мл раствора фосфата натрия и добавить несколько капель раствора нитрата серебра. Отметить цвет образующегося осадка.
Опыт 4. Реакция на ион
Поместить в пробирку небольшое количество порошкообразного карбоната кальция и добавить соляной кислоты. Что наблюдается?
Требование к результатам опытов:
Написать молекулярные и ионные уравнения реакций для каждого опыта.
Источник: mydocx.ru
Задание 1. Распознавание растворов хлорида натрия, карбоната натрия и сульфата натрия (практическая работа)
Определим, в какой из колб находятся растворы хлорида натрия NaCI, карбоната натрия Na2CO3 и сульфата натрия Na2SO4. Карбонат натрия можно обнаружить по карбонат-иону с помощью раствора соляной кислоты HCI. Карбонат натрия находится в той пробирке, где выделяется газ.
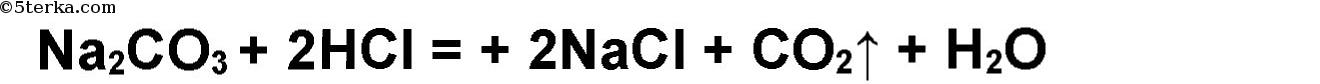
В какой из оставшихся двух пробирок хлорид натрия? Качественная реакция на хлорид-ион — реакция с нитратом серебра AgNO3. Белый осадок хлорида серебра выпадает в той пробирке, где находится хлорид натрия.
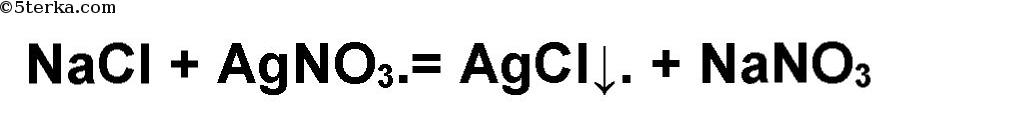
Аценат Натрия можно проверить с помощью FeCl3 (хлорида железа.) Раствор примет темно-красную окраску, за счёт появления ацетата железа(З).
Убедимся в том, что в оставшейся пробирке сульфат натрия. При добавлении хлорида бария выпадает белый осадок. Это сульфат бария.

Значит, в пробирке был действительно сульфат натрия.
Оборудование: колбы, пробирки, штатив для пробирок, пипетки.
Техника безопасности.
Соблюдать правила работы с кислотами и ядовитыми веществами — хлоридом бария и нитратом серебра. Остерегаться попадания на кожу и слизистые оболочки.
Источник:

Решебник по химии за 11 класс (О.С. Габриелян, 2007 год),
задача №1
к главе «Практическая работа №3 Распознание веществ.».
Источник: 5terka.com