Для уравнивания химической реакции, введите уравнение реакции и нажмите кнопку Уравнять. Решенное уравнение появится сверху.
- Используйте заглавные символы для начального знака элемента и строчные символы для второго знака. Примеры: Fe, Au, Co, Br, C, O, N, F.
- Ионные заряды пока не поддерживаются и не будут приняты в расчет.
- Переместите неизменные группы в соединениях, чтобы не допустить неопределенность. Например, C6H5C2H5 + O2 = C6H5OH + CO2 + H2O не уравняется, но XC2H5 + O2 = XOH + CO2 + H2O уравняется.
- Промежуточные расстояния [такие, как (s) (aq) или (g)] не требуются.
- Вы можете использовать круглые () и квадратные скобки [].
Примеры
- CuSO4 + Al + NaCl = Al2(SO4)3 + Na2O4S + CuCl
- KCl + Ag(NO3)2 = KNO3 + AgCl2
- (COCl(NH3)5)Cl2 + H2O + NH3 = CO(NH3)5(OH)3 + NH4Cl
- NIS + O2 = NIO + SO2
- C5H8O2 + NaOH = C2H3NaO2 + C3H6O
- PB(CH3COO)2 + CuSO4 = PBSO4 + Cu(CH3COO)2
- C2H5NH3Cl + KOH = KCl + C2H5NH3OH
- Cu(No3)2 + NaCl = CuCl2 + NaNo3
- AgNO3 + Ca(OH)2 = Ca(NO3)2 + Ag(OH)
- NiO + CO2 = NiO2 + CO
- NaNO3 + HNO3 = NaNO3 + HNO3
- CaCl2 + Na2Co3 = NaCl + CaCo3
Калькуляторы
Химическое уравнение
Взаимодействие нитрата серебра и хлорида натрия
- Программа решения химических уравнений
- Калькулятор стехиометрических реакций
- Калькулятор Лимитирующего реагента
- Ionic Equation Calculator
- окислительно-восстановительные реакции
Источник: www.chemicalaid.com
Задание с ответами: химия. ЕГЭ — 2018
Смешали растворы нитрата серебра и хлорида натрия, в результате чего выпал белый творожистый осадок. Этот осадок отделили, а полученный раствор выпарили. Образовавшееся вещество прокалили и продукт, образованный при прокаливании, добавили к раствору перманганата калия. Выпавший в осадок порошок темно-коричневого цвета прореагировал с соляной кислотой, при этом наблюдали выделение желто-зеленого газа.
Напишите уравнения четырёх описанных реакций.
Сведения для решения
1) Нитрат серебра вступил в обменную реакцию с хлоридом натрия, в результате чего выделился белый творожистый осадок — хлорид серебра:

2) Нитраты щелочных металлов при нагревании разлагаются с образованием нитритов и выделением кислорода:

3) Нитрит натрия за счет N +3 является восстановителем и под действием сильного окислителя — перманганата калия окисляется до N +5 , превращаясь в нитрат:

4) При обычных условиях диоксид марганца относительно инертное вещество. По при нагревании с кислотами проявляет окислительные свойства, например, способен окислить концентрированную соляную кислоту до хлора:

Источник: vuz-24.ru
Задание 1. Распознавание растворов хлорида натрия, карбоната натрия и сульфата натрия (практическая работа)
Определим, в какой из колб находятся растворы хлорида натрия NaCI, карбоната натрия Na2CO3 и сульфата натрия Na2SO4. Карбонат натрия можно обнаружить по карбонат-иону с помощью раствора соляной кислоты HCI. Карбонат натрия находится в той пробирке, где выделяется газ.
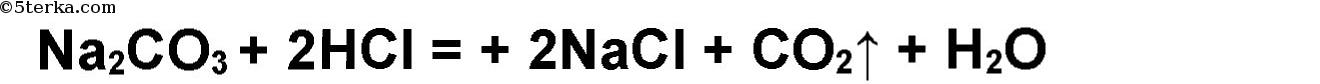
В какой из оставшихся двух пробирок хлорид натрия? Качественная реакция на хлорид-ион — реакция с нитратом серебра AgNO3. Белый осадок хлорида серебра выпадает в той пробирке, где находится хлорид натрия.
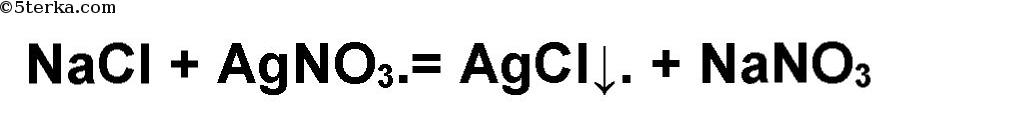
Аценат Натрия можно проверить с помощью FeCl3 (хлорида железа.) Раствор примет темно-красную окраску, за счёт появления ацетата железа(З).
Убедимся в том, что в оставшейся пробирке сульфат натрия. При добавлении хлорида бария выпадает белый осадок. Это сульфат бария.

Значит, в пробирке был действительно сульфат натрия.
Оборудование: колбы, пробирки, штатив для пробирок, пипетки.
Техника безопасности.
Соблюдать правила работы с кислотами и ядовитыми веществами — хлоридом бария и нитратом серебра. Остерегаться попадания на кожу и слизистые оболочки.
Источник:

Решебник по химии за 11 класс (О.С. Габриелян, 2007 год),
задача №1
к главе «Практическая работа №3 Распознание веществ.».
Источник: 5terka.com