Новые вопросы по химии
Что произойдёт с железом при взаимодействии с водой? 3 класс.
C8h18 формула глюкозы
1. Цинк растворили в концентрированной азотной кислоте. Полученный газ растворили в горячей воде. В ходе этого взаимодействия образовался бесцветный газ. Он легко окисляется кислородом воздуха до образования бурого газа.
Закончите формулы. H2+CuO= Na+HCl =
Что такое макроэлементы и ультромикроэлементы?
Главная » Химия » Сильный электролит — это А. Хлорид серебра Б. Хлорид алюминия В. Фосфат алюминия Г. Фосфат серебра
Источник: urokam.net
Уравнения диссоциации хлорида серебра 1
Хлорид серебра (AgCl), формула, диссоциация, свойства
хлорид серебра (AgCl химической формулы), представляет собой бинарную соль, образованную серебром и хлором. Серебро — блестящий, пластичный и ковкий металл с химическим символом Ag. Чтобы иметь возможность образовывать новые соединения, этот металл должен быть окислен (потеряв электрон своего последнего энергетического уровня), который превращает его в его ионные частицы, катион серебра, положительно заряженный.
Хлорид серебра, избежать потери. Как можно повторно использовать реагенты.
Хлор — газ зеленовато-желтого цвета, слегка раздражающий и с неприятным запахом. Его химический символ — Cl. Для образования химических соединений с металлами хлор восстанавливается (получает электрон, чтобы завершить восемь электронов на своем последнем энергетическом уровне) до его хлорид-аниона, заряженного отрицательно..

При обнаружении в ионной форме оба элемента могут образовывать соединение хлорида серебра либо естественным путем (как можно найти в некоторых месторождениях), либо химическим синтезом, который дешевле получить.
Хлорид серебра находится в нативном виде в виде хлоргидрита («хлор» для хлора, «аргыр» для аргента). Окончание «ите» указывает на название минерала.
Он имеет зеленовато-желтый вид (очень типичный для хлора) и сероватый по серебру. Эти тональности могут варьироваться в зависимости от других веществ, которые могут быть найдены в окружающей среде.
Полученный синтетически хлорид серебра выглядит как белые кристаллы, очень похожие на кубическую форму хлорида натрия, хотя в целом он будет выглядеть как белый порошок.
- 1 Как получить хлорид серебра?
- 2 Диссоциация
- 2.1 Низкая диссоциация в воде
- 4.1 Разложение под воздействием тепла или света
- 4.2 Осаждение серебра
- 4.3 Растворимость
- 5.1 Фотография
- 5.2 Гравиметрия
- 5.3 Анализ воды
- 5.4 Объемность
Как получить хлорид серебра?
В лаборатории его можно легко получить следующим способом:
Нитрат серебра вступает в реакцию с хлоридом натрия и образуется хлорид серебра, который выпадает в осадок, как показано стрелкой вниз, а нитрат натрия растворяется в воде.
диссоциация
Диссоциация в химии относится к возможности того, что ионное вещество может быть разделено на его компоненты или ионы, когда оно встречает вещество, которое позволяет такое разделение.
Это вещество известно как растворитель. Вода универсальный растворитель, который может диссоциировать большинство ионных соединений.
Хлорид серебра называют галоидной солью, потому что он образуется с элементом хлора, который соответствует семейству VIIA периодической таблицы, называемому галогенами. Галоидные соли — это ионные соединения, в основном плохо растворимые в воде.
Низкая диссоциация в воде
AgCl, который принадлежит к этому типу соединений, имеет очень низкую диссоциацию в воде. Такое поведение может быть вызвано следующими причинами:
— Когда образуется AgCl, именно в коллоидном состоянии, когда молекула диссоциирует на свои ионы серебра (+) и хлора (-), сразу же образуется исходная молекула хлорида серебра AgCl, устанавливающая динамическое равновесие между ними. (диссоциированный продукт и нейтральная молекула).
— Из-за молекулярной стабильности AgCl, когда образуется связь, его прочность имеет тенденцию быть более ковалентной, чем ионной, создавая устойчивость к диссоциации.
— Плотность серебра намного выше, чем у хлора, и именно серебро уменьшает диссоциацию и увеличивает осаждение AgCl в растворе.
Одним из факторов, влияющих на растворимость вещества, является температура. При нагревании вещества, растворенного в воде, растворимость увеличивается, и, следовательно, диссоциация его компонентов легче. Однако перед нагреванием AgCl подвергается разложению в газообразном Ag и Cl.
Физические свойства
Это те характеристики, которыми обладает вещество и которые позволяют идентифицировать его и отличать от других. Эти свойства не изменяют внутреннюю структуру вещества; то есть они не изменяют расположение атомов в формуле.
Хлорид серебра имеет твердый белый кристаллический цвет без запаха и в чистом виде имеет геометрию в форме октаэдра. Основные физические свойства описаны ниже:
— Температура плавления: 455 ° C
— Точка кипения: 1547 ° C
— Плотность: 5,56 г / мл
— Молярная масса: 143,32 г / моль.
Когда он обнаружен как хлораргирит (минерал), он имеет твердый вид и может быть бесцветным, зелено-желтым, зелено-серым или белым, в зависимости от места и веществ, которые находятся вокруг него. Твердость по шкале Мооса от 1,5 до 2,5..
Считается также блеском, адамантином (алмазом), смолой и шелковистостью. Это относится к несколько яркой внешности.
Химические свойства
Речь идет о реакционной способности химического вещества, когда он находится в контакте с другим. В этом случае его внутренняя структура не сохраняется, поэтому атомное расположение в формуле изменяется.
Разложение под воздействием тепла или света
Разлагает хлорид серебра на элементы.
Осаждение серебра
Осаждение серебра — лучший способ извлечь этот элемент из фотографических и рентгенографических пленок..
растворимость
Хлорид неба очень нерастворим в воде, но растворим в низкомолекулярных спиртах (метанол и этанол), в аммиаке и в концентрированной серной кислоте..
Использование и приложения
фотография
Хлорид серебра используется из-за его высокой чувствительности к свету. Этот процесс был открыт Уильямом Генри Фоксом Тэлботом в 1834 году..
гравиметрия
Гравиметрический анализ состоит в определении количества элемента, радикала или соединения, которое содержится в образце. Для этого необходимо удалить все вещества, которые могут создавать помехи, и преобразовать вещество, подлежащее исследованию, в вещество определенного состава, которое можно взвесить.
Это получается с помощью веществ, которые легко осаждаются в водной среде, как это происходит с AgCl.
Анализ воды
Этот процесс осуществляется посредством оценки, которая проводится с использованием AgNO3 в качестве титранта и индикатора, определяющего окончание реакции (изменение цвета); то есть, когда в воде больше нет хлоридов.
Эта реакция приводит к осаждению AgCl вследствие сродства хлорид-иона к катиону серебра.
волюметрия
Это оценка образца с неизвестной концентрацией (хлориды или бромиды). Чтобы найти концентрацию образца, он реагирует с веществом; конечная точка реакции распознается по образованию осадка. В случае хлоридов это будет хлорид серебра.
Cоставьте уравнение диссоциации хлорида серебра AgCl.
| Заказ №: 22179 |
| ⟾ Тип работы: Задача |
| Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| Цена: 153 руб. |
Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Cоставьте уравнение диссоциации хлорида серебра AgCl. Вычислите растворимость AgCl при 25 °С.
Решение: Уравнение диссоциации хлорида серебра AgCl Ag Cl Произведение концентраций ионов Ag и Cl в насыщенном водном растворе хлорида серебра – постоянная величина (произведение растворимости ПР). При 25 °С произведение растворимости хлорида серебра равно

Готовые задачи по химии которые сегодня купили:





















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
Полное ионное уравнение с образованием осадка хлорида серебра AgCl
Ионные уравнения – результат химического взаимодействия катионов и анионов. С их помощью расписывают реакции замещения и обмена.
Характеристика ионных реакций
Ионные уравнения обладают рядом особенных характеристик.
- Валентности ионов не меняются в ходе реакции.
- В ходе реакции должны образоваться плохорастворимый осадок, газ или слабый электролит.
Если исходные и образовавшиеся вещества – это растворимые соединения, то реакция обратима. Такие взаимодействия не идут до конца и, как правило, в химии используются редко. Обратимые реакции не расписывают как уравнения ионного обмена. Например, хлорид натрия NaCl и нитрат калия KNO3 – растворимые соединения, в результате взаимодействия которых образуются растворимые соединения.
- молекулярное уравнение
- полное уравнение
Na + +Cl — +K + +NO3 — ⇄Na + +NO3 — +K + +Cl —
- краткое уравнение
Чтобы расписать краткое уравнение, нужно вычеркнуть одинаковые ионы в обеих частях уравнения. Например, справа есть ион Na + и слева есть ион Na + , поэтому оба иона вычеркиваются. В данном случае вычеркиваются все ионы.
Если в результате реакции образуются газ, плохорастворимый осадок или слабый электролит, то реакция необратима.
- Газов в природе немного, поэтому химики их запоминают: H2, N2, O2, F2, Cl2, инертные газы (VIII группа в периодической таблице Д.И. Менделеева), все водородные соединения неметаллов, несколько оксидов углерода, азота, серы. В реакциях газы обозначаются стрелкой вверх ↑.
- Осадки – нерастворимые соединения, которые определяют с помощью таблицы растворимости. Осадки обозначаются стрелкой вниз ↓.
- Чтобы определить силу электролита, необходимо вычислить степень диссоциации по формуле:
Если степень диссоциации меньше 3 %, то такие электролиты называют слабыми. К слабым электролитам относится вода, слабые и органические кислоты, нерастворимые основания.
Для необратимых реакций расписывают ионные уравнения.
Необратимое ионное уравнение
На практике, как правило, проводят именно необратимые реакции.
Источник: all-equa.ru
Хлорид серебра это электролит или нет
Хлори́д серебра́(I) (хлористое серебро) — AgCl, неорганическое бинарное соединение серебра с хлором, серебряная соль хлороводородной (соляной) кислоты. В нормальных условиях представляет собой белый порошок или бесцветные кристаллы. Встречается в природе в виде минерала хлораргирита.
Молекулярная и кристаллическая структура


Хлорид серебра имеет следующий элементный состав: Ag (75,26 %), Cl (24,74 %). Атом серебра в молекуле находится в состоянии sp 3 d 2 -гибридизации. Энергия разрыва связи в соединении (Есв.): 313 кДж/моль, длина связи Ag—Cl: 0,228 нм [5] .
Кристаллы AgCl принадлежат к кубической сингонии, структура типа NaCl, пространственная группа Fm3m, параметры элементарной ячейки a = 0,5549 нм, Z = 4. Центральный атом образует с соседями октаэдр, координационное число равно 6 [6] .
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера [6] .
Физические свойства
Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро» [7] .
Хлорид серебра чрезвычайно мало растворим в воде: при 25 °C произведение растворимости (ПР) составляет 1,77·10 −10 . С повышением температуры растворимость соединения повышается: при 100 °C ПР=2,81·10 −8 [8] . Нерастворим в минеральных кислотах, этиловом и метиловом спирте, ацетоне. Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке [9] [4] .
Зависимость давления насыщенного пара (P, в барах) для соединения в диапазоне температур (T) от 1185 до 1837 K выражается следующим уравнением [11] :

Получение
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы):

Химические свойства
- Разлагается при комнатной температуре под действием света:

- Образует с гидратом аммиака, тиосульфатами и цианидами щелочных металлов растворимые комплексные соединения:



- Вступает в окислительно-восстановительные реакции, восстанавливаясь до металлического серебра [12] :
 324 ^oC> 2BaCl_2+4Ag+O_2>» border=»0″/>
324 ^oC> 2BaCl_2+4Ag+O_2>» border=»0″/>
 Окислительные свойства хлорида серебра используется для извлечения металла из серебросодержащих отходов [13] :[стр. 233] : :
Окислительные свойства хлорида серебра используется для извлечения металла из серебросодержащих отходов [13] :[стр. 233] : : 

- Растворяется в концентрированных растворах хлоридов и соляной кислоты, образуя комплексы:

- Медленно реагирует с концентрированной серной кислотой при кипячении [14] :

- В растворах жидкого аммиака из-за растворимости в нём соли можно провести обменные реакции, недоступные в водных растворах [15] :

Применение
- Светочувствительный компонентфотографических эмульсий различных фотографических материалов;
- Компонент электродов химических источников тока на основе систем Ag/AgCl/Cl − ;
- Компонент электропроводящих стёкол;
- Материал для линз в ИК-спектроскопии [16] ;
- Промежуточный продукт, образующийся при извлечении серебра из сульфидной руды [13] :[стр. 167] :

- Реагент для получения сереброорганических соединений:

- Входит в состав антимикробных композиций на основе ионов серебра.
Безопасность
Соединение может вызвать раздражающий эффект при контакте с кожей и слизистыми оболочками.
Свойства, особенности и применение хлорида серебра
В таблице Менделеева нет такого элемента, как AgCl, или хлорид серебра. Он образуется при соединении хлора одновалентного (Cl) с серебром (Ag) такой же валентности.
Образующий соединение хлор (Cl) является галогеном и выступает активным окисляющим веществом, встретить его в природе отдельно большая редкость. Ag является благородным металлом, чистое серебро химически инертно и потому практически не участвует в каких-либо реакциях. Может существовать в форме слитков, самородков, серебряных жил и россыпей.
Серебро в несколько раз более активно, нежели хлор, и для того чтобы образовался хлорид серебра, следует провести операцию, где серебросодержащая соль будет взаимодействовать с хлоридами. К примеру, взаимодействующими элементами могут быть нитрат серебра и хлорид натрия.

Взаимодействие этих веществ осуществляется в ходе реакции замещения, итогом которой является образование белого осадка. Полученное соединение не отличается стойкостью. Попадая под солнечные лучи, осадок темнеет, выделяются молекулы серебра, вступающие в реакцию с молекулами серы в атмосфере. Именно по этой причине темнеют все серебряные изделия.
Особенности
Хлорид серебра имеет кристаллическую структуру. Форма кристаллов кубическая. Расположенный в центре атом соединяется с другими атомами и образует октаэдр. AgCl имеет следующие химические особенности:
- его молярная масса составляет всего 143,32 г/моль;
- плотность соединения — 5,56 г/см3;
- кипит при температуре от 455 градусов;
- плавится при температуре от 1547 градусов;
- при кипении и плавлении не разлагается;
- является неорганическим бинарным соединением хлора и серебра; известен как серебряная соль хлороводородной кислоты.

Работа с хлоридом серебра
Физические свойства хлористого серебра таковы:
- цвет соединения белый, элемент и вовсе может не иметь цвета;
- соединение представлено в виде кристаллов;
- природный аналог химического соединения — минерал, известный как хлораргирит;
- плохо растворяется в воде, если температура ее равняется либо не достигает 25 градусов;
- неплохо взаимодействует с растворами аммиака, роданида, пиридина, цианидов, тиосульфатов щелочных металлов, растворяясь в них;
- никак не реагирует на метиловый и этиловый спирты, ацетон.
Хлорид серебра — твердое вещество. По шкале твердости соединение оценивается в 2,5 балла. После плавки образуется практически прозрачная масса желто-коричневого цвета, известная как «роговое серебро».

Полученное серебро из хлорида серебра
Применение
AgCl обладает повышенной чувствительностью к свету. Это его свойство используется при изготовлении фотографических эмульсий. Соединение применяется в процессе производства хлор-серебряно-цинковых батарей, а также как покрытие для радаров.
Хлорид серебра входит в состав веществ, из которых изготавливают электропроводящие стекла и линзы для спектрометров. При производстве электродов химических источников тока также используют AgCl. Пытаясь получить рассматриваемое соединение в домашних условиях, действовать следует осторожно. Попав на кожу, вещество может вызвать раздражение.
Хлорид серебра I

 |
Хлорид серебра I (хлористое серебро) — AgCl, неорганическое бинарное соединение серебра с хлором, серебряная соль хлороводородной (соляной) кислоты. В нормальных условиях представляет собой белый порошок или бесцветные кристаллы. Встречается в природе в виде минерала хлораргирита.
Молекулярная и кристаллическая структура
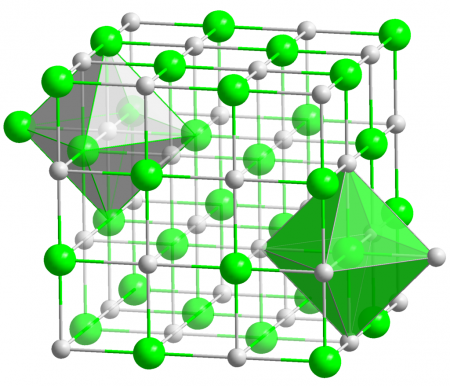
Хлорид серебра имеет следующий элементный состав: Ag (75,26 %), Cl (24,74 %). Атом серебра в молекуле находится в состоянии sp 3 d 2 -гибридизации. Энергия разрыва связи в соединении (Есв.): 313 кДж/моль, длина связи Ag—Cl: 0,228 нм.
Кристаллы AgCl принадлежат к кубической сингонии, структура типа NaCl, пространственная группа Fm3m, параметры элементарной ячейки a = 0,5549 нм, Z = 4. Центральный атом образует с соседями октаэдр, координационное число равно 6.
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера.
Физические свойства
Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро».
Хлорид серебра чрезвычайно мало растворим в воде: при 25 °C произведение растворимости (ПР) составляет 1,77⋅10 −10 . С повышением температуры растворимость соединения повышается: при 100 °C ПР = 2,81⋅10 −8 . Нерастворим в минеральных кислотах, этиловом и метиловом спирте, ацетоне. Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке. Из-за образования комплексных соединений хлорид серебра заметно растворим в концентрированной соляной кислоте и растворах хлоридов.
- стандартная энтальпия образования, ΔH°298: −127 кДж/моль;
- стандартная энтропия, S°298: 96 Дж/(моль·K);
- стандартная энергия Гиббса, ΔG°298: −110 кДж/моль.
- стандартная мольная теплоемкость, Cp°298: 50,79 Дж/(моль·K);
- энтальпия плавления, ΔHпл: 13,2 кДж/моль;
- энтальпия кипения, ΔHкип: 184 кДж/моль.
Зависимость давления насыщенного пара (P, в барах) для соединения в диапазоне температур (T) от 1185 до 1837 K выражается следующим уравнением:
log10 P = 4,95155 − 8775,980/T−62,718
Получение
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы):

Химические свойства
- Разлагается при комнатной температуре под действием света:
2 AgCl = 2 Ag + Cl2
- Образует с гидратом аммиака, тиосульфатами и цианидами щелочных металлов растворимые комплексные соединения:
- Вступает в окислительно-восстановительные реакции, восстанавливаясь до металлического серебра:
4 AgCl + 2 BaO → >324oC 2 BaCl2 + 4 Ag + O2 2 AgCl + Zn = ZnCl2 + 2 Ag ↓ 2 AgCl + 2 KOH + H2O2 = 2 KCl + 2 Ag ↓ + O2 ↑ + 2 H2O Окислительные свойства хлорида серебра используется для извлечения металла из серебросодержащих отходов: 4 AgCl + 2 Na2CO3 → 850−900oC 4 NaCl + 4 Ag + 2 CO2 + O2 4 AgCl + CH2O + 6 NaOH = 4 Ag ↓ + Na2CO3 + 4 NaCl + 4 H2O
- Растворяется в концентрированных растворах хлоридов и соляной кислоты, образуя комплексы:
- Медленно реагирует с концентрированной серной кислотой при кипячении:
- В растворах жидкого аммиака из-за растворимости в нём соли можно провести обменные реакции, недоступные в водных растворах:
Применение
- Светочувствительный компонент фотографических эмульсий различных фотографических материалов;
- Компонент электродов химических источников тока на основе систем Ag/AgCl/Cl − ;
- Компонент электропроводящих стёкол;
- Материал для линз в ИК-спектроскопии;
- Промежуточный продукт, образующийся при извлечении серебра из сульфидной руды:
- Реагент для получения сереброорганических соединений:
AgCl + R−MgBr = R−Ag + MgBrCl
- Входит в состав антимикробных композиций на основе ионов серебра.
Безопасность
Соединение может вызвать раздражающий эффект при контакте с кожей и слизистыми оболочками.
Источник: ollimpia.ru