Существуют две основные причины прохождения электрического тока через проводники: либо за счет переноса электронов, либо за счет переноса ионов. Электронная проводимость присуща, прежде всего, металлам. Ионная проводимость присуща многим химическим соединениям, обладающим ионным строением, например, солям в твердом или расплавленном состояниях, а также многим водным и неводным растворам.
Все вещества по их поведению в растворах принято делить на две категории:
а) вещества, растворы которых обладают ионной проводимостью (электролиты);
б) вещества, растворы которых не обладают ионной проводимостью (неэлектролиты).
К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например, спирты и углеводы.
Оказалось, что растворы электролитов обладают более низкими значениями температуры плавления и более высокими температурами кипения по сравнению с соответствующими значениями для чистого растворителя или для раствора неэлектролита в этом же растворителе. Для объяснения этих фактов Аррениус предложил теорию электролитической диссоциации.
Что такое электролиты? Электролиты в организме человека ► Симптомы дефицита калия
Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов – катионов и анионов. Например, молекула уксусной кислоты так диссоциирует в водном растворе:
СН3СООН СН3СОО – + Н +
Процесс диссоциации во всех случаях является обратимым, поэтому при написании уравнений реакции диссоциации применяется знак обратимости . Различные электролиты диссоциируют на ионы в различной степени. Полнота распада зависит от природы электролита, его концентрации, природы растворителя, температуры.
Сильные и слабые электролиты. Степень диссоциации. Константа диссоциации. Степенью диссоциации α называют – отношение числа молекул, распавшихся на ионы (n) к общему числу растворенных молекул (n0).
α = (n/n0)? 100
Степень диссоциации может изменяться от 0 до 1, от отсутствия диссоциации до полной диссоциации. В зависимости от величины степени диссоциации различают слабые и сильные электролиты. К слабым электролитам относят вещества, у которых степень диссоциации в 0,1 М растворах меньше 3%; если степень диссоциации в 0,1 М растворе превышает 30%, то такой электролит называют сильным. Электролиты, степень диссоциации которых лежит в пределах от 3% до 30%, называются электролитами средней силы.
К сильным электролитам относятся большинство солей, некоторые кислоты – НСl, НВr, НI, НNО3, НСlO4, Н2SO4 и основания щелочных и щелочноземельных металлов – щелочи LiОН, NаОН, КОН, RbОН, СsОН, Са(ОН)2, Sr(ОН)2, Ва(ОН)2.
Уравнение реакции диссоциации электролита АК на катионы К + и анионы А – можно в общем виде представить следующим образом:
Состав электролита для золочения, который от Вас скрывают на YouTube! Рецепт раствора БЕСПЛАТНО!
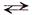
КА К + + А –
и степень диссоциации α в данном случае можно выразить отношением молярной концентрации образовавшихся ионов [К + ] или [А – ] к первоначальной молярной концентрации электролита [АК]о, т.е.
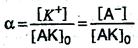
С увеличением концентрации раствора степень диссоциации электролита уменьшается.
Многоосновные кислоты и основания диссоциируют ступенчато – вначале от молекулы отщепляется один из ионов, затем другой и т.д. Каждая ступень диссоциации характеризуется своим значением константы диссоциации.
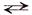
II ступень: НSO4 – Н + + SO4 2–
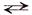
Общее уравнение: Н2SO4 2Н + + SO4 2–
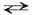
Процесс электролитической диссоциации характеризуют константой диссоциации (К). Так, для реакции КА К + + А – константа диссоциации:
К = [К + ]? [ А – ]/[КА]
Между константой и степенью электролитической диссоциации существует количественная связь. В приведенном примере общую концентрацию растворенного вещества обозначим с, а степень диссоциации α. Тогда [К + ] = [А – ] = α?с и соответственно концентрация недиссоциированных частиц [КА] = (1 – α) с.
Подставив значения в выражение для константы диссоциации, получим соотношение
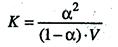 , поскольку молярная концентрация равна C = 1/V, то
, поскольку молярная концентрация равна C = 1/V, то 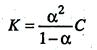
Данные уравнения является математическим выражением закона разведения Оствальда: константа диссоциации электролита не зависит от разведения раствора.
Ионное произведение воды. рН раствора. Значение константы диссоциации воды КН2О = 1·10 –14 . Данную константу для воды называют ионным произведением воды, которое зависит только от температуры.
Согласно реакции Н2О Н + + ОН – , при диссоциации воды на каждый ион Н + образуется один ион ОН – , следовательно, в чистой воде концентрации этих ионов одинаковы: [Н + ] = [ОН – ] = 10 –7 .
рН = –lg[Н + ]
Водные растворы имеют значение рН в интервале от 1 до 14. По соотношению концентраций этих ионов различают три типа сред: нейтральную, кислую и щелочную.
Нейтральная среда – среда, в которой концентрации ионов [Н + ] = [ОН – ] = 10 –7 моль/л (рН = 7).
Кислая среда – среда, в которой концентрация ионов [Н + ] больше концентрации ионов [ОН – ], т.е. [Н + ] > 10 –7 моль/л (рН < 7).
Щелочная среда – среда, в которой концентрация ионов [Н + ] меньше концентрации ионов [ОН – ], т.е. [Н + ] < 10 –7 моль/л (рН >7).
Качественно реакцию среды и рН водных растворов электролитов определяют при помощи индикаторов и рН-метра.
Например, если концентрация ионов [H + ] = 10 –4 моль/л, то рН = – lg10 –4 = 4 и среда раствора кислая, а если концентрация ионов [ОН – ] = 10 –4 моль/л, то [Н + ] = К (Н2O) – [ОН – ] = 10 –14 – 10 –4 = 10 –10 , а рН = – lg10 –10 = 10 и среда раствора щелочная.
Произведение растворимости. Растворение твердого вещества в воде прекращается тогда, когда образуется насыщенный раствор, т.е. устанавливается равновесие между твердым веществом и частицами того же вещества, находящимися в растворе. Так, например, в насыщенном растворе хлорида серебра устанавливается равновесие:
AgClтв Ag + водн + Сl – водн
В насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре и эта величина количественно характеризует способность электролита растворяться, называется она произведением растворимости (ПР).
Произведение растворимости – это постоянная величина, равная произведению концентраций ионов малорастворимого электролита в его насыщенном растворе. В общем случае для малорастворимого электролита состава AmBn можно записать: AmBn ↔ mA + nB
ПРAmBn = [A] m ? [B] n
Зная величины произведений растворимости, можно решать вопросы, связанные с образованием или растворением осадков при химических реакциях, что особенно важно для аналитической химии.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Электролиты
Электролиты — в химии это вещества, растворы или расплавы, которые при растворении проводят электрический ток и выделяют ионы.
Эти растворы проводят электричество из-за подвижности:
- положительно заряженных ионов (называются катионами)
- и отрицательно заряженных ионов (называются анионами).
В питании это минералы, которые содержатся в крови, поте и моче. Когда минералы растворяются в жидкости, они образуют электролиты, т.е. положительные или отрицательные ионы, которые используются в метаболических процессах организма.
Метаболизм — процесс поддержания жизни организма, при котором калории от потребляемой пищи превращаются в энергию
Сильные и слабые электролиты
Сильные электролиты быстро и полностью ионизируются при растворении, и в растворе не образуются нейтральные молекулы. Примеры сильных электролитов:
- NaCl (хлорид натрия),
- HNO3 (азотная кислота),
- HClO3 (хлорноватая кислота),
- CaCl2 (хлорид кальция) и др.
У слабых электролитов при растворении в воде ионизируются лишь небольшие фракции молекул, т.е. в их растворах присутствует некое количество нейтральных молекул. Примеры слабых электролитов:
- большинство органических кислот и оснований,
- NH4OH (аммиак),
- H2CO3 (угольная кислота),
- CH3COOH (уксусная кислота), и др.
Как определить сильный и слабый электролит?
Сильные электролиты полностью ионизируются, т.к. основными компонентами раствора сильных электролитов являются ионы, и степень диссоциации такого электролита стремится к 1 (т.е. степень диссоциации α ≈ 1). Слабые электролиты ионизируются только частично, т.е. степень диссоциации такого электролита стремится к 0 (или α < 1).
В таблице растворимости можно посмотреть степень диссоциации электролита.
- растворимые соли,
- многие неорганические кислоты,
- основания щелочных и щелочноземельных металлов.
- почти все органические кислоты и вода,
- некоторые неорганические кислоты,
- нерастворимые гидроксиды металлов.
Электролиты и неэлектролиты
Все электролиты при растворении в воде дают ионы и проводят электрический ток. К электролитам относятся:
- кислоты,
- основания,
- соли (почти все).
Неэлектролиты — это вещества, растворы или расплавы которых не проводят электрический ток. К неэлектролитам относятся:
- многие органические вещества (сахара, спирты, углеводы, углеводороды, бензол, альдегиды, простые и сложные эфиры, и пр.)
- вещества, в молекулах которых существуют ковалентные неполярные или малополярные связи.
Электролиты в организме
Электролиты — это минералы, которые несут электрический заряд при растворении в воде. В питании этот термин относится к минералам, которые содержатся в крови, поте и моче.
Эти минералы, растворяясь в жидкости, образуют электролиты, т.е. положительные или отрицательные ионы, которые используются в метаболических процессах.
В организме человека электролиты играют роль в:
- проведении нервных импульсов,
- сокращении мышц,
- поддержании количества жидкости (гидратации),
- поддержании кислотно-щелочного баланса.
Электролиты в организме человека включают:
- Натрий,
- Калий,
- Хлориды,
- Кальций,
- Магний,
- Хлор,
- Фосфаты,
- Гидрокарбонаты.
Узнайте также про Электролиз.
Дата обновления 09/04/2021.
Источник: www.uznaychtotakoe.ru
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)

Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:

Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:

Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.

Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.

Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.

Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:

- Слабые электролиты (в их числе вода)
- Осадки
- Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Источник: studarium.ru