Хлор представляет собой ядовитый жёлто-зелёный газ с неприятным запахом. Он в (2,5) раза тяжелее воздуха.
Хлор слабо растворяется в воде. При комнатной температуре в (1) объёме воды растворяется (2,5) объёма хлора. Образовавшийся раствор называется хлорной водой.
В химических реакциях хлор является окислителем .
Промышленный способ получения хлора — электролиз расплава или раствора хлорида натрия:
2NaCl = 2Na + Cl 2 ↑ ,
2NaCl + 2H 2 O = 2NaOH + Cl 2 ↑ + H 2 ↑ .
В лаборатории его получают реакцией соляной кислоты с оксидом марганца((IV)):
4HCl + Mn O 2 = Mn Cl 2 + Cl 2 ↑ + 2H 2 O .
Хлороводород
Хлороводород образуется при взаимодействии хлора с водородом:
H 2 + Cl 2 = t 2HCl .
Его можно также получить при действии концентрированной серной кислоты на твёрдые хлориды:
H 2 S O 4 ( к ) + 2NaCl = t 2HCl ↑ + Na 2 S O 4 .
Химическая связь в молекуле хлороводорода — ковалентная полярная: H δ + → Cl δ − . Он представляет собой бесцветный газ с резким запахом, тяжелее воздуха. Хлороводород очень хорошо растворяется в воде: в (1) объёме воды растворяется до (500) объёмов хлороводорода.
Соляная кислота
Соляная кислота:
- изменяет окраску индикаторов;
- взаимодействует с металлами, расположенными в ряду активности до водорода:
Fe + 2HCl = H 2 + Fe Cl 2 ;
- взаимодействует с основными и амфотерными оксидами:
ZnO + 2HCl = H 2 O + Zn Cl 2 ;
- взаимодействует с основаниями и амфотерными гидроксидами:
KOH + HCl = H 2 O + KCl ;
- взаимодействует с солями, если продуктом реакции являются газ, осадок или слабый электролит (с карбонатами, силикатами, сульфидами, растворимыми солями серебра и т. д.):
CaC O 3 + 2HCl = Ca Cl 2 + H 2 O + C O 2 ↑ ,
Na 2 S + 2HCl = 2NaCl + H 2 S ↑ ,
AgN O 3 + HCl = HNO 3 + AgCl ↓ .
Большинство солей соляной кислоты хорошо растворяется в воде. К нерастворимым относится хлорид серебра . Он выпадает в виде белого творожистого осадка при взаимодействии раствора нитрата серебра с соляной кислотой или с растворами хлоридов. Эту реакцию используют как качественную реакцию на ионы хлора. Сокращённое ионное уравнение:
Источник: www.yaklass.ru
HCl + AgCl = ? уравнение реакции
Составьте химическое уравнение по схеме HCl + AgCl = ? Запишите уравнение в ионном виде, если это возможно. Дайте краткую характеристику физических и химических свойства хлорида серебра, приведите способы его получения.
Xumuk Админ. ответил 6 лет назад
Хлорид серебра образуется в виде белого творожистого нерастворимого в воде и кислотах осадка (значит в реакцию взаимодействия с хлороводородом [HCl + AgCl = ?] не вступает) при взаимодействии ионов серебра с хлорид-ионами. На свету хлорид серебра постепенно темнеет, разлагаясь с выделением металлического серебра:
![]()
Хлорид серебра вступает в реакции взаимодействия с концентрированными растворами щелочей, гидратом аммиака.
![]()
![]()
Переводится в раствор за счет комплексообразования.
![]()
![]()
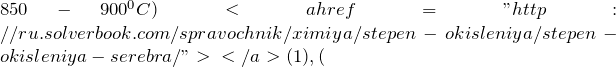
При сплавлении с карбонатом натрия (серебро (1), равно как и в реакции с оксидом бария (» width=»616″ height=»67″ />> 324^C$) (2):
Источник: ru.solverbook.com
Хлорид серебра это кислота
72. Соли соляной кислоты
Соли соляной кислоты или хлориды – соединения хлора со всеми элементами, имеющими меньшее значение электроотрицательности.
Хлориды металлов – твердые вещества. В основном хорошо растворимы в воде, но AgCl, CuCl, HgCl2, TlCl и PbCl2 – малорастворимы. Хлориды щелочных и щелочноземельных металлов имеют нейтральную реакцию. Увеличение числа атомов хлора в молекулах хлоридов приводит к уменьшению полярности химической связи и термической стойкости хлоридов, увеличению их летучести и склонности к гидролизу. Растворы хлоридов других металлов имеют кислую реакцию вследствие гидролиза:
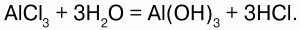
Хлориды неметаллов – вещества, которые могут быть в любом агрегатном состоянии: газообразные (HCl), жидкие (PCl3) и твердые (PCl5). Также вступают в реакцию гидролиза:
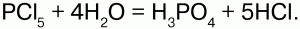
Некоторые хлориды неметаллов являются комплексными соединениями, например, РС15 состоит из ионов [РСl4]+ и [РСl6]-. Хлориды брома и йода относят к межгалогенным соединениям. Для ряда хлоридов характерна ассоциация и полимеризация в жидкой и газовой фазах с образованием хлоридных мостиков между атомами.
Получение. Получают реакцией металлов с хлором или взаимодействиями соляной кислоты с металлами, их оксидами и гидроксидами, также путем обмена с некоторыми солями:
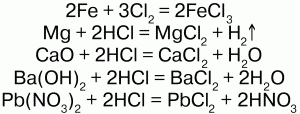
Определяют ион хлора качественно и количественно при помощи нитрата серебра. В результате этого образуется белый осадок в виде хлопьев.
Хлориды используют в производстве и в органическом синтезе. В основе образования летучих хлоридов лежит обогащение и разделение многих цветных и редких металлов. Хлорид натрия – для получения гидроксида натрия, соляной кислоты, карбоната натрия, хлора. Используется также в пищевой промышленности и мыловарении. Хлорид калия – в качестве калийного удобрения.
Хлорид бария – средство для борьбы с насекомыми-вредителями. Хлорид цинка – для пропитки древесины, как предохраняющее средство от гниения, при паянии металла. Хлорид кальция безводный используется для сушки веществ (газов), в медицинской практике, а его кристаллогидрат – в качестве охлаждающего вещества.
Хлорид серебра используется для изготовления фотографий. Хлорид ртути – ядовитое соединение, п рименятся как протравливатель семян, дубления кожи, окрашивания ткани. Действует как катализатор при органическом синтезе. Как дезинфицирующее вещество. Хлорид аммония используется в красильном производстве, гальванике, при паянии и лужении.
- Альтернативная медицина
- Астрономия и Космос
- Биология
- Военная история
- Геология и география
- Государство и право
- Деловая литература
- Домашние животные
- Домоводство
- Здоровье
- История
- Компьютеры и Интернет
- Кулинария
- Культурология
- Литературоведение
- Математика
- Медицина
- Науч. литер. — прочее
- Педагогика
- Политика
- Психология
- Религиоведение
- Сад и огород
- Самосовершенствование
- Сделай сам
- Спорт
- Технические науки
- Транспорт и авиация
- Учебники
- Физика
- Философия
- Химия
- Хобби и ремесла
- Шпаргалки
- Эзотерика
- Юриспруденция
- Языкознание
Источник: www.redov.ru