
Хлорид серебра, характеристика, свойства и получение, химические реакции.
Поделиться в:




Хлорид серебра – неорганическое вещество, имеет химическую формулу AgCl.
Краткая характеристика хлорида серебра:
Хлорид серебра – неорганическое вещество белого цвета. При плавлении становится оранжево-желтым. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро».
Два способа восстановления серебра 99 и 999 Сравнение
Химическая формула хлорида серебра AgCl.
Хлорид серебра – неорганическое химическое соединение, соль хлороводородной (соляной) кислоты и серебра, бинарное соединение серебра и хлора.
Практически не растворяется в воде, ацетоне, этаноле, метаноле.
Кристаллогидратов не образует.
В расплавленном виде хорошо пристает к стеклу , кварцу и металлам .
Хлорид серебра встречается в природе в виде минерала хлораргирита.
Физические свойства хлорида серебра:
| Наименование параметра: | Значение: |
| Химическая формула | AgCl |
| Синонимы и названия иностранном языке | silver chloride (англ.) |
серебро хлористое (рус.)
Получение хлорида серебра:
Хлорид серебра получают в результате следующих химических реакций:
- 1. взаимодействия нитрата серебра и хлорида калия:
В ходе реакции используется разбавленный раствор хлорида калия.
- 2. взаимодействия нитрата серебра и хлорида натрия:
В ходе реакции используется разбавленный раствор хлорида натрия.
- 3. взаимодействия нитрата серебра и хлорида кальция:
- 5. взаимодействия серебра и хлора:
2Ag + Cl2 → 2AgCl (t = 150-200 °C).
Химические свойства хлорида серебра. Химические реакции хлорида серебра:
Химические свойства хлорида серебра аналогичны свойствам хлоридов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия хлорида серебра и фтора:
В результате реакции образуются фторид серебра (II) и хлор.
2. реакция взаимодействия хлорида серебра и цинка :
2AgCl + Zn = ZnCl2 + 2Ag.
В результате реакции образуются хлорид цинка и серебро.
3. реакция взаимодействия хлорида серебра и оксида бария :
АФФИНАЖ СЕРЕБРА НОВЫМ МЕТОДОМ! Минуя ХЛОРИД СЕРЕБРА.. АЛЮМИНИЙ, МЕДЬ и ПРОЧЕЕ..!
4AgCl + 2BaO → 2BaCl2 + 4Ag + O2 (t > 324°C).
В результате реакции образуются хлорид бария, серебро и кислород.
4. реакция взаимодействия хлорида серебра и гидроксида калия:
4AgCl + 4KOH → 4KCl + 4Ag + O2 + 2H2O (t > 450 °C).
В результате реакции образуются хлорид калия, серебро , кислород и вода .
5. реакция взаимодействия хлорида серебра и сульфида натрия:
В результате реакции образуются сульфид серебра (II) и хлорид натрия.
6. реакция взаимодействия хлорида серебра и йодида натрия:
AgCl + NaI ⇄ AgI + NaCl.
В результате реакции образуются йодид серебра и хлорид натрия. Реакция носит обратимый характер.
7. реакция взаимодействия хлорида серебра и карбоната натрия :
4AgCl + 2Na2CO3 → 4Ag + 4NaCl + 2CO2 + O2 (t = 850-900 °C).
В результате реакции образуются серебро , хлорид натрия, оксид углерода (IV) и кислород.
8. реакция взаимодействия хлорида серебра и нитрата бария:
В результате реакции образуются хлорид бария и нитрат серебра. Реакция протекает в растворе жидкого аммиака .
9. реакция взаимодействия хлорида серебра, пероксида водорода и гидроксида калия :
В результате реакции образуются хлорид калия, серебро , кислород и вода .
10. реакция разложения хлорида серебра:
В результате реакции образуются серебро и хлор . Реакция протекает при комнатной температуре под действием светового излучения.
Применение и использование хлорида серебра:
Хлорид серебра используется во множестве отраслей промышленности и для бытовых нужд:
– как светочувствительный компонент фотографических эмульсий различных фотографических материалов ;
– входит в состав антимикробных композиций на основе ионов серебра;
– в химической промышленности как реагент для получения сереброорганических соединений;
– как компонент электродов химических источников тока, электропроводящих стёкол;
– как материал для линз в ИК-спектроскопии.
хлорид серебра реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие хлорида серебра
реакции
Коэффициент востребованности 4 323
- ← Октан, свойства, химические реакции
- Погода в Екатеринбурге на сегодня, текущая погода, прогноз на 5 дней →
Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (107 922)
- Экономика Второй индустриализации России (105 120)
- Этилен (этен), получение, свойства, химические реакции (41 557)
- Крахмал, свойства, получение и применение (36 263)
- Целлюлоза, свойства, получение и применение (34 467)
- Природный газ, свойства, химический состав, добыча и применение (33 279)
- Программа искусственного интеллекта ЭЛИС (32 507)
- Прямоугольный треугольник, свойства, признаки и формулы (32 090)
- Метан, получение, свойства, химические реакции (31 821)
- Плазма, свойства, виды, получение и применение (30 570)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Хлорид серебра (AgCl), формула, диссоциация, свойства
хлорид серебра (AgCl химической формулы), представляет собой бинарную соль, образованную серебром и хлором. Серебро — блестящий, пластичный и ковкий металл с химическим символом Ag. Чтобы иметь возможность образовывать новые соединения, этот металл должен быть окислен (потеряв электрон своего последнего энергетического уровня), который превращает его в его ионные частицы, катион серебра, положительно заряженный.
Хлор — газ зеленовато-желтого цвета, слегка раздражающий и с неприятным запахом. Его химический символ — Cl. Для образования химических соединений с металлами хлор восстанавливается (получает электрон, чтобы завершить восемь электронов на своем последнем энергетическом уровне) до его хлорид-аниона, заряженного отрицательно..

При обнаружении в ионной форме оба элемента могут образовывать соединение хлорида серебра либо естественным путем (как можно найти в некоторых месторождениях), либо химическим синтезом, который дешевле получить.
Хлорид серебра находится в нативном виде в виде хлоргидрита («хлор» для хлора, «аргыр» для аргента). Окончание «ите» указывает на название минерала.
Он имеет зеленовато-желтый вид (очень типичный для хлора) и сероватый по серебру. Эти тональности могут варьироваться в зависимости от других веществ, которые могут быть найдены в окружающей среде.
Полученный синтетически хлорид серебра выглядит как белые кристаллы, очень похожие на кубическую форму хлорида натрия, хотя в целом он будет выглядеть как белый порошок.
- 1 Как получить хлорид серебра?
- 2 Диссоциация
- 2.1 Низкая диссоциация в воде
- 4.1 Разложение под воздействием тепла или света
- 4.2 Осаждение серебра
- 4.3 Растворимость
- 5.1 Фотография
- 5.2 Гравиметрия
- 5.3 Анализ воды
- 5.4 Объемность
Как получить хлорид серебра?
В лаборатории его можно легко получить следующим способом:
Нитрат серебра вступает в реакцию с хлоридом натрия и образуется хлорид серебра, который выпадает в осадок, как показано стрелкой вниз, а нитрат натрия растворяется в воде.
диссоциация
Диссоциация в химии относится к возможности того, что ионное вещество может быть разделено на его компоненты или ионы, когда оно встречает вещество, которое позволяет такое разделение.
Это вещество известно как растворитель. Вода универсальный растворитель, который может диссоциировать большинство ионных соединений.
Хлорид серебра называют галоидной солью, потому что он образуется с элементом хлора, который соответствует семейству VIIA периодической таблицы, называемому галогенами. Галоидные соли — это ионные соединения, в основном плохо растворимые в воде.
Низкая диссоциация в воде
AgCl, который принадлежит к этому типу соединений, имеет очень низкую диссоциацию в воде. Такое поведение может быть вызвано следующими причинами:
— Когда образуется AgCl, именно в коллоидном состоянии, когда молекула диссоциирует на свои ионы серебра (+) и хлора (-), сразу же образуется исходная молекула хлорида серебра AgCl, устанавливающая динамическое равновесие между ними. (диссоциированный продукт и нейтральная молекула).
— Из-за молекулярной стабильности AgCl, когда образуется связь, его прочность имеет тенденцию быть более ковалентной, чем ионной, создавая устойчивость к диссоциации.
— Плотность серебра намного выше, чем у хлора, и именно серебро уменьшает диссоциацию и увеличивает осаждение AgCl в растворе.
Одним из факторов, влияющих на растворимость вещества, является температура. При нагревании вещества, растворенного в воде, растворимость увеличивается, и, следовательно, диссоциация его компонентов легче. Однако перед нагреванием AgCl подвергается разложению в газообразном Ag и Cl.
Физические свойства
Это те характеристики, которыми обладает вещество и которые позволяют идентифицировать его и отличать от других. Эти свойства не изменяют внутреннюю структуру вещества; то есть они не изменяют расположение атомов в формуле.
Хлорид серебра имеет твердый белый кристаллический цвет без запаха и в чистом виде имеет геометрию в форме октаэдра. Основные физические свойства описаны ниже:
— Температура плавления: 455 ° C
— Точка кипения: 1547 ° C
— Плотность: 5,56 г / мл
— Молярная масса: 143,32 г / моль.
Когда он обнаружен как хлораргирит (минерал), он имеет твердый вид и может быть бесцветным, зелено-желтым, зелено-серым или белым, в зависимости от места и веществ, которые находятся вокруг него. Твердость по шкале Мооса от 1,5 до 2,5..
Считается также блеском, адамантином (алмазом), смолой и шелковистостью. Это относится к несколько яркой внешности.
Химические свойства
Речь идет о реакционной способности химического вещества, когда он находится в контакте с другим. В этом случае его внутренняя структура не сохраняется, поэтому атомное расположение в формуле изменяется.
Разложение под воздействием тепла или света
Разлагает хлорид серебра на элементы.
Осаждение серебра
Осаждение серебра — лучший способ извлечь этот элемент из фотографических и рентгенографических пленок..
растворимость
Хлорид неба очень нерастворим в воде, но растворим в низкомолекулярных спиртах (метанол и этанол), в аммиаке и в концентрированной серной кислоте..
Использование и приложения
фотография
Хлорид серебра используется из-за его высокой чувствительности к свету. Этот процесс был открыт Уильямом Генри Фоксом Тэлботом в 1834 году..
гравиметрия
Гравиметрический анализ состоит в определении количества элемента, радикала или соединения, которое содержится в образце. Для этого необходимо удалить все вещества, которые могут создавать помехи, и преобразовать вещество, подлежащее исследованию, в вещество определенного состава, которое можно взвесить.
Это получается с помощью веществ, которые легко осаждаются в водной среде, как это происходит с AgCl.
Анализ воды
Этот процесс осуществляется посредством оценки, которая проводится с использованием AgNO3 в качестве титранта и индикатора, определяющего окончание реакции (изменение цвета); то есть, когда в воде больше нет хлоридов.
Эта реакция приводит к осаждению AgCl вследствие сродства хлорид-иона к катиону серебра.
волюметрия
Это оценка образца с неизвестной концентрацией (хлориды или бромиды). Чтобы найти концентрацию образца, он реагирует с веществом; конечная точка реакции распознается по образованию осадка. В случае хлоридов это будет хлорид серебра.
ссылки
- Г. Н (1970) Количественный химический анализ (второе издание). N.Y. Харпер энд Роу издатели, Inc.
- W. (1929). Исследование Серебряного Хлорида Электрода. J. Am. Chem. Soc.51(10), стр. 2901-2904. DOI: 10.1021 / ja01385a005
- Д. Вест Д. (2015) Основы аналитической химии(Девятое издание). Мексика. Cengage Learning Editores, S.A, Inc.
- A. Rosenblum.N. et.al (2018) Энциклопедия истории фотографии Britannica, inc . Получено: britannica.com
- Хлорид серебра (s.f). В Википедии выздоровел wikipedia.org
Источник: ru.thpanorama.com
Хлорид серебра I
Хлорид серебра I (хлористое серебро) — AgCl, неорганическое бинарное соединение серебра с хлором, серебряная соль хлороводородной (соляной) кислоты. В нормальных условиях представляет собой белый порошок или бесцветные кристаллы. Встречается в природе в виде минерала хлораргирита.

Молекулярная и кристаллическая структура
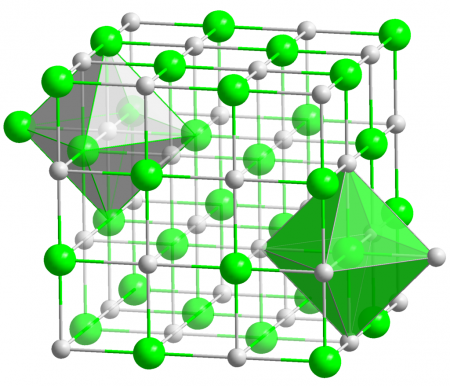
Кристаллическая структура AgCl
Хлорид серебра имеет следующий элементный состав: Ag (75,26 %), Cl (24,74 %). Атом серебра в молекуле находится в состоянии sp 3 d 2 -гибридизации. Энергия разрыва связи в соединении (Есв.): 313 кДж/моль, длина связи Ag—Cl: 0,228 нм.
Кристаллы AgCl принадлежат к кубической сингонии, структура типа NaCl, пространственная группа Fm3m, параметры элементарной ячейки a = 0,5549 нм, Z = 4. Центральный атом образует с соседями октаэдр, координационное число равно 6.
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера.
Физические свойства
Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро».
Хлорид серебра чрезвычайно мало растворим в воде: при 25 °C произведение растворимости (ПР) составляет 1,77⋅10 −10 . С повышением температуры растворимость соединения повышается: при 100 °C ПР = 2,81⋅10 −8 . Нерастворим в минеральных кислотах, этиловом и метиловом спирте, ацетоне. Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке. Из-за образования комплексных соединений хлорид серебра заметно растворим в концентрированной соляной кислоте и растворах хлоридов.
- стандартная энтальпия образования, ΔH°298: −127 кДж/моль;
- стандартная энтропия, S°298: 96 Дж/(моль·K);
- стандартная энергия Гиббса, ΔG°298: −110 кДж/моль.
- стандартная мольная теплоемкость, Cp°298: 50,79 Дж/(моль·K);
- энтальпия плавления, ΔHпл: 13,2 кДж/моль;
- энтальпия кипения, ΔHкип: 184 кДж/моль.
Зависимость давления насыщенного пара (P, в барах) для соединения в диапазоне температур (T) от 1185 до 1837 K выражается следующим уравнением:
log10 P = 4,95155 − 8775,980/T−62,718
Получение
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы):

Химические свойства
- Разлагается при комнатной температуре под действием света:
- Образует с гидратом аммиака, тиосульфатами и цианидами щелочных металлов растворимые комплексные соединения:
- Вступает в окислительно-восстановительные реакции, восстанавливаясь до металлического серебра:
- Растворяется в концентрированных растворах хлоридов и соляной кислоты, образуя комплексы:
- Медленно реагирует с концентрированной серной кислотой при кипячении:
- В растворах жидкого аммиака из-за растворимости в нём соли можно провести обменные реакции, недоступные в водных растворах:
Применение
- Светочувствительный компонент фотографических эмульсий различных фотографических материалов;
- Компонент электродов химических источников тока на основе систем Ag/AgCl/Cl − ;
- Компонент электропроводящих стёкол;
- Материал для линз в ИК-спектроскопии;
- Промежуточный продукт, образующийся при извлечении серебра из сульфидной руды:
- Реагент для получения сереброорганических соединений:
- Входит в состав антимикробных композиций на основе ионов серебра.
Безопасность
Соединение может вызвать раздражающий эффект при контакте с кожей и слизистыми оболочками.
Соединения серебра
- Серебро (Ag)
- Азид серебра (AgN3) Тринитрид серебра
- Амид серебра (AgNH2)
- Антимонид серебра I (Ag3Sb)
- Арсенат серебра I (Ag3AsO4) Арсенат серебра
- Арсенид серебра I (Ag3As) Арсенид трисеребра
- Ацетат серебра (AgC2H3O2) Серебро уксуснокислое
- Ацетиленид серебра (Ag2C2)
- Бензоат серебра (AgC7H5O2) Серебро бензойнокислое
- Бромат серебра I (AgBrO3) Серебро бромноватокислое
- Бромид серебра I (AgBr) Серебро бромистое
- Вольфрамат серебра (Ag2WO4) Серебро вольфрамовокислое
- Гексафторогерманат серебра (Ag2[GeF6])
- Гидроксид серебра (AgOH) Гидроокись серебра
- Гидрофосфат серебра (Ag2HPO4) Фосфорнокислое серебро кислое
- Гипонитрит серебра (Ag2N2O2) Серебро азотноватистокислый
- Диборид серебра (AgB2) Серебро бористое
- Дигидрофосфат серебра (AgH2PO4)
- Дихромат серебра (Ag2Cr2O7) Бихромат серебра (Серебро двухромовокислое)
- Йодат серебра (AgIO3) Серебро йодноватокислое
- Йодид серебра I (AgI) Серебро йодистое
- Карбонат серебра I (Ag2CO3) Серебро углекислое
- Лактат серебра (AgC3H5O3) Серебро молочнокислое
- Лаурат серебра (AgC12H23O2) Серебро лауриновокислое
- Метафосфат серебра (AgPO3) Серебро фосфорнокислое
- Молибдат серебра (Ag2MoO4) Серебро молибденовокислое
- Нитрат серебра I (AgNO3) Серебро азотнокислое (Ляпис или адский камень)
- Нитрат серебра II (Ag(NO3)2) Азотнокислое серебро
- Нитрид серебра I (Ag3N)Серебро азотистое
- Нитрит серебра I (AgNO2) Серебро азотистокислое
- Оксалат серебра (Ag2C2O4) Серебро щавелевокислое
- Оксид серебра I (Ag2O) Окись серебра
- Оксид серебра III (Ag2O3)
- Оксид серебра I,III (Ag2O2) Серебро окись
- Ортоарсенит серебра I (Ag3AsO3) Арсенит серебра
- Ортофосфат серебра I (Ag3PO4)
- Пальмитат серебра (AgC16H31O2) Серебро пальмитиновокислое
- Периодат серебра (AgIO4) Серебро йоднокислое
- Перманганат серебра (AgMnO4) Серебро марганцовокислое
- Перренат серебра (AgReO4) Серебро рениевокислое
- Перхлорат серебра (AgClO4) Серебро хлорнокислое
- Пирофосфат серебра (Ag4P2O7) Дифосфат серебра
- Пропионат серебра (AgC3H5O2) Серебро пропионовокислое
- Реактив Толленса ([Ag(NH3)2]ОН)
- Селенат серебра (Ag2SeO4) Серебро селеновокислое
- Селенид дисеребра (Ag2Se) Серебро селенистое
- Селенит серебра (Ag2SeO3) Серебро селенистокислое
- Субфторид серебра (Ag2F) Гемифторид серебра
- Сульфат серебра (Ag2SO4) Серебро сернокислое
- Сульфид серебра I (Ag2S) Серебро сернистое
- Сульфид серебра II (AgS) Сернистое серебро
- Сульфит серебра (Ag2SO3) Серебро сернистокислое
- Тартрат серебра (Ag2C4H4O6) Серебро виннокислое
- Теллурид серебра (AgTe) Серебро теллуристое
- Теллурид серебра I (Ag2Te) Теллурид дисеребра
- Теллурит серебра (Ag2TeO3) Серебро теллуристокислое
- Тетрафтороборат серебра (Ag[BF4]) Тетрафторобориат серебра
- Тиоантимонит серебра (Ag3SbS3) Серебро тиосурьмянистокислое
- Тиосульфат серебра (Ag2S2O3) Серебро тиосернокислое
- Тиоцианат серебра I (AgSCN) Серебро роданистое
- Фосфид серебра (Ag3P) Серебро фосфористое
- Фторид серебра I (AgF) Серебро фтористое
- Фторид серебра II (AgF2) Фтористое серебро
- Фульминат серебра (AgONC) Гремучее серебро
- Хлорат серебра (AgClO3) Серебро хлорноватокислое
- Хромат серебра (Ag2CrO4) Серебро хромовокислое
- Хлорид серебра I (AgCl) Серебро хлористое
- Хлорит серебра (AgClO2) Серебро хлористокислое
- Цианамид серебра (Ag2CN2)
- Цианат серебра (AgOCN) Серебро циановокислое
- Цианид серебра I (AgCN) Серебро цианистое
- Цитрат серебра (Ag3C6H5O7) Серебро лимоннокислое
Источник: chem.ru