Задания. 1. Получите аммиак по реакции гидроксида кальция с хлоридом аммония.
2. Изучите некоторые физические свойства аммиака (цвет, запах, относительную плотность, растворимость в воде).
3. Изучите взаимодействие аммиака с водой, азотной и соляной кислотами.
4. Проделайте реакции:а) между раствором аммиака в воде и серной кислотой;б) между гидроксидом аммония и раствором хлорида железа (III).
Соблюдайте правила техники безопасности при проведении опытов!
Оборудование. Детали прибора для получения аммиака, лабораторный штатив, штатив с пробирками, фарфоровая ступка с пестиком, ложечка или шпатель, стеклянные палочки (2 шт.), пробка с держателем, нагревательный прибор.
Вещества. Кристаллические гидроксид кальция и хлорид аммония; концентрированная соляная, концентрированная азотная и 20% -я серная кислоты; вода (в стакане), раствор фенолфталеина, раствор хлорида железа (III).
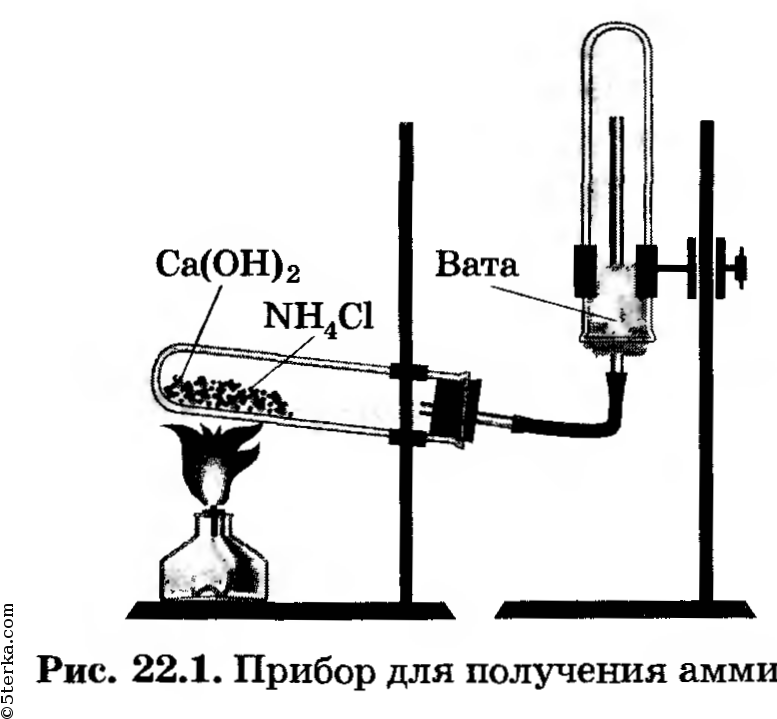
Получение аммиака. Соберите прибор для получения аммиака (рис. 22.1), испытайте на герметичность. За
Хлорид серебра AgCl восстановление до металлического
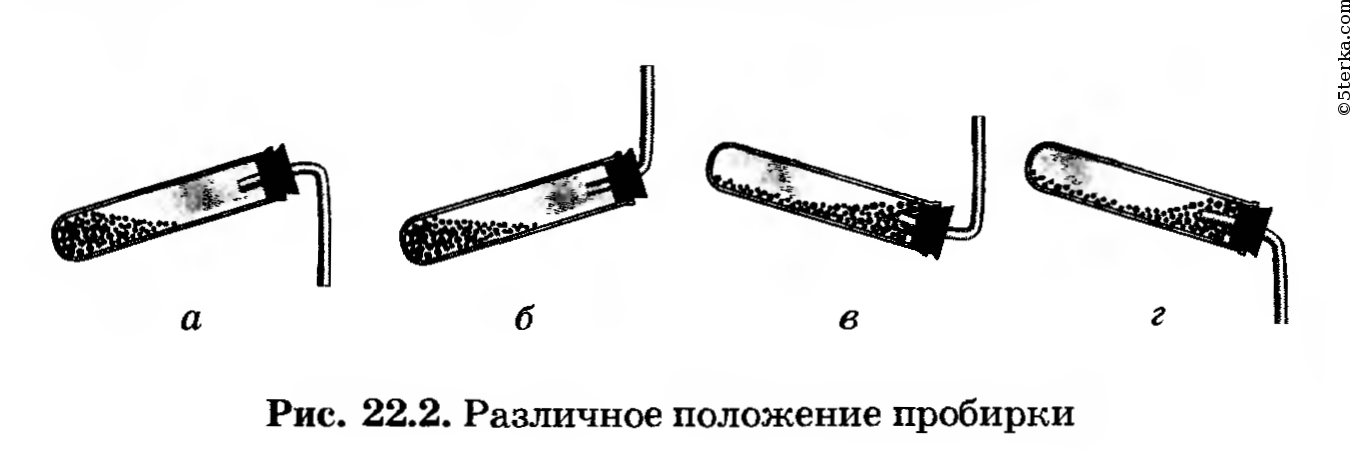
крепите его в штативе так, чтобы удобно было нагревать пробирку. Решите, какое положение пробирки (рис. 22.2, а, б, в или г) является правильным.
Приготовьте три сухих (почему?) пробирки, которые предстоит наполнить аммиаком. Закройте их пробками.
В ступку насыпьте по одной ложечке хлорида аммония и гидроксида кальция, перемешайте их, разотрите пестиком. Затем перенесите порцию смеси в пробирку прибора, заполнив ее не более чем на 1/3.
Начните нагревать содержимое пробирки, при этом сначала обогрейте пламенем горелки всю пробирку, затем пламя направьте так, чтобы нагревалась поверхность смеси.
Наполните три пробирки аммиаком, заткните их пробками с держателями; прекратите нагревание и, не разбирая прибора, перенесите его в вытяжной шкаф.
Изучение свойств аммиака.
1. Исследуйте растворимость, взаимодействие аммиака с водой. Для этого опустите пробирку с аммиаком в стакан с водой и под водой откройте ее, как это показано на рисунке 22.3.
Что вы наблюдаете?
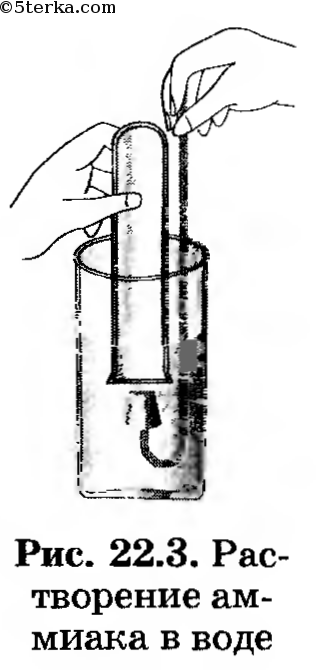
Не вынимая пробирку, закройте ее также под водой пробкой с держателем, после чего поставьте в штатив. К полученному раствору добавьте 2—3 капли раствора фенолфталеина.
Составьте уравнение реакции взаимодействия аммиака с водой.
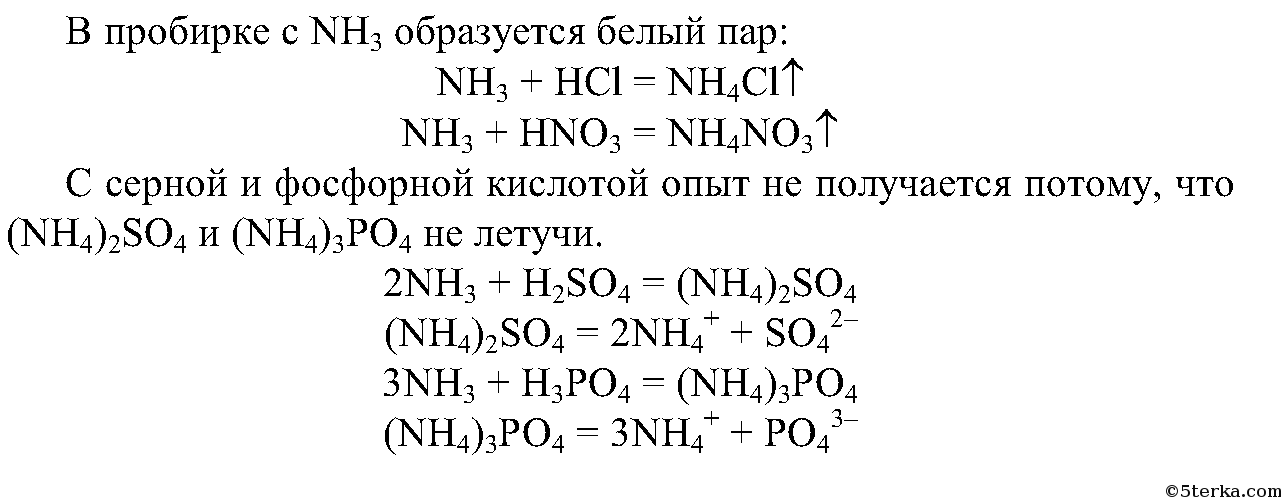
2. Смочите стеклянную палочку концентрированной соляной кислотой, другую — концентрированной азотной кислотой. Внесите их поочередно в пробирки с аммиаком. Что вы наблюдаете?
Составьте уравнения происходящих реакций.
Почему опыт не получится при использовании серной и фосфорной кислот?
3. Разлейте полученный водный раствор аммиака в воде в две пробирки. В одну пробирку добавьте несколько капель раствора фенолфталеина и осторожно прилейте серную кислоту до исчезновения окраски индикатора. Что вы наблюдаете?
Лабораторная работа №5. Комплексообразование
Составьте уравнения реакций образования сульфата и гидросульфата аммония.
4. В другую пробирку с раствором аммиака добавьте раствор хлорида железа (III). Что вы наблюдаете?
Запишите ионные уравнения реакций.
Правильное положение пробирки под б). Во-первых, NH3 легче, чем воздух, он будет подниматься вверх, поэтому газоотводная трубка должна также быть направлена вверх. Во-вторых, мы будем нагревать вещество в пробирке, поэтому оно не должно соприкасаться с пробиркой, которая от огня может расплавиться.
Пробирки должны быть сухими, т.к. аммиак реагирует с водой и в результате образуется гидроксид аммония.
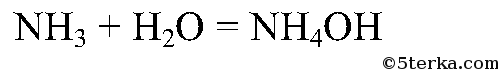
Реакция получения аммиака:
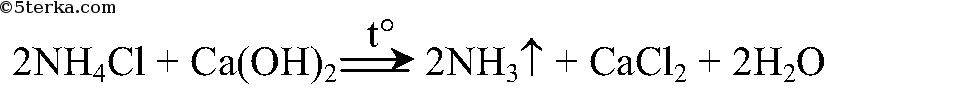
Изучение свойств аммиака:
1.
Аммиак хорошо растворяется в воде:
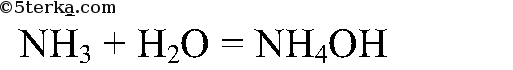

Раствор обесцвечивается, поскольку серная кислота нейтрализует аммиак, т.е. среда становится нейтральной. В нейтральной и кислой среде фенолфталеин бесцветный.
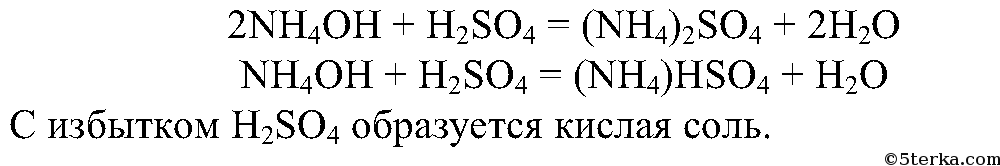
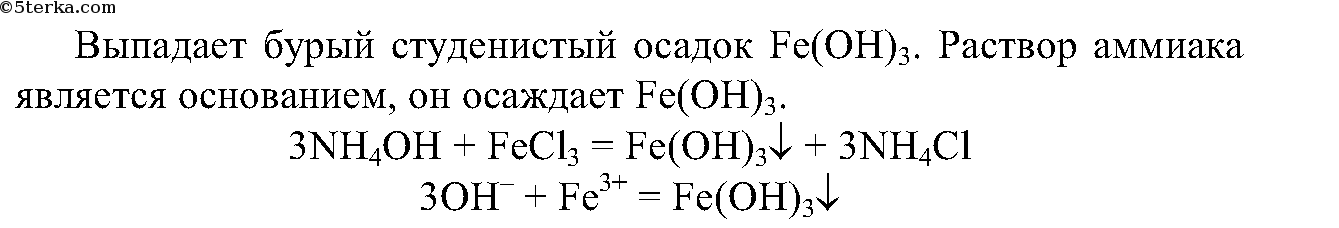
Источник:

Решебник по химии за 9 класс (Л.С.Гузей, В.В.Сорокин, Р.П.Суровцева, 2000 год),
задача №3
к главе «Практические занятия».
Источник: 5terka.com
Расчет условий растворения и осаждения осадков
Из постоянства произведения концентраций ионов в насыщенном растворе в заданных условиях вытекают два следствия, позволяющие рассчитать условия осаждения (растворения) осадка.
Увеличение в растворе концентрации одного из ионов осадка, приводит к уменьшению концентрации в растворе других ионов, поэтому растворимость соединения AmBn в присутствии одноименного иона (например, В) равна

Если произведение концентраций ионов в растворе меньше произведения растворимости, осадок растворяется, и, наоборот, осадок выпадает, если произведение концентраций ионов превышает произведение растворимости.
Это позволяет решать практически важные задачи: находить условия количественного осаждения малорастворимого соединения, условия начала образования осадка или условия, при которых осадок не выпадает.
ПРИМЕР 9. Рассчитайте рН начала осаждения гидроксида магния из 0.010 М раствора хлорида магния.
Решение. Осадок начнет осаждаться, когда величина [Mg 2+ ][OH — ] 2 превысит значение Кs(Mg(OH)2).
Для упрощения расчетов примем γ(Mg 2+ ) и γ(ОН — ) равными единице. Тогда

ПРИМЕР 10. Рассчитайте рН количественного осаждения карбоната бария 0.5 М раствором карбоната аммония.
Решение. Условие количественного осаждения – снижение концентрации осаждаемого иона в растворе до 1·10 -6 М. Таким образом, задача сводится к отысканию условий, при которых равновесная концентрация карбонат-иона в растворе удовлетворяет величине произведения растворимости.
Принимая коэффициенты активности равными единице, рассчитаем равновесную концентрацию карбонат-иона, необходимую для полного осаждения:

Равновесная концентрация карбонат-иона связана с общей концентрацией карбоната аммония соотношением:

где а (СО3 2- ) – коэффициент зависящий от рН

По условиям задачи


ПРИМЕР 11. Выпадет ли осадок сульфида кадмия, если через раствор, содержащий 1·10 -3 М кадмия и 1 М соляной кислоты, пропустить до насыщения сероводород (С(H 2S) = 0.1 М)?
Решение. Запишем условие образования осадка сульфида кадмия

Поскольку в вышеуказанных условиях осаждения протекают конкурирующие реакции и с участием иона кадмия

и с участием сульфид-иона

то при I ≈ 0 условие образования осадка надо записать так:

Запишем уравнение материального баланса

По таблицам находим β1 = 1.12·10 2 , β2 = 3.98·10 2 , β3 = 2.51·10 2 , β4 = 7.94·10 2 . Находим a(Cd 2+ ) и a(S 2- ) в 1 М НС1:


Поскольку найденная величина меньше, чем 7.94·10 -27 , осадок не выпадает.
Задачи
1. Рассчитайте растворимость хромата серебра:
а) при ионной силе, равной нулю;
б) в 0.010 М растворе нитрата калия.
2. Рассчитайте растворимость фосфата цинка:
а) при ионной силе, равной нулю;
б) в 0.05 М растворе хлорида калия;
в) в 0.05 М растворе хлорида аммония.
3. Рассчитайте растворимость гидроксида магния:
а) при ионной силе, равной нулю;
б) в 0.05 М растворе хлорида калия;
в) в 0.05 М растворе хлорида аммония.
4. Рассчитайте растворимость хромата бария:
а) при ионной силе, равной нулю;
б) при рН 4.0 (образованием Cr2O7 2- пренебречь).
5. Выпадет ли осадок сульфата стронция, если к 1 мл 0.010 М раствора нитрата стронция добавить равный объем насыщенного раствора сульфата кальция?
6. Рассчитайте рН полного осаждения оксалата кальция 0.100 М раствором оксалата аммония.
7. Рассчитайте рН полного осаждения гидроксида магния.
8. Рассчитайте растворимость MgNH4PO4 в 0.10 М растворе хлорида аммония.
9. Можно ли разделить магний и железо (III) осаждением в виде гидроксидов из раствора, содержащего по 0.010 М хлорида железа(III) и магния?
10. Почему фосфат кальция растворяется в 0.1 М уксусной кислоте, а фосфат железа(III) не растворяется?
Контрольные вопросы
1. Выведите формулу произведения растворимости.
2. Что называется термодинамическим произведением растворимости? От каких факторов зависит его величина?
3. Как влияет одноименный ион на растворимость осадка? Изобразите эту зависимость графически.
4. Почему при выделении осадка следует избегать большого избытка осадителя?
5. Как влияют электролиты на растворимость осадка?
6. Что называется реальным произведением растворимости? В каких условиях реальное произведение растворимости является константой?
7. Как влияют конкурирующие химические реакции на растворимость осадка?
8. Что называется условным произведением растворимости? От каких факторов зависит его величина?
9. Выведите формулу для расчета растворимости соединения AmBn.
10. В каких случаях по величинам произведений растворимости можно сравнивать растворимость малорастворимых соединений?
11. Сформулируйте условия образования и растворения осадка.
12. Как влияет температура на растворимость осадка?
13. Почему растворимость в одних случаях с повышением температуры увеличивается, а в других уменьшается?
14. Каковы причины растворимости малорастворимых соединений: а) в кислотах; б) в щелочах?
15. Как рассчитать константу равновесия реакции растворения малорастворимого соединения в кислоте?
16. Что такое фракционное осаждение? Приведите примеры.
17. Сравните влияние электростатических взаимодействий ионов и конкурирующих химических реакций на растворимость осадков.
18. Растворяется ли MgNH4PO4 в кислотах? Какие продукты образуются в зависимости от силы кислоты?
19. Почему в уксуснокислой среде из смеси катионов бария, стронция и кальция в осадок выпадает только хромат бария? Как добиться полноты осаждения хромата бария?
20. Почему при действии бихромата калия на раствор соли бария выпадает хромат бария?
21. Почему хромат бария растворяется в уксусной кислоте при нагревании? В чем можно растворить хромат стронция? Как зависит состав раствора от силы кислоты?
22. В чем растворяется хромат стронция? Как зависит состав раствора от силы кислоты?
Воспользуйтесь поиском по сайту:
studopedia.org — Студопедия.Орг — 2014-2023 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.006 с) .
Источник: studopedia.org
Хлорид серебра и гидроксид аммония почему растворился осадок
Да, но до перехода у электрона был определённый спин. Может ли он после перехода в состояние с более высокой энергией стать другим?
Цитата FilIgor ( )
Если спин изменится — чисто логически, что ж им не спариться?
Группа: Супермодераторы
Сообщений: 6490
Статус: Offline
Цитата денис1 ( )
Квантовая механика более современна.
Она будет рассматривать этот вопрос, но уже на другом уровне.
Цитата FilIgor ( )
Может быть, сейчас что-то изменилось, если предоставится возможность, спрошу Цирельсона.
Группа: Пользователи
Сообщений: 1
Статус: Offline
Группа: Супермодераторы
Сообщений: 6490
Статус: Offline
Группа: Пользователи
Сообщений: 1146
Статус: Offline
2) Почему гидроксид магния растворяется в растворе хлорида аммония?
Mg(OH)2+[NH4]Cl ↔ Mg 2+ +NH3*H2O. Такое уравнение реакции? Предполагаю, что она идёт обратимо, но почему равновесие смещено вправо? Может быть из-за того, что аммиак медленно испаряется, уходя из сферы реакции?
3) Обратная реакция тоже идёт при добавлении к раствору хлорида магния раствора аммиака. Необходимо ответить на такой вопрос касательно обратной реакции: «Концентрация какого иона увеличивается в растворе, и как это влияет на концентрацию OH — ?» Предполагаю, что увеличивается концентрация ионов аммония. Но как это влияет на концентрацию OH — , не знаю.
Группа: Супермодераторы
Сообщений: 1839
Статус: Offline
Цитата денис1 ( )
1) Почему сульфаты бария и стронция не растворяются в соляной и азотной кислотах, а сульфат кальция — растворяется? Имхо, все данные реакции не будут идти. Точнее — будут идти в обратную сторону, так как только тогда образуется осадок.
Это — из разряда «вечных вопросов». Сульфат кальция растворяется в кислотах, потому что такова природа катиона и аниона. Такое соотношение энтальпийных и энтропийных характеристик равновесия. Их можно охарактеризовать всякими числами, можно даже углУбиться в квантовые всякие дела, но на выходе будет тот же самый ответ — такова природа.
Цитата денис1 ( )
2) Почему гидроксид магния растворяется в растворе хлорида аммония? Mg(OH)2+[NH4]Cl ↔ Mg2++NH3*H2O. Такое уравнение реакции? Предполагаю, что она идёт обратимо, но почему равновесие смещено вправо? Может быть из-за того, что аммиак медленно испаряется, уходя из сферы реакции?
Источник: chemistlab.ru