
Если подружить благородный металл серебро и соляную кислоту, получится хлорид серебра – бесцветные кристаллы или белая соль, способная плавиться при температуре 455° С и кипеть без разложения при 1554° С. Популярность пришла на заре развития фотографии. Способность изменять цвет завораживала. Но помимо светочувствительности, соединение хлора с серебром несет в себе много других замечательных свойств.
И целой страны мало
Серебро по латыни аргентум, поэтому обозначено в химии Ag. В честь него названа целая страна Аргентина, хотя рудники и добыча ведется по всему миру не одно тысячелетие. Есть стойкое убеждение, что запасов его гораздо меньше, чем золота, и придет время, когда их положение в иерархии драгоценностей поменяется. Время покажет, оправданы такие ожидания или нет.
А пока серебро широко используется не только ювелирами. Оно, как в чистом виде, так и в соединениях, широко используется в промышленности и в технике.
Качественные реакции на хлорид-, бромид- и йодид-ионы
Формула хлорида серебра очень проста: одновалентный хлор соединяется с одновалентным Ag и на выходе получают вещество, которое записывается символом AgCl. Но в действительности процесс несколько сложнее. Хлор относится к группе галогенов, активных элементов 17-й группы периодической таблицы Д. И. Менделеева. Галоген с греческого «порождающий соль», потому что все галогены – активные окислители, в чистом виде в природе практически не встречаются.
Серебро, наоборот, принадлежит сообществу благородных металлов, включающему помимо него золото и платиновую группу. Все они, в той или иной степени, химически инертны, «неохотно» вступают в химические реакции. В природе существуют в соединениях и в чистом виде, таком как слитки, самородки, жилы и россыпи, за что их ценят ювелиры и монетные дворы.
Оно более активно, чем золото. Чтобы получить его хлорид, запускают взаимодействие растворимых серебросодержащих солей, обычно – нитрата серебра, с хлоридами, той же поваренной солью. В результате реакции замещения происходит выпадение осадка белого цвета. Соединение нестойкое, через некоторое время под воздействием света темнеет, потому что происходит выделение молекул чистого аргентума, которые соединяются с молекулами серы.
Сероводород всегда присутствует в атмосфере, вот почему серебряные вещи тускнеют и покрываются патиной. Соль, меняющая цвет, подтолкнула к идее фотографического изображения.
Вещество одно, свойств много
У хлорида серебра кристаллическая структура кубического вида, где центральный атом образует с соседями октаэдр, почти такой же, как у поваренной соли NaCl (хлорид натрия). Но в отличие от последней, плохо растворим в воде. При 25° C произведение растворимости составляет всего 1,77•10−10. Показатели растворимости AgCl в минеральных маслах нулевые.
Он не растворяется в минеральных кислотах, этиловом и метиловом спирте, ацетоне. Зато растворим в водных растворах аммиака и в жидком аммиаке.

Модель молекулы аммиака
Аммиак – активное соединение водорода и азота, при его окислении образуются кислоты азота, которые легко увлекают металлы, создавая с ними соли, относящиеся к азотнокислым. В частности, нитрат серебра (формула AgNO3) – кристаллическое вещество, используемое для гальванического серебрения, в производстве зеркал, в медицине (ляпис) и для получения других соединений серебра, в том числе хлорида.
Светочувствительность AgCl, когда цвет меняется на глазах, быстро нашла применение в фотографии, но развитие химии показало, что бромид серебра обладает лучшими свойствами менять цвет под воздействием света.
Тем не менее, AgCl нашел себя в других областях человеческой деятельности. В первую очередь, в медицине и косметике, ведь антибактерицидные свойства серебра известны давно. Вода, в которую опустили серебряный крестик, не портится и не зацветает, становится святой.
И для людей, и для науки
Любое полезное свойство быстро находит применение. Препараты, в основе которых хлорид серебра, встречаются:
- среди мазей и гелей для борьбы с угревой сыпью у молодежи;
- в гомеопатии как материал с антибактериальными свойствами;
- в производстве лекарственных препараторов, в частности такого знаменитого, как Silargetten – главного средства борьбы с заражениями и сепсисом в эпоху до пенициллина.
В промышленности используется не менее широко:
- для компонентов фотоэмульсий и различных фотографических материалов;
- при изготовления электродов химических источников тока;
- для компонента электропроводящих стекол;
- в качестве материала для линз в ИК-спектроскопии;
- в виде промежуточного продукта при извлечении его из сульфидной руды;
- в качестве реагента для сереброорганических соединений.
AgCl большей частью производится лабораторным способом, но его можно встретить и в природе в виде минерала хлораргирита.
При работе всегда есть опасность раздражения на коже и на слизистых оболочках с последующими осложнениями.
Источник: gdeserebro.ru
Гидролиз хлорида серебра (I)
Хлорид серебра (I) – средняя соль, образованная слабым основанием – гидроксидом серебра (I) (AgOH) и сильной кислотой – соляной (хлороводородной) (HCl). Формула — AgCl.
Представляет порошок белого цвета. Молярная масса – 143 г/моль.

Рис. 1. Хлорид серебра (I). Внешний вид.
Гидролиз хлорида серебра (I)
Гидролизуется по катиону. Характер среды – кислый. Уравнение гидролиза имеет следующий вид:
AgCl ↔ Ag + + Cl — (диссоциация соли);
Ag + +HOH ↔ AgOH+ H + (гидролиз по катиону);
Ag + + Cl — + HOH ↔ AgOH + Cl — + H + (ионное уравнение);
AgCl+ H2O↔ AgOH + HCl (молекулярное уравнение).
Примеры решения задач
| Задание | Вычислите растворимость хлорида серебра (I) в воде. Произведение растворимости этого вещества (Ksp) равно 10 -10 . |
| Решение | Условно запишем уравнение диссоциации хлорида серебра (I) в воде: |
Тогда, выражение для расчета произведения растворимости этого вещества будет записываться следующим образом:
Растворимость вещества в воде обозначается s и выражается в моль/л. Растворимость хлорида серебра (I) в воде будет равна:
s= [Ag + ]=[ Cl — ] = sp = -10 = 10 -5 моль/л.
| Задание | В раствор, содержащий 7,2 г хлорида меди (II) прилили нитрат серебра, в результате чего наблюдали выпадение творожистого осадка белого цвета. Какое вещество выпало в осадок? Рассчитайте его массу. |
| Решение | Запишем уравнение реакции взаимодействия хлорида меди (II) с нитратом серебра: |
Вещества, выпавшее в осадок – хлорид серебра (I).
Найдем количество вещества хлорида меди (II) используя данные, указанные в условии задачи (молярная масса равна 134 г/моль):
Согласно уравнению реакции
Тогда рассчитаем массу выделившегося хлорида серебра (I) (молярная масса – 143 г/моль):
m(AgCl)= υ(AgCl)×M(AgCl)= 0,02 ×143 = 2,86г.
Источник: ru.solverbook.com
Хлорид серебра(I)
В нормальных условиях, хлорид серебра — это белый порошок или бесцветные кристаллы.
Встречается в природе в виде минерала хлораргирита.
- 1 Молекулярная и кристаллическая структура
- 2 Физические свойства
- 3 Химические свойства
- 4 Получение
- 5 Применение
- 6 Безопасность
- 7 См. также
- 8 Примечания
Молекулярная и кристаллическая структура
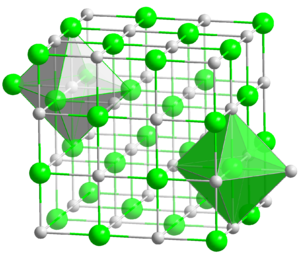
Кристаллическая структура AgCl
Хлорид серебра имеет следующий элементный состав: Серебро (Ag) — 75,26 %, хлор (Cl) — 24,74 %. Атом серебра в молекуле находится в состоянии sp 3 d 2 -гибридизации. Энергия разрыва связи в соединении (Есв.): 313 кДж/моль, длина связи Ag—Cl: 0,228 нм [6] .
Кристаллы AgCl принадлежат к кубической сингонии, структура типа NaCl, пространственная группа Fm3m, параметры элементарной ячейки a = 0,5549 нм, Z = 4. Центральный атом образует с соседями октаэдр, координационное число равно 6 [7] .
В газовой фазе хлорид серебра существует в форме мономера, димера и тримера [7] .
Физические свойства
Хлорид серебра — белое или бесцветное вещество, плавящееся и кипящее без разложения. В расплавленном состоянии имеет жёлто-коричневый цвет. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро» [8] .
Хлорид серебра чрезвычайно мало растворим в воде: при 25 °C произведение растворимости (ПР) составляет 1,77⋅10 −10 . С повышением температуры растворимость соединения повышается: при 100 °C ПР = 2,81⋅10 −8 [9] . Нерастворим в минеральных кислотах, этиловом и метиловом спиртах, ацетоне. Растворим в водных растворах аммиака, цианидов, роданидов и тиосульфатов щелочных металлов; пиридине и жидком аммиаке [4] [10] . Из-за образования комплексных соединений хлорид серебра заметно растворим в концентрированной соляной кислоте и растворах хлоридов.
- стандартная энтальпия образования, ΔH°298: −127 кДж/моль [11] ;
- Стандартная энтропия, S°298: 96 Дж/(моль·K) [11] ;
- Стандартная энергия Гиббса, ΔG°298: −110 кДж/моль [11] .
- Стандартная мольная теплоемкость, Cp°298: 50,79 Дж/(моль·K) [4] ;
- Энтальпия плавления, ΔHпл: 13,2 кДж/моль [4] ;
- Энтальпия кипения, ΔHкип: 184 кДж/моль [4] .
Зависимость давления насыщенного пара (P, в барах) для соединения в диапазоне температур (T) от 1185 до 1837 K выражается следующим уравнением [12] :
Химические свойства
- Разлагается при комнатной температуре под действием света:
- Образует с гидратом аммиака, тиосульфатами и цианидами щелочных металлов растворимые комплексные соединения:
- Вступает в окислительно-восстановительные реакции, восстанавливаясь до металлического серебра [13] :
- Растворяется в концентрированных растворах хлоридов и соляной кислоты, образуя комплексы:
- Медленно реагирует с концентрированной серной кислотой при кипячении [15] :
- В растворах жидкого аммиака из-за растворимости в нём соли можно провести обменные реакции, недоступные в водных растворах [16] :
Получение
Хлорид серебра образуется в виде белого осадка при взаимодействии растворимых солей серебра, обычно — нитрата, с хлоридами (данная реакция является качественной на хлорид-анионы):
Применение
- Светочувствительный компонентфотографических эмульсий различных фотографических материалов;
- Компонент электродов химических источников тока на основе систем Ag/AgCl/Cl − ;
- Компонент электропроводящих стёкол;
- Материал для линз в ИК-спектроскопии[17] ;
- Промежуточный продукт, образующийся при извлечении серебра из сульфидной руды [14] :[с. 167] :
- Реагент для получения сереброорганических соединений:
- Входит в состав антимикробных композиций на основе ионов серебра.
Безопасность
Соединение может вызвать раздражающий эффект при контакте с кожей и слизистыми оболочками.
См. также
Примечания
- ↑ 1,01,1Лидин Р. А., Андреева Л. Л., Молочко В. А. Глава 3. Физические свойства // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп.. — М. : «Дрофа», 2006. — С. 73. — ISBN 5-7107-8085-5.
- ↑ 2,02,1Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — P. 8—9. — ISBN 0-07-049439-8.
- ↑ 3,03,1Турова Н. Я. Неорганическая химия в таблицах. — М. : Высший химический колледж РАН, 1997. — С. 88.
- ↑ 4,04,14,24,34,44,54,6 [www.xumuk.ru/spravochnik/863.html Серебра хлорид] (неопр.) . Справочник по веществам. XuMuK.ru. Дата обращения: 1 марта 2010.
- ↑Ю. Ю. Лурье. Справочник по аналитической химии. — М. : Химия, 1979. — С. 88. — 480 с. — 80 000 экз.
- ↑Лидин Р. А., Андреева Л. Л., Молочко В. А. Часть III. Глава 5. Энергия и длина связи для двухатомных частиц // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп.. — М. : «Дрофа», 2006. — С. 378. — ISBN 5-7107-8085-5.
- ↑ 7,07,1 Серебра галогениды // Химическая энциклопедия / Главный редактор И. Л. Кнунянц. — М. : «Советская энциклопедия», 1995. — Т. 4. — С. 635—636. — ISBN 5-85270-092-4.
- ↑Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. Учебное пособие для вузов. — М. : «Химия», 1981. — С. 591.
- ↑Произведения растворимости(неопр.) . Новый справочник химика. Химическое равновесие. Свойства растворов. ChemAnalytica.Com (1 апреля 2009). Дата обращения: 4 марта 2010.
- ↑Таблица неорганических и координационных соединений(неопр.) . Новый справочник химика. Основные свойства неорганических, органических и элементоорганических соединений. ChemAnalytica.Com (31 марта 2009). Дата обращения: 4 марта 2010.
- ↑ 11,011,111,2Лидин Р. А., Андреева Л. Л., Молочко В. А. Часть IV. Глава 1. Энтальпия образования, энтропия и энергия Гиббса образования веществ // Константы неорганических веществ: справочник / Под редакцией проф. Р. А. Лидина. — 2-е изд., перераб. и доп.. — М. : «Дрофа», 2006. — С. 440. — ISBN 5-7107-8085-5.
- ↑Silver Chloride. Phase change data(англ.). NIST Chemistry WebBook. National Institute of Standads and Technology. Дата обращения: 17 марта 2010.Архивировано 20 апреля 2012 года.
- ↑Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ / 3-е изд., под редакцией Р.А. Лидина. — М. : «Химия», 2000. — С. 296. — ISBN 5-7245-1163-0.
- ↑ 14,014,1 Неорганическая химия / Под редакцией Ю. Д. Третьякова. — Академия, 2004. — Т. 3: Химия переходных элементов. Кн. 2. — 368 с. — ISBN 5-7695-2533-9.
- ↑Пятницкий И.В., Сухан В.В.Аналитическая химия серебра. — М. : «Наука», 1975. — С. 23.
- ↑Дроздов А.А., Зломанов В.П., Мазо Г.Н., Спиридонов Ф.М. Неорганическая химия. Т.2: Химия непереходных элементов / Под ред. акад. Ю.Н.Третьякова. — М. : Издательский центр «Академия», 2004. — Т. 2. — С. 178. — ISBN 5-7695-1436-1.
- ↑Silver Chloride (AgCl)(англ.). Products. Crystran Ltd. Дата обращения: 18 марта 2010.Архивировано 20 апреля 2012 года.
Источник: xn--h1ajim.xn--p1ai