Оксиды меди – это группа веществ, состоящих из атомов кислорода и меди. Выделяют несколько разновидностей оксида меди: I, II, III. Они отличаются физико-химическими свойствами. Соединения применяют в основном в стекольной промышленности, как красители, в качестве реагентов органической и неорганической химии, противогрибкового средства.
Что такое оксиды меди
Оксид меди представляет собой бинарное вещество, в котором кислород находится в степени окисления 2 – , а свойства меди отличаются. Это амфотерный металл, способный вступать в превращения с кислотами и с щелочами за счёт различной валентности. Валентностью называют способность элемента удерживать возле себя другие атомы. Меди свойственна валентность I и II.
Виды (оксиды меди I, II и III), формулы
Оксид меди I – это закись меди, которая широко встречается в природе в минеральном виде. Формула меди оксида – Cu2O. Минерал куприт представлен кубическими кристаллами красного оттенка: от розового до ярко-алого. Иногда формируют слоистые, игольчатые образования. Проявляет алмазный блеск, твёрдость по шкале Мооса – 4. Месторождения расположены по всему миру: Франция, Россия (Урал), Намибия, Аризона.
Взаимодействие водорода с оксидом меди (II)
Описывается оксид меди формулой CuO (II). В окружающей среде его находят в тенорите. Он распространён в форме громоздких неправильных чёрных масс. Характеризуется металлическим блеском и средней твёрдостью. Зоны раскопок сопряжены с сульфидными залежами, формируется в местах вулканической активности, был найден в лаве Везувия.
Оксид меди III – нестабильное вещество, которое удалось выделить только в ионных средах. Формула меди оксида III – Cu2O3.
Физические свойства, внешний вид

Внешний вид оксида меди II (порошок)
Свойства меди оксидов различны. Все они не растворяются в воде и органических растворителях: ароматических веществах, а также спиртах: метаноле, этаноле, в эфирах. Оксид меди I – твёрдый кристаллический порошок кирпично-красного цвета, реже тёмного, коричневатого.
Оксид меди II – мелкодисперсные чёрные кристаллы. Распадается при достижении отметки температурного режима в 1100 °C. Плотность 6,31 г/см 3 . Плавится при температуре 1447 °С, при нагревании до 2000 °С – закипает.
Свойства меди оксида III неизвестны.
Химические свойства, реакции
Оксиды меди реагируют со многими типами веществ. Так, оксид меди I взаимодействует с гидроксидом аммония:
Оксид меди реагирует с перманганатом калия:
Оксид меди I реагирует с хлороводородом. При погружении в него оксида меди кислота даёт хлорид, выпадающий в осадок:
Активно реагируют с оксидом меди кислоты других неметаллов. Оксид меди I вступает в реакцию с азотистой кислотой:
Оксид меди I с угарным газом даёт окислительно-восстановительную реакцию:
Взаимодействие уксусной кислоты с оксидом меди (II)
По схожему механизму протекают реакции с другими газами:
Однако с кислородом оксид меди I проявляет восстанавливающие свойства:
Оксид меди I при разогревании до 1800 °С разлагается, запускается реакция термолиза:
У оксида меди II слабо выражена амфотерность, это более сильный основный оксид. Особо выражено действие на оксид меди кислот. Вещество меди оксид реагирует с бромводородом:
Оксид меди II взаимодействует с кислотными оксидами:
Вещество меди оксид при смешивании с углеродом даёт металлическую медь и монооксид:
Реакция взаимодействия оксида меди II с алюминием протекает с формированием глинозёма:
Производство и получение оксидов меди I, II и III
Химическая формула оксида меди II
В лабораторных условиях оксид меди получают разнообразными способами. Чаще всего применимо нагревание медной стружки в кислороде до 200 °С:
Для этого могут быть использованы реактивы йодида и гидроксида:
В промышленности для синтеза оксида меди I пригодны высокотемпературные процессы (600 – 1300 °С):
Для получения оксида меди I на заводе применяют прокаливание сульфида меди (I) при непрерывном вентилировании:
Оксид меди II добывают из соответствующих гидроксидов:
Его можно получить и из природного сырья (малахит):
Применение (оксиды меди I, II и III)
Основная сфера применения меди оксида – производство стекла. Благодаря наличию меди в составе вещество обладает выраженной окраской и способно передавать пигмент продукции.
Оксид меди I применяют для придания окраски керамическим и стеклянным изделиям. В качестве красителя его добавляют в глазури и водостойкие краски, которые наносят на суда. Оксид меди I обладает активностью пестицида, поэтому применение для прокрашивание им дна корабля защищает его от обрастания водорослями и, соответственно, разрушения.
Кроме того, применение меди оксида I распространяется на сферу сельского хозяйства. Вещество обладает противогрибковой активностью и работает как фунгицид. Оно нарушает целостность мембраны клеток патогенных микроорганизмов, дестабилизирует их, блокирует деление и рост мицелия. Применение оксида меди I эффективно для борьбы с такими микозами, как:
- мучнистая роса;
- пятнистости;
- серая и чёрная гниль;
- мумификация;
- млечный блеск;
- головня.
Применение оксида меди I способствует возвращению здорового вида растения, нормализации цветения и плодоношения. При соблюдении допустимых дозировок средство не наносит вреда растительным клеткам и не вредит урожаю. Обработку проводят в сухую безветренную погоду согласно инструкции.
Оксид меди II используется для окрашивания стекла в зелёный и синий цвета, производства витражей, медно-рубиновых стёкол. Другая сфера применения меди оксида II – химия. Это важный восстанавливающий реагент, необходимый для получения других соединений меди.
Опасность оксидов меди
Оксид меди I и оксид меди II относятся ко 2 классу опасности (высокоопасное вещество). При попадании на слизистую дыхательных путей вызывает сильное раздражение, ожоги, провоцирует кашель и перфорации. Неосторожное применение приводит к покраснениям кожи и появлению язв. При работе с оксидом меди I необходимо соблюдать меры осторожности, надевать защитную одежду и респиратор. Вещество крайне токсично для водной среды, поскольку убивает зоопланктон (рачков-дафний).
Где купить и сколько стоит
Оксиды меди можно приобрести в специализированных магазинах. 100 грамм оксида меди I – порядка 750 рублей. Стоимость оксида меди II – 1400 руб/100 г. Оптом вещества меди оксиды продаются заводами-производителями: от 40 руб/кг.
Заключение
Оксиды меди – это соединения меди с кислородом. Разновидности оксидов меди отличаются между собой, они не растворяются в воде, функционируют как окислители и восстановители. Основная сфера использования – выпуск цветных стёкол, а также садоводство и огородничество, где вещество используется как фунгицид, борющийся с грибковыми болезнями культурных растений. Оксиды меди I и II токсичны для человека и водных обитателей, обращаться с ними следует осторожно. Оксид меди III теоретически существует, но практически не был выделен.
- Нитрат меди: свойства, реакции и применение
- Гидроксиды меди: виды, свойства, применение
- Сульфат меди Е519: свойства, применение, вред и польза
- Нитрат алюминия: свойства, реакции, применение
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
Источник: chtoikak.ru
Какие два вещества вступают в реакцию с оксидом меди 2?
У нас есть 23 ответов на вопрос Какие два вещества вступают в реакцию с оксидом меди 2? Скорее всего, этого будет достаточно, чтобы вы получили ответ на ваш вопрос.
Содержание
- Какие вещества не реагируют с оксидом меди 2?
- Что образуется при слиянии серной кислоты с оксидом меди II )?
- Как определить оксид меди 2?
- Какие два из перечисленных веществ не вступают в реакцию с оксидом железа III?
- Какие вещества не вступают в реакцию с медью?
- Что будет если смешать сульфат меди и гидроксид натрия?
- Как получить медь из оксида меди?
- Кто вступает в реакцию с оксидом меди 2?
- Какие вещества вступают в реакцию с оксидом железа 2?
- Какие два вещества вступают в реакцию с оксидом меди 2? Ответы пользователей
- Какие два вещества вступают в реакцию с оксидом меди 2? Видео-ответы
Отвечает Марина Зуйкова
Решение. Основный оксид меди (II) взаимодействует с кислотами и кислотными оксидами, также он может быть восстановлен до меди такими восстановителями как водород, углерод, оксид углерода (II).
Какие вещества не реагируют с оксидом меди 2?
Оксид меди — основный оксид, который соответствует нерастворимому основанию — он с водой не реагируют.
Что образуется при слиянии серной кислоты с оксидом меди II )?
Реакция обмена между оксидом меди и серной кислотой проходит с образованием соли – сульфата меди и воды.
Как определить оксид меди 2?
Окси́д ме́ди(II) (окись меди) CuO — оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета.
Какие два из перечисленных веществ не вступают в реакцию с оксидом железа III?
Какие два из перечисленных веществ не вступают в реакцию с оксидом железа(III)? Решение. Гидроксид железа(III) нерастворим, поэтому оксид железа(III) не взаимодействует с водой. А также он не реагирует с серебром.
Источник: querybase.ru
Оксид меди (II)

Оксид меди (II) (окись меди) CuO — оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета.
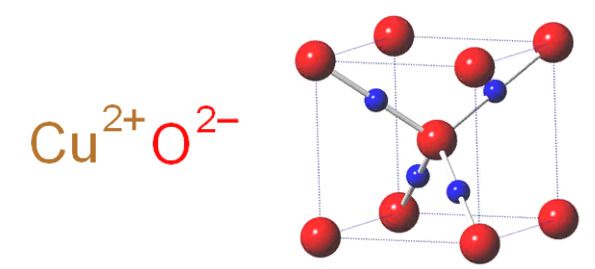
Кристаллическая решётка оксида меди характеризуется следующими параметрами: моноклинная сингония, пространственная группа C2h, параметры ячейки a = 0.46837(5) нм , b = 0.34226(5) нм , c = 0.51288(6) нм , α = 90° , β = 99,54(1)° , γ = 90° . Атом меди окружён четырьмя атомами кислорода и имеет искажённую плоскую конфигурацию.

Получение
Получить оксид меди (II) можно:
- нагревая металлическую медь на воздухе (при температурах ниже 1100 °C):
- нагревая гидроксид меди (II), её нитрат или карбонат:
- нагревая малахит:
Химические свойства
Оксид меди (II) реагирует с кислотами с образованием соответствующих солей меди (II) и воды:
При сплавлении CuO со щелочами образуются купраты:
При нагревании до 1100 °C разлагается на медь и кислород.
Оксиду меди (II) соответствует гидроксид меди (II) Cu(OH)2, который является очень слабым основанием. Он способен растворяться в концентрированных растворах щелочей с образованием комплексов (то есть обладает слабыми амфотерными свойствами):
Cu(OH)2 + 2NaOH → Na2[Cu(OH)4] (тетрагидроксокупрат (II) натрия).
Оксид меди(II) восстанавливается до металлической меди аммиаком, монооксидом углерода, водородом, углем:
CuO + H2 → Cu + H2O 2CuO + C → 2Cu + CO2
Физические свойства
Оксид меди (II) относится к моноклинной кристаллической системе.
Работа выхода электрона из кристалла CuO составляет 5,3 эВ.
Оксид меди (II) представляет собой полупроводник p-типа с узкой шириной запрещенной зоны 1,2 эВ.
Оксид меди может быть использован для производства сухих батарей.
Применение
CuO используют при производстве стекла и эмалей для придания им зелёной и синей окраски. Кроме того, оксид меди применяют в производстве медно-рубинового стекла.
В лабораториях применяют для обнаружения восстановительных свойств веществ. Вещество восстанавливает оксид до металлической меди, при этом чёрный цвет оксида меди переходит в розовую окраску меди.
Соединения меди
- Ацетат-арсенит меди I (C4H6As6Cu4O16) Парижская зелень
- Ацетат меди I (C2H3CuO2) Уксуснокислая медь I
- Ацетат меди II (C4H6CuO4) Уксуснокислая медь II
- Ацетиленид меди I (Cu2C2) Карбид меди
- Ацетиленид меди II (CuC2) Ацетиленистая медь
- Бензоат меди II (Cu(C6H5COO)2) Бензойнокислая медь
- Бромат меди II (Cu(BrO3)2) Бромноватокислая медь
- Бромид меди I (CuBr) Бромистая медь
- Бромид меди II (CuBr2) Дибромид меди
- Вольфрамат меди II (CuWO4) Вольфрамовокислая медь
- Гексафторосиликат меди I (Cu2[SiF6]) Гексафторосиликат меди I
- Гексафторосиликат меди II (Cu[SiF6]) Гексафторосиликат меди II
- Гидрид меди I (CuH) Водородистая медь
- Гидроксид меди I (CuOH) Гидроксид меди I
- Гидроксид меди II (Cu(OH)2) Гидроксид меди II
- Глицинат меди II (Cu(NH2CH2COO)2) Аминоуксуснокислая медь
- Глюконат меди II (CuC12H22O14) Глюконовокислая медь
- Дигидроксотетрааммиакат меди ([Cu(NH3)4](OH)2) Реактив Швейцера
- Диоксид меди (CuO2) Перекись меди ( Пероксид меди )
- Диселенид меди (CuSe2) Селенистая медь
- Дисульфид меди II (CuS2) Сернистая медь
- Дифосфид меди (CuP2) Фосфористая медь
- Дихромат меди II (CuCr2O7) Бихромат меди ( Двухромовокислая медь )
- Йодат меди II (Cu(IO3)2) Йодноватокислая медь
- Йодид меди I (CuI) Йодид меди
- Карбонат меди I (Cu2CO3) Углекислая медь I
- Карбонат меди II (CuCO3) Углекислая медь II
- Лактат меди II (Cu(C3H5O3)2) Молочнокислая медь
- Лаурат меди II (Cu(C11H23COO)2) Лауриновокислая медь
- Метаборат меди II (Cu(BO2)2) Борнокислая медь
- Метаванадат меди II (Cu(VO3)2) Ванадиевокислая медь
- Метагерманат меди (CuGeO3) Германиевокислая медь
- Нитрат меди I (CuNO3) Азотнокислая медь I
- Нитрат меди II (Cu(NO3)2) Азотнокислая медь
- Нитрид меди (Cu3N) Азотистая медь
- Оксалат меди II (CuC2O4) Щавелевокислая медь
- Оксид меди I (Cu2O) Закись меди ( гемиоксид меди или оксид димеди )
- Оксид меди II (CuO) Окись меди
- Оксид меди III (Cu2O3) Триоксид димеди
- Олеат меди II (Cu(C17H33COO)2) Олеиновокислая медь
- Ортофосфат меди II (Cu3(PO4)2) Фосфат меди
- Пальмитат меди II (CuC32H62O4) Пальмитиновокислая медь
- Перхлорат меди II (Cu(ClO4)2) Хлорнокислая медь
- Платинамедь (CuPt) ( медьплатина )
- Рицинолеат меди II (Cu(C18H33O3)2 Рицинолевокислая медь
- Салицилат меди II (Cu(C7H5O3)2 Салициловокислая медь
- Селенат меди II (CuSeO4) Селеновокислая медь
- Селенид меди I (Cu2Se) Селенистая медь I
- Селенид меди II (CuSe) Селенистая медь II
- Селенит меди II (CuSeO3) Селенистокислая медь
- Стеарат меди II (CuC36H70O4) Стеариновокислая медь
- Сульфат меди I (Cu2SO4) Сульфат меди I
- Сульфат меди II (CuSO4) Сульфат меди ( медный купорос )
- Сульфид меди I (Cu2S) Моносульфид димеди
- Сульфид меди II (CuS) Сульфид меди
- Сульфит меди I,II (Cu2SO3•CuSO3•2H2O) Сернистокислая медь I,II
- Сульфит меди I (Cu2SO3) Сернистокислая медь I
- Тетрафтороборат меди II (Cu[BF4]2) Тетраборнокислая медь
- Тиоцианат меди I (CuSCN) Тиоциановокислая медь I ( Роданид меди I )
- Тиоцианат меди II (Cu(SCN)2) Тиоциановокислая медь II Роданистая медь ( Роданид меди II )
- Формиат меди II (Cu(HCOO)2) Муравьинокислая медь
- Фторид меди I (CuF) Фтористая медь
- Фосфит меди II (CuPHO3) Фосфористокислая медь ( фосфанат меди )
- Фторид меди II (CuF2) Дифторид меди
- Хлорат меди II (Cu(ClO3)2) Хлорноватокислая медь
- Хлорид меди I (CuCl) Хлористая медь I
- Хлорид меди II (CuCl2) Хлористая медь II
- Хромат меди II (CuCrO4) Хромовокислая медь
- Хромит меди II (CuCr2O4) Хромит меди
- Цианид меди I (CuCN) Цианид меди I
- Цианид меди II (Cu(CN)2) Цианид меди II
- Цитрат меди II Cu3(C6H5O7)2 Лимоннокислая медь
Источник: chem.ru