FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
получение хлорида серебра
Красным цветом приводится решение , а фиолетовым ― объяснение.
Задание 2
С какими из перечисленных веществ реагирует соляная кислота: нитрат калия, нитрат серебра (I), гидроксид калия, оксид углерода (IV), оксид меди (II), гидроксид железа (III)? Напишите уравнения реакций в молекулярном, полном и сокращённом ионном виде.
HCl + AgNO3 = AgCl↓ + HNO3
H + + Cl — + Ag + + NO3 — = AgCl↓ + H + + NO3 —
Ag + + Cl — = AgCl↓
CuO + 2HCl = CuCl2 + H2O
CuO + 2H + + 2Cl — = Cu 2+ + 2Cl — + H2O
CuO + 2H + = Cu 2+ + H2O
Задание 3
Какую реакцию называют реакцией нейтрализации? Реакцию между кислотой и основанием.
Какая соль образуется при нейтрализации азотной кислоты гидроксидом кальция? Нитрат кальция Ca(NO3)2.
Напишите уравнение реакции.
2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O
Задание 4
При смешивании двух бесцветных растворов — нитрата ртути (II) и иодида калия выпадает ярко-красный осадок иодида ртути (II) (рис. 32). Напишите уравнение реакции в молекулярном, полном и сокращённом ионном виде.
Ag(NO3)2 + 2KI = AgI2↓ + 2KNO3
Ag + + 2NO3 — + 2K + + 2I — = AgI2↓ + 2K + + 2NO3-
Ag + + 2I — = AgI2↓
Задание 5
При действии на сульфид железа (II) соляной кислотой наблюдается выделение газа сероводорода H2S. Напишите уравнение реакции в молекулярном, полном и сокращённом ионном виде.
FeS + 2HCl = FeCl2 + H2S↑
FeS + 2H + + 2Cl — = Fe 2+ + 2Cl — + H2S↑
FeS + 2H + = Fe 2+ + H2S↑
Задание 6
Какую область химии называют аналитической? Область химии, занимающуюся определением качественного и количественного состава неизвестных веществ, называют аналитической химией.
Что такое качественный, количественный анализ? Качественный анализ отвечает на вопрос, из атомов каких элементов состоит то или иное вещество, а количественный анализ позволяет определить соотношение атомов, образующих соединение, а также ответить на вопрос, сколько того или иного вещества содержится в данном образце. В основе качественного определения некоторых ионов лежат реакции, заканчивающиеся образованием осадков.
Химическая металлизация. Часть 2: Получаем основной компонент — нитрат серебра.
Задание 7
Какие ионы выступают реагентами на хлорид-ионы? Ионы нитрата серебра.
По каким признакам можно судить о наличии в растворе хлорид-ионов? По образованию белого творожистого осадка хлорида серебра AgCl↓
Задание 8
Реактивом на сульфат-ионы служат растворимые соли бария, образующие с сульфат-ионами белый кристаллический осадок сульфата бария, нерастворимый в кислотах. Напишите уравнение реакции взаимодействия серной кислоты с раствором хлорида бария в молекулярном, полном и сокращённом ионном виде.
BaCl2 + H2SO4= BaSO4↓ + 2HCl
Ba 2+ + 2Cl — + 2H + + SO4 2- = BaSO4↓ + 2H + + 2Cl —
Ba 2+ + SO4 2- = BaSO4↓
Задание 9
Напишите два уравнения реакций в молекулярном виде, отвечающие сокращённому ионному уравнению
H + + ОН – = H2O
NaOH + HCl = NaCl + H2O
2KOH + H2SO4 = K2SO4 + H2O
Задание 10
Какая масса 10%-го раствора гидроксида натрия потребуется для полной нейтрализации 98 г 10%-го раствора серной кислоты?
Дано: m(р-ра H2SO4)=90 г, ω1(H2SO4)=10%, ω2(NaOH)=10%
Найти: m(р-ра NaOH)-?
Решение
1. Вычисляем массу серной кислоты в растворе.
m(H2SO4)=m1(р-ра H2SO4)•ω(H2SO4):100%=98 г • 10%:100%=9,8 г
2. Количество вещества серной кислоты рассчитываем по формуле: n=m/M, где M ― молярная масса
M(H2SO4)=98 г/моль
n(H2SO4)=m( H2SO4 )/M( H2SO4 )=9,8 г : 98 г/моль=0,1 моль
3. Составим химическое уравнение: 2NaOH + H2SO4 = Na2SO4 + H2O
По уравнению реакции n(NaOH)/2=n(H2SO4)/1, поэтому
n(NaOH)=2 • n(H2SO4)=2 •0,1 моль = 0,2 моль
4. Массу гидроксида натрия рассчитываем по формуле: m=n•M, где M ― молярная масса.
M(NaOH)=40 г/моль
m( NaOH )=n( NaOH )•M( NaOH )=0,2 моль • 40 г/моль=8 г
5. Вычисляем массу раствора гидроксида натрия.
m(р-ра NaOH)= m(NaOH):ω(NaOH) •100% =8 г : 10% • 100%=80 г
Ответ: m(р-ра NaOH)= 80 г
Задание 11
Какой объём газа (н.у.) выделится при действии на 13,2 г сульфида железа (II) соляной кислотой?
Дано: m(FeS)=13,2 г
Найти: V(H2S)-?
Решение
1. Количество вещества сульфида железа рассчитываем по формуле: n=m/M, где M ― молярная масса.
M(FeS)=88 г/моль
n(FeS)=m(FeS):M(FeS)=13,2 г : 88 г/моль=0,15 моль
2. Составим химическое уравнение: FeS + 2HCl = FeCl2 + H2S ↑
По уравнению реакции n(FeS)/1=n(H2S)/1, поэтому
n(H2S)=n(FeS)=0,15 моль
3. Объём сероводорода рассчитываем по формуле: V=n•Vm, где Vm ― молярный объём.
V( H2S )=n( H2S )•Vm=0,15 моль•22,4 л/моль=3,36 л
Ответ: V(H2S)=3,36 л
Задание 12
Предложите схему опыта, позволяющего определить наличие в водопроводной воде ионов:
а) кальция;
Реактив ― углекислый газ. Наблюдаем растворение малорастворимого осадка CaCO3.
CaCO3 ↓ + H2O + CO2 = Ca(HCO2)2
б) железа (III);
Реактив ― щелочь. Наблюдаем образование бурого осадка Fe(OH)3 ↓ .
Fе 3+ + 3OH — = Fe(OH)3 ↓
в) SO4 2- ;
Реактив ― cоли бария. Наблюдаем образование белого осадка BaSO4 ↓ , нерастворимого в кислоте.
Ba 2+ + SO4 2- = BaSO4 ↓
г) CO3 2- .
Реактив ― сильная кислота. Наблюдаем бурное выделение газа.
CO3 2- + 2H + = H2O + CO2 ↑
- Еремин Химия 11 класc 2019
- 2021-09-18
Источник: gdz.cool
имеется следующий перечень хим веществ : серебро,железо,нитрат серебра,нитрат железа2,хлорид кальция

Железо — Fe, серебро — Ag, нитрат серебра — AgNO_3, нитрат железа(II) — Fe(NO_3)_2, хлорид кальция — CaCl_2, карбонат натрия — Na_2CO_3, карбонат кальция — CaCO_3, хлорид натрия — NaCl.
Объяснение:
только цыфры снизу напиши мленькие ³ так только снизу

Отвечает Бауыржанкызы Айсулу.
Конечно! Вот химические формулы каждого из веществ из вашего перечня:
- Серебро — Ag
- Железо — Fe
- Нитрат серебра — AgNO3
- Нитрат железа(II) — Fe(NO3)2
- Хлорид кальция — CaCl2
- Карбонат натрия — Na2CO3
- Карбонат кальция — CaCO3
- Хлорид натрия — NaCl
Обратите внимание, что нитрат железа(II) и карбонат кальция имеют указание на валентность железа в скобках для обозначения соответствующего оксидационного состояния железа.
Источник: uznavalka.pro
Вопросы к параграфу 50 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман

Твёрдые вещества растворили в воде, далее прилили соляную кислоту.
В одной пробирке выделяется газ без цвета и запаха:
![]()
![]()
В пробирке — карбонат натрия.
К другим растворам добавили несколько капель фенолфталеина.
Содержимое одной из пробирок окрасилось с малиновый цвет.
В пробирке — гидроксид натрия (образует щелочную среду).
К оставшимся растворам добавили нитрат серебра.
В одной пробирке выпадает белый осадок:
![]()
В одной пробирке находится хлорид магния, в пробирке с осадком — нитрат натрия.
2. При помощи характерных реакций докажите, что выданное вам вещество — сульфат алюминия.

3. В одной пробирке дан раствор хлорида натрия, во второй — раствор хлорида стронция, а в третьей — раствор хлорида алюминия. Определите, в какой пробирке находится каждое из выданных веществ.
К растворам добавили сульфат калия.
В одной пробирке выпадает белый осадок:
![]()
В пробирке — хлорид стронция.
К оставшимся растворам прилили раствор гидроксида натрия.
![]()
В пробирке — хлорид аллюминия. В пробирке с осадком — хлорид натрия.
4. Практически осуществите следующие превращения:
Fe→FeCl2→Fe(OH)2→Fe(OH)3→Fe(NO3)3
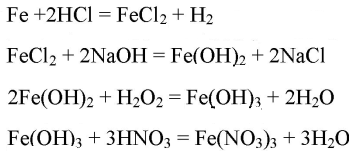
Вариант 2. Распознавание карбоната кальция CaCO3, нитрата стронция Sr(NO3)2, сульфата натрия NaSO4, сульфида натрия Na2S. 1. В четырех пробирках даны следующие твёрдые вещества: а) карбонат кальция; б) нитрат стронция; в) сульфат натрия; г) сульфид натрия. Определите, в какой пробирке находится каждое из перечисленных веществ.
Растворили твёрдые вещества и добавили к растворам соляную кислоту.
В пробирке вещество не растворилось в воде, после добавления соляной кислоты выделился газ без запаха и цвета:
![]()
В пробирке — карбонат кальция.
В другой пробирке выделяется газ с характерным запахом тухлых яиц:
![]()
В пробирке — сульфид натрия.
К остальным растворам прилили раствор серной кислоты.
В одной из пробирок выпадает белый осадок:
![]()
В пробирке — нитрид стронция, в пробирке с осадком — сульфат натрия.
2. Докажите, что кристаллы сульфата железа (III) частично окислились и содержат примеси ионов Fe3+.
Качественным реагентом на присутствие трёхвалентного железа является роданид калия. Появляется красное окрашивание.
![]()
3. В двух склянках дана вода. В одной из них вода содержит сульфат магния, а в другой — гидрокарбонат кальция. Проделайте опыты, при помощи которых можно устранить постоянную и временную жёсткость воды.
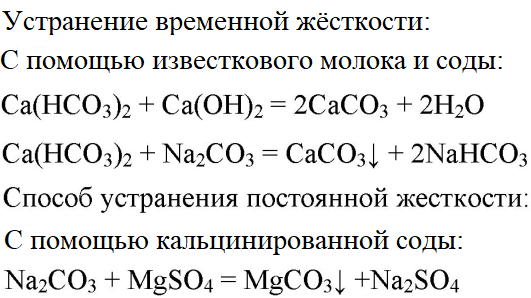
4. Практически осуществите следующие превращения:
Аl→Al2(SO4)3→Аl(ОН)3→Na[Al(OH)4]
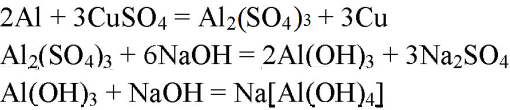
5. Отчёт о работе оформите в произвольной форме.
Отчёт представлен выше (1,2,3,4 пункты каждого варианта).
Источник: gdzwow.com