Повышение температуры меняет прочность комплексных ионов серебра в сторону уменьшения. Первоначально прочный комплексный ион ( Кн), разложение и разряд которого протекают с преодолением высокого энергетического барьера, но достижении 100 меняется на менее прочный ( Кн), разряд которого протекает более облегченно, с преодолением меньшего энергетического барьера. [4]
Для электродных процессов с участием комплексных ионов серебра ( хлоридных, роданидных) характерны ярко выраженные катодные и анодные поляризационные кривые. Анодные кривые имеют один максимум в широком интервале концентраций. Катодные волны сильно сдвинуты в сторону отрицательных потенциалов. Так, из 4М растворов соляной кислоты ионы серебра восстанавливаются при потенциалах более отрицательных, чем — 0 4 в, относительно насыщенного каломельного электрода, потенциал полуволны восстановления роданидного комплекса серебра из 1М раствора роданида калия близок к — 0 6 в относительно насыщенного каломельного электрода. [6]
АФФИНАЖ СЕРЕБРА. САМЫЙ ПРОСТОЙ СПОСОБ!!! Серебро с контактов. #серебро #аффинаж #драгметалы
Очевидно, что чем большей концентрации комплексных ионов серебра можно достигнуть в растворе, тем большее количество AgCl растворится. Если рассчитанная величина [ Ag ( NH3) J ], умноженная на объем раствора — ( общее число г / ионов комплексного соединения, могущее находиться в растворе), превышает число г-ионов Ag в осадке, то происходит полное растворение последнего. [7]
Некоторые из этих комплексов очень устойчивы; устойчивость ци-анидного комплексного иона серебра Ag ( CN) 2, например, настолько велика, что добавление иодид-иона не вызывает осаждения иодида серебра, хотя произведение растворимости иодида серебра очень мало. Ионы гексацианоферрата ( П) Ре ( СМ) Г, гексацианоферрата ( Ш) Fe ( CN) i — H гексацианокобальтата ( 1П) Co ( CN) — настолько устойчивы, что они почти не разрушаются под действием сильной кислоты. [8]
Некоторые из этих комплексов очень устойчивы; устойчивость цианид-ного комплексного иона серебра Ag ( CN) -, например, настолько велика, что добавление сульфида не вызывает осаждения сульфида серебра, хотя произведение растворимости сульфида серебра очень мало. Ионы гекса-цианоферрат ( П) -, гексацианоферрат ( Ш) — и ] гексацианокобальтат ( Ш) — [ Fe ( CN) -, Fe ( CN) g -, Co ( CN) ] настолько устойчивы, что они почти не разрушаются под действием сильной кислоты. [9]
Некоторые из этих комплексов очень устойчивы; устойчивость цианид-ного комплексного иона серебра Ag ( CN) i, например, настолько велика, что добавление иодид-иона не вызывает осаждения иодида серебра, хотя произведение растворимости иодида серебра очень мало. Ионы гекса-цианоферрата ( П) Fe ( CN) e -, гексацианоферрата ( Ш) Fe ( CN) и гексациано-кобальтата ( Ш) Co ( CN) i — настолько устойчивы, что они почти не разрушаются под действием сильной кислоты. [10]
Таким образом, комплекс [ Ag ( NH3) 2 ] является наименее устойчивым, а комплекс [ Ag ( CN) 2 ] — наиболее устойчивым из указанных трех комплексных ионов серебра . [11]
Таким образом, комплекс [ Ag ( NH3) 2 ] является наименее устойчивым, а комплекс [ Ag ( CN) 2 ] — — наиболее устойчивым из указанных трех комплексных ионов серебра . [12]
Простой способ аффинажа серебра. Аффинаж серебра. Выход из 10 штук переключателей ТП1-2 серебра.
Обнаруженное различие между действием ультразвука и вращением электрода на предельный ток / указывает на то, что появление последнего с увеличением концентрации раствора не может быть удовлетворительно объяснено, например, ограниченной скоростью диссоциации комплексного иона серебра , предшествующей акту разряда. [14]
Написать формулы комплексного цианида и аммиаката серебра, принимая координационное число серебра равное двум. Чем различаются комплексные ионы серебра в этих двух соединениях. [15]
Источник: www.ngpedia.ru
Урок 7. Комплексные ионы
В уроке 7 «Комплексные ионы» из курса «Химия для чайников» выясним, что такое сложный ион, а также чему равен заряд комплексного иона; рассмотрим примеры комплексных катионов и анионов; научимся определять координационное число и структуру комплексного иона, давать правильные названия ионам. Комплексные ионы тесно связаны с простыми ионами, поэтому советую вам подробно изучить урок 6 «Простые ионы», если вы этого еще не сделали.

Сложные ионы
Итак, мы уже знакомы с простыми ионами, состоящими из одного атома с избытком или недостатком электронов. Однако существуют и сложные ионы, состоящие из двух и более простых ионов. Сложные ионы часто называют комплексными ионами.
Приведем пример: аммоний NH 4 + , который состоит из одного иона азота N 3- и четырех атомов водорода H 1+ , его общий заряд равен +1; имеет форму тетраэдра, в вершинах которого расположен водород, а в центре — атом азота. Еще один пример комплексного иона: карбонат СO3 2- , в состав которого входит ион углерода С 4+ и три иона кислорода O 2- , общий заряд комплексного иона равен -2; имеет форму треугольника. Очевидно, что суммарный заряд комплексного иона равен сумме зарядов простых ионов, входящих в его состав.
Как и простые ионы, комплексные ионы образуют химические соединения:
Наиболее распространенные комплексные катионы смотрите на рисунке ниже:

Наиболее распространенные комплексные анионы смотрите на рисунке ниже:

Координационное число
Координационное число – это число атомов комплексного иона, которые окружают центральный атом и равноудалены от него. Координационное число зависит прежде всего от размеров центрального атома, а также окружающих его атомов или групп. Например, атом азота N в нитрат-ионе NO3 — окружают три атома кислорода, поэтому его координационное число равно 3. Атом серы больше атома азота, поэтому координационное число сульфат-иона SO4 равно 4. Чаще всего встречаются координационные числа 2, 3, 4 и 6. Ниже приведены наиболее распространенные координационные числа и соответствующие им ионы:

Возможные структуры ионов или молекул с координационными числами 3, 4 и 6 показаны на рисунке ниже:

Название ионов
Простые анионы получают название путем добавления окончания -ид к названию элемента, например фторид(F — )-, оксид(O 2- )-, хлорид(Cl — ) ионы и т.д. Если один элемент образует с кислородом несколько разных комплексных анионов, они получают окончания -ат или -ит в зависимости от того, выше или ниже степень окисления центрального атома в соответствующем анионе. Например: SO4 2- (сульфат-ион) и SO3 2- (сульфит-ион).
Надеюсь урок 7 «Комплексные ионы» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Источник: himi4ka.ru
Ионы

Частица, в которой содержится разное число протонов и электронов, называется ионом. Если количество протонов больше, ион приобретает положительный заряд и становится катионом. Ионы с отрицательным зарядом (преобладают электроны) называются анионами.
Общее описание
Впервые в химии понятие «ион» появилось в 1834 году благодаря экспериментам Майкла Фарадея. Учёный изучал электропроводность водных растворов кислот, солей, щелочей. Он предположил, что возможность проводить электричество обусловлена движением в растворе заряженных частиц – ионов.
Молекулы способны распадаться на ионы – атомы с недостатком или избытком электроном. Процесс распада называется электролитической диссоциацией, а образованный раствор или расплав – электролитом. Если опустить в раствор электролита электрод, катионы начнут двигаться к катоду – отрицательному полюсу, анионы – к аноду – положительному полюсу. Этим объясняется электропроводность электролитов.
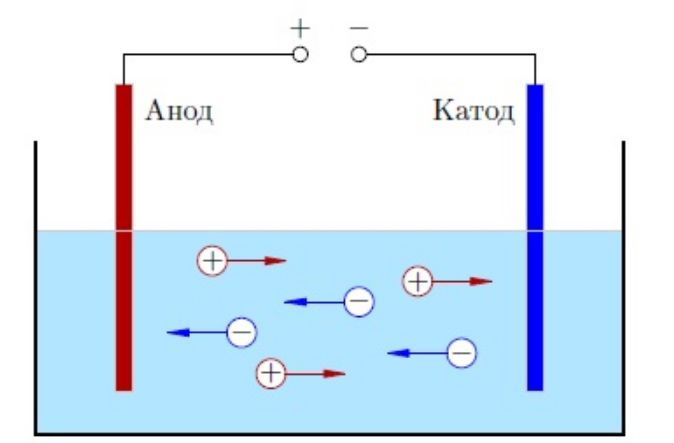
В растворах или в расплавах ионы образуются под действием молекул воды или высокой температуры.
Строение
Ионы состоят из ядра и электронов, движущихся вокруг. Ядро образуют положительно заряженные частицы (протоны) и нейтральные частицы (нейтроны). Количество протонов совпадает с порядковым номером элемента. Количество нейтронов равно значению разницы между относительной атомной массой и количеством протонов.
Электроны располагаются на энергетических уровнях. Количество уровней совпадает с периодом, в котором находится элемент. На внешнем энергетическом уровне находятся валентные электроны, которые могут взаимодействовать с другими атомами. При отдаче валентных электронов атом превращается в катион, при присоединении дополнительного электрона становится анионом.
Например, если к атому хлора присоединить ещё один электрон он станет отрицательно заряженным ионом – анионом. А если у атома натрия отнять один электрон, он станет положительно заряженным ионом – катионом, т.к. количество протонов станет больше, чем отрицательных электронов.
Катионы в уравнениях отмечаются плюсом, а анионы – минусом. Например, Fe 2+ , Al 3+ , Na + , F – , Cl – . Цифра означает, сколько электронов отдал или принял атом, став ионом, т.е. показывает степень окисления. Количество катионов или анионов можно посмотреть по таблице растворимости веществ.

Классификация
Ионы делятся на две группы:
- простые или моноатомные – содержат одно ядро, т.е. состоят из одного атома вещества;
- сложные или полиатомные – содержат минимум два ядра, т.е. состоят из двух и более атомов вещества.
К простым ионам относятся катионы и анионы металлов и неметаллов – Na + , Mg 2+ , Cl – . Сложные ионы образуются при присоединении иона к нейтральным молекулам вещества. Например:
Катионами являются ионы металлов, водорода, аммония и некоторых других веществ. Анионами являются гидроксид-ион (OH – ), ионы кислотных остатков, неметаллов и других веществ.
Некоторые атомы могут становиться катионами или анионами в зависимости от реакции.
Также выделяют ион-радикалы – свободные заряженные частицы, способные присоединять атомы или присоединяться к атомам других веществ. В зависимости от заряда делятся на китионы-радикалы и анионы-радикалы.
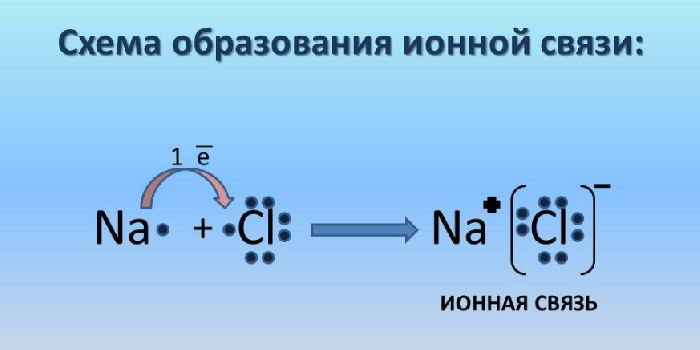
Ионная связь – класс соединения ионов. Ионная связь возникает в результате электростатического притяжения анионов и катионов. При этом атом с большей электроотрицательностью притягивает атом с меньшей электроотрицательностью. Ионная связь возникает преимущественно между ионами металлов и неметаллов. Металл всегда отдаёт электроны, т.е. является восстановителем.
Что мы узнали?
Из темы урока узнали, что такое ионы. Атом становится ионом при отщеплении или присоединении электронов. Если электронов становится меньше, то атом приобретает положительный заряд за счёт преобладания протонов и становится катионом. При увеличении количества отрицательно заряженных электронов атом становится анионом.
Ионы способны передавать электричество и обязательно присутствуют в электролитах. Между ионами возникает ионная связь за счёт электростатического притяжения отрицательных и положительно заряженных частиц.
Источник: obrazovaka.ru