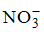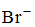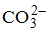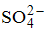Катионы натрия и калия относятся к I аналитической группе, которая характеризуется отсутствием группового реагента, т. е. реактива, способного осаждать все катионы этой группы из их растворов.
Реакция обнаружения катиона калия K +
Гексанитрокобальтат (III) натрия Nа3 [Со(NO2 )6 ] образует с ионами калия желтый кристаллический осадок гексанитрокобальтата (III) калия-натрия:
2 КС l + Na3 [Co(NO2 )6 ] = K2 Na[Co(NO2 )6 ] Ї + 2NaCl,
2 К + + Na + + [Co(NO2 )6 ] 3- = K2 Na[Co(NO2 )6 ] Ї .
Обнаружение иона К + с помощью гексанитрокобальтата (III) натрия проводят в нейтральном и слабокислом растворах, так как в щелочной среде и в присутствии сильных кислот реагент разлагается.
Реакция обнаружения катиона натрия Na +
Гексагидроксостибиат (V) калия К[Sb(ОН)6 ] образует с ионом натрия белый кристаллический осадок гексагидроксостибиата (V) натрия:
NaCI + К[Sb(ОН)6 ] = Na[Sb(OH)6 ] Ї + КСl,
Na + + [Sb(OH)6 ] = Na[Sb(OH)6 ] Ї .
Обнаружение иона Na + с помощью гексагидроксостибиата (V) калия проводят в нейтральном или слабощелочном растворе, так как кислоты разлагают реагент, а щелочи растворяют осадок Na[Sb(OH)6 ] с образованием хорошо растворимой средней соли.
Распознавание растворов натрия
Ионы s-элemeнтов IIA группы
Катионы магния, кальция, (бария и стронция относятся ко II аналитической группе, которая характеризуется наличием группового реагента (NН4 )2 СОз, осаждающего любой из приведенных катионов из его раствора.
Действие группового реагента. Карбонат аммония (NH4 )2 СОз с раствором соли магния образует белый аморфный осадок основной соли (MgOH)2 CO3 , растворимый в избытке NH4 Cl:
2MgCl2 + 2(NH4 ) 2 CO3 + Н 2 О = (MgOH) 2 CO3 Ї + СО 2 + 4NH4 Cl,
2Mg 2+ + 2CO3 2- + Н 2 О = (MgOH)2 CO3 Ї + CO2 .
Реакция обнаружения. Едкие щелочи и гидроксид аммония образуют с растворами солей магния белый аморфный осадок Mg(OH)2 , хорошо растворимый в кислотах и растворах аммонийных солей:
Mg 2+ + 2O Н — = Mg(OH)2 Ї
Растворение в кислотах:
Mg(OH)2 + 2H + = Mg 2+ + 2Н2 O.
Растворение в растворах аммонийных солей:
Mg(OH)2 + 2NH4 + = Mg 2+ + 2NH4 OH.
Действие группового реагента. Карбонат аммония (NН4 )2 СО3 осаждает катион Ва 2+ из растворов его солей в виде белого аморфного постепенно кристаллизующегося осадка ВаСО3 :
BaCl2 + (NH4 ) 2 CO3 = ВаСО 3 Ї + 2NH4 Cl,
Ва 2+ + CO3 2- = ВаСО3 Ї.
Осадок хорошо растворим в кислотах, в том числе и слабых.
Реакция обнаружения. Дихромат калия К2 Сг2 O7 образует с раствором соли бария желтый осадок ВаСгO4, нерастворимый в уксусной кислоте, в отличие от хромата стронция (хромат кальция хорошо растворяется в воде):
2Ba 2+ + Сг2 O7 2- + Н2 O = 2ВаСгO4 Ї + 2H + .
Реакцию проводят при избытке CH3 COONa, который реагирует с образующимися ионами Н + , смещая равновесие вправо вследствие образования малодиссоциированной уксусной кислоты:
СН3 СОС — + Н + = СН3 СООН.
Действие группового реагента. Карбонат аммония (NН4 ) 2 СО3 осаждает из растворов солей кальция аморфный белый осадок СаСО3 , который при нагревании переходит в кристаллический:
ЦИНАГОГА. Утро доброе. Радоваться! Непорочное сердце — это что?
CaCl2 + (NH4 ) 2 CO3 = СаСО 3 Ї + 2NH4 C1,
Ca 2+ CO3 2- = СаСО 3 Ї .
Осадок легко растворяется в минеральных и уксусной кислотах.
Реакция обнаружения. Оксалат аммония (NH4 )2 C2 O4 образует с раствором соли кальция белый кристаллический осадок, растворимый в соляной, но не растворимый в уксусной кислоте:
Аналогичный осадок дают ионы Ва 2+ и Sr 2+ . Поэтому этой реакцией можно обнаружить Са 2+ только при отсутствии ионов бария и стронция.
Действие группового реагента. Карбонат аммония (NH4 )2 CO3 При взаимодействии с растворами солей стронция осаждает карбонат стронция белого цвета, растворимый в уксусной, соляной и азотной кислотах:
SrCl2 + (NH4 )2 CO3 = SrCO3 Ї + 2NH4 C1.
Реакция обнаружения. Насыщенный раствор гипса CaSO4 . 2H2 O (гипсовая вода) образует с ионами Sr 2+ белый осадок сульфата стронция:
Sr 2+ + SO4 2- = SrSO4 Ї .
Однако при действии гипсовой воды ион стронция дает не обильный осадок, а только помутнение, появляющееся не сразу из-за образования пересыщенного раствора. Появление осадка ускоряют нагреванием.
Реакция служит для обнаружения Sr 2+ только при отсутствии Ba 2+ , которой с гипсовой водой вызывает помутнение, появляющееся сразу, так как растворимость BaSO4 меньше растворимости SrSO4 (Ks 0 (BaSO4 ) = 1,1 . 10 -10 , Ks 0 (SrSO4 ) = 2,8 . 10 -7 ).
Гипсовая вода не образует осадков с растворами солей кальция ни на холоду, ни при нагревании. Этим ион Ca 2+ отличается от ионов Ba 2+ и Sr 2+ .
Список литературы
Для подготовки данной работы были использованы материалы с сайта http://chemistry.narod.ru/
Дата добавления: 06.02.2004
База рефератов на портале KM.RU существует с 1999 года. Она пополнялась не только готовыми рефератами, докладами, курсовыми, но и авторскими публикациями, чтобы учащиеся могли использовать их и цитировать при самостоятельном написании работ.
Это популяризирует авторские исследования и научные изыскания, что и является целью работы истинного ученого или публициста. Таким образом, наша база — электронная библиотека, созданная в помощь студентам и школьникам.
Источник: www.km.ru
Определение характера среды растворов кислот и щелочей с помощью индикаторов

Вода хоть и в очень малой степени, но подвергается электролитической диссоциации по схеме:
Поскольку количества образующихся ионов H+и ОНГ равны друг другу:
Чистая вода имеет нейтральную среду.
При растворении в воде кислот среда становится кислой (кислотной), т. к. возрастает концентрация ионов водорода H+:
При растворении в воде щелочей среда становится щелочной, т. к. возрастает концентрация гидроксид-ионов:
На практике для характеристики степени кислотности раствора используют так называемый ВодородНый показатель, или pH. Поясним, что это такое.
В результате точных измерений было найдено, что концентрация ионов водорода в чистой воде равна c(H+) = 1 ∙ IO-7моль/л. Это очень маленькая величина. Вы, должно быть, знаете, что в естественных науках для большего удобства вместо обычных масштабов (шкал, графиков) часто используют логарифмические, что позволяет работать с несопоставимыми, казалось бы, величинами. Для удобства в химии используют не концентрацию ионов водорода, а отрицательный логарифм этой величины, называемый водородным показателем или pH: pH = — Ig c(H+)
Следовательно, вместо громоздкой записи c(H+) = 1 ∙ IO-7моль/л
Можно кратко записать:
Поскольку pH = — Ig c(H+) = — Ig (l∙10^7) = 7,0.
Итак, нейтральной среде соответствует значение pH = 7,0. В кислой среде e(H+) > 1 ∙ 10~7моль/л, следовательно, pH < 7,0. В щелочной среде e(H+) < 1 ∙ 10^7моль/л, следовательно, pH >7,0. Всё это наглядно представлено в таблице 7.
Таблица 7
Среда раствора
Нейтральная
Используемая на практике шкала pH растворов изменяется от 0 до 14,0.
Нейтральная среда
кислая среда | щелочная среда
Так, часто используемые в химической практике растворы кислот, оснований и солей имеют следующие значения pH (табл. 8).
Таблица 8
Окончание табл. 8
Биологические жидкости:
Для определения среды раствора используют кислотно-основные Индикаторы. В практике школьных лабораторий широко используют фенолфталеин, лакмус и метиловый оранжевый, реже — так называемый универсальный индикатор. Упрощённо считают, что индикаторы принимают следующую окраску в зависимости от среды раствора (табл. 9).
Таблица 9
Кислая среда
Щелочная среда

Условность таблицы 9 в том, что каждый индикатор изменяет окраску не в одной определённой точке, а в некотором интервале значений pH. Так, метиловый оранжевый начинает изменять красную окраску при значении pH чуть более 3,0. При pH около 4,5 окраска метилоранжа уже полностью жёлтая. В интервале pH от 3,0 до 4,5 окраска метилоранжа оранжевая — промежуточная между красной и жёлтой.
Аналогично и другие индикаторы имеют свою область перехода окраски от одной к другой. Ниже приведены значения pH, при которых указанные индикаторы изменяют свою окраску (рис. 41).

3,0 4,0 5,0 6,0 7,0 8,0 9,0 pH
Рис. 41
Из этого рисунка видно, что, например, фенолфталеин имеет отчётливую малиновую окраску только в умеренно щелочной среде при pH > 9,5. В слабощелочной среде фенолфталеин остаётся бесцветным. Легко сообразить, что если метилоранж в каком-либо растворе принял жёлтую окраску, а лакмус ещё розовый, то величина pH раствора около 5,0.
Если лакмус уже синий, а фенолфталеин ещё практически бесцветен, то pH раствора около 8,0. Чтобы избежать таких сложностей при определении pH, используют универсальный индикатор, который плавно меняет окраску на протяжении всей шкалы pH. Поэтому по универсальному индикатору можно определить не только среду раствора (кислую, нейтральную или щелочную), но и оценить примерное значение pH. Цветовая шкала окраски универсального индикатора со значениями pH нанесена на каждой коробочке с индикатором. Для определения pH стеклянной палочкой наносят каплю исследуемого раствора на полоску универсальной индикаторной бумаги и сравнивают полученную окраску со стандартной шкалой.
Качественные реакции на ионы в растворе
Качественными Называют реакции, с помощью которых можно обнаружить данный ион (или вещество) в анализируемом растворе. Качественная реакция должна обязательно сопровождаться каким-либо эффектом — выпадением осадка, выделением газа, изменением цвета раствора. Программа 9 класса предусматривает знакомство с качественными реакциями на хлорид-, сульфат — и карбонат-ионы.
Определение хлорид-иона. Качественным реактивом на хлорид-ионы являются ионы серебра, при взаимодействии которых друг с другом выпадает белый творожистый осадок хлорида серебра:
Осадок хлорида серебра не расторяется в минеральных кислотах, но растворяется в концентрированном растворе аммиака за счёт образования аммиачного комплекса.
Определение сульфат-иона. Качественным реактивом на сульфат-ионы являются ионы бария, образующие с сульфат-ионами нерастворимый в воде и минеральных кислотах белый мелкокристаллический осадок:
Ba2+ + SO.2 → BaSO4I 4 4*
Указание на «нерастворимость в кислотах» очень важно. Так, ионы бария образуют белые осадки и с карбонат-ионами, и с фосфат-ионами, но оба осадка — и BaCO3, и Ba3(PO4)2— растворяются в сильных минеральных кислотах (азотной, соляной).
Определение карбонат-ионов. Качественными реакциями на карбонат-ионы могут быть реакции с кислотами или с ионами кальция. В первом случае выделяется бесцветный газ, во втором случае — белый осадок, растворимый в кислотах:
2H+ + C0∣- → H2O + C02↑
Ca2+ + СО2’ → CaCO3I
Часть 1
К каждому из заданий части 1 даны 4 варианта ответа, из которых только один правильный.
1. Различить растворы соляной и серной кислот можно, если добавить к ним раствор
1) лакмуса 3) фенолфталеина
2) нитрата бария 4) гидроксида калия
2. Ученик обнаружил на кухне две одинаковые банки. В одной из них находится поваренная соль (NaCl), а в другой — питьевая сода (NaHCO3). Каким из предложенных способов ему следует воспользоваться, чтобы распознать содержимое банок?
1) исследовать запахи веществ
2) растворить вещества в воде
3) добавить в вещества раствор уксусной кислоты
4) добавить в вещества раствор иода
3. C помощью соляной кислоты можно распознать
1) карбонат натрия 3) сульфат бария
2) хлорид натрия 4) нитрат магния
4. C помощью раствора серной кислоты можно определить наличие в растворе ионов
1) хлора 3) бария
2) натрия 4) цинка
5. Для обнаружения в растворе хлорид-ионов используют раствор, содержащий ионы
1) меди(П) 3) серебра
2) бария 4) алюминия
6. Чтобы на кухне отличить питьевую соду от поваренной соли, необходимо
1) растворить вещества в воде
2) добавить к каждому веществу нашатырный спирт 3) добавить к каждому веществу несколько капель мыльного раствора
4) прилить к каждому веществу уксус
7. Наличие в растворе ионов серебра можно установить в результате реакции с
1) NaNO3 2) BaCl2 3) FeCO3 4) CuSO4
8. Наличие ионов бария в растворе можно доказать с помощью раствора
1) Na2SO4 2) KNO3 3) NaOH 4) HCl
9. Различить серную и соляную кислоту можно, если
1) поместить в них кусочек цинка
2) добавить раствор фенолфталеина
3) добавить раствор метилоранжа
4) прилить раствор нитрата бария
10. Наличие в растворе карбонат-ионов можно установить в результате реакции с
1) соляной кислотой
2) хлоридом калия
4) фосфатом натрия
11. Различить растворы гидроксида кальция и гидроксида калия можно, если
1) добавить раствор фенолфталеина
2) подействовать раствором хлорида меди(П)
3) добавить соляную кислоту
4) пропустить через них углекислый газ
12. При добавлении в раствор кислоты раствора соли выделяется газ, окрашивающий влажную синюю лакмусовую бумагу в красный цвет. Процессу образования газа соответствует левая часть краткого ионного уравнения:
1) Na0 + 2H+ = 3) 2H+ + S2- =
2) NH’ + ОН” = 4) 2H+ + SiO∣ =
13. При добавлении соляной кислоты к порошку соли белого цвета выделяется газ, от которого известковая вода мутнеет. Образованию газа соответствует левая часть краткого ионного уравнения:
1) 2H^ + H2O = 3) NH1 + ОН»=
2) Ag+ + СГ = 4) 2H+ + СО2-=
14. Фенолфталеин останется бесцветным в растворе
1) едкого натра 3) гидроксида калия
2) серной кислоты 4) Извести
15. Выделение газа наблюдается при сливании растворов
1) сульфата натрия и гидроксида бария
2) гидроксида натрия и соляной кислоты
3) карбоната калия и азотной кислоты
4) гидроксида меди(П) и азотной кислоты
16. Выпадение осадка наблюдается при сливании растворов
1) хлорида алюминия и гидроксида кальция
2) сульфата натрия и соляной кислоты
3) карбоната калия и азотной кислоты
4) гидроксида натрия и серной кислоты
17. Лакмус окрасится в красный цвет в растворе
1) гидроксида натрия 3) спирта
2) поваренной соли 4) Азотной кислоты
18. Лакмус окрасится в синий цвет в растворе
1) гидроксида натрия 3) спирта
2) поваренной соли 4) азотной кислоты
19. Фенолфталеин окрасится в малиновый цвет в растворе
1) гидроксида натрия 3) спирта
2) серной кислоты 4) азотной кислоты
При выполнении заданий выберите правильные ответы.
20. Осадок выпадает при добавлении раствора серной кислоты к раствору
1) карбоната калия
2) нитрата меди(П)
3) гидроксида бария
4) хлорида кальция
5) нитрата свинца(П)
6) гидроксида натрия Ответ: .
21. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества. К каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
Источник: apple-tour.ru
Ионы серебра можно обнаружить в растворе с помощью соляной кислоты
Тысячи правильных ответов на различные тесты
Тысячи проверенных ответов
Вопрос теста:
Действием раствора соляной кислоты можно обнаружить в растворе ионы …
Выберите один ответ:
Показать ответ