Для уравнивания химической реакции, введите уравнение реакции и нажмите кнопку Уравнять. Решенное уравнение появится сверху.
- Используйте заглавные символы для начального знака элемента и строчные символы для второго знака. Примеры: Fe, Au, Co, Br, C, O, N, F.
- Ионные заряды пока не поддерживаются и не будут приняты в расчет.
- Переместите неизменные группы в соединениях, чтобы не допустить неопределенность. Например, C6H5C2H5 + O2 = C6H5OH + CO2 + H2O не уравняется, но XC2H5 + O2 = XOH + CO2 + H2O уравняется.
- Промежуточные расстояния [такие, как (s) (aq) или (g)] не требуются.
- Вы можете использовать круглые () и квадратные скобки [].
Примеры
- Ag2HPO4 + HNO3 = Ag2NO3 + H2PO4
- Ag2HPO4 + HNO3 = AgNO3 + H3PO4
- Ag2HPO4 + HNO3 = AgNO3 + HPO3 + H2O
- Ag2HPO4 + NH3 = Ag2PO4 + NH4
- Ag2HPO4 = Ag + HPO4
- Ag3PO4 + H3PO4 = AgH2PO4
- Sn + AgNO3 = Sn(NO3)2 + Ag
- C6H5Cl + CH3Cl + AlCl3 = C6H5 + HCl + AlCl3
- HF + Al = AlF3 + H2
- NI(No3)2 + Na2Co3 = NICo3 + NaNo3
- KTe = K + Te
- (CH3COO)2Cr + H2SO4 = Cr2(SO4)3 + CH3COOH + H2O + SO2
Калькуляторы
Химическое уравнение
получение нерастворимого фосфата серебра
- Программа решения химических уравнений
- Калькулятор стехиометрических реакций
- Калькулятор Лимитирующего реагента
- Ionic Equation Calculator
- окислительно-восстановительные реакции
Источник: www.chemicalaid.com
Химия кислоты с фосфором
Метафосфорная кислота — одноосновная кислота, простейшая формула которой HPO3; действительный же состав её молекул выражается формулой (HPO3)n, где n = 3,4,5 и т. д. В чистом виде представляет собой стекловидную массу, легко растворимую в воде.
- Получают взаимодействием оксида фосфора(V) c водой:
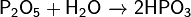 Физико-химические свойства Метафосфорная кислота представляет собой белое стеклообразное вещество, хорошо растворимое в воде и, присоединяя её, постепенно переходит в ортофосфорную кислоту:
Физико-химические свойства Метафосфорная кислота представляет собой белое стеклообразное вещество, хорошо растворимое в воде и, присоединяя её, постепенно переходит в ортофосфорную кислоту: 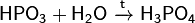
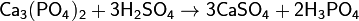 Можно получить гидролизом пентахлорида фосфора:
Можно получить гидролизом пентахлорида фосфора:  Или взаимодействием с водой оксида фосфора(V), полученного сжиганием фосфора в кислороде:
Или взаимодействием с водой оксида фосфора(V), полученного сжиганием фосфора в кислороде: 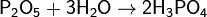 С водой реакция идет очень бурно, поэтому оксид фосфора(V) обрабатывают нагретым до 200 °C концентрированным раствором ортофосфорной кислоты. Расплавленная ортофосфорная кислота и её концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей. H3PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]ClO4. Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:
С водой реакция идет очень бурно, поэтому оксид фосфора(V) обрабатывают нагретым до 200 °C концентрированным раствором ортофосфорной кислоты. Расплавленная ортофосфорная кислота и её концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей. H3PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]ClO4. Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:  Качественной реакцией на ион РО4 3− является образование ярко-жёлтого осадка молибденофосфата аммония:
Качественной реакцией на ион РО4 3− является образование ярко-жёлтого осадка молибденофосфата аммония: 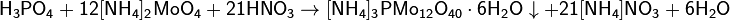 Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.  (дигидрофосфат натрия)
(дигидрофосфат натрия)  (гидрофосфат натрия)
(гидрофосфат натрия)  (фосфат натрия) Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную. Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
(фосфат натрия) Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную. Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям: 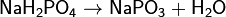
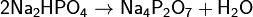 Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (NH4)3PO4. Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты. Применение: Используется при пайке в качестве флюса (по окисленной меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшуюкоррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество. В составе гидрожидкостей НГЖ-5У и ее иностранных аналогов. Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках. В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни. Ортофосфорная кислота применяется для протравливания (снятия смазанного слоя) эмали и дентина перед пломбированием зубов. При применении адгезивных материалов 2 и 3 поколения требуется протравливание эмали зуба кислотой, с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение данные этапы несут в себе опасность возникновения различных ошибок и осложнений. При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесенный адгезив не полностью (по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя. Кроме того, не всегда удается полностью удалить ортофосфорную кислоту после её нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность бондинга, а также приводят к образованию так называемой «кислотной мины». С появлением адгезивных материалов 4 и 5 поколения стали использовать технику тотального протравливания (дентин — эмаль). В адгезивных системах 6 и 7 поколения отдельный этап протравливания кислотой отсутвует. Так адгезивы являются самопротравливающимися. Хотя некоторые производители все же рекомендуют для усиления адгезии кратковременно протравливать эмаль и при использовании самопротравливащих адгезивов. H4P2O7Дифосфорная кислота — неорганическое соединение, четырёхосновная кислородсодержащая кислота с формулой H4P2O7, бесцветные кристаллы, растворимые в воде, образует кристаллогидраты. Получение: Растворение оксида фосфора в воде:
Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (NH4)3PO4. Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты. Применение: Используется при пайке в качестве флюса (по окисленной меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшуюкоррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество. В составе гидрожидкостей НГЖ-5У и ее иностранных аналогов. Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках. В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни. Ортофосфорная кислота применяется для протравливания (снятия смазанного слоя) эмали и дентина перед пломбированием зубов. При применении адгезивных материалов 2 и 3 поколения требуется протравливание эмали зуба кислотой, с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение данные этапы несут в себе опасность возникновения различных ошибок и осложнений. При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесенный адгезив не полностью (по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя. Кроме того, не всегда удается полностью удалить ортофосфорную кислоту после её нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность бондинга, а также приводят к образованию так называемой «кислотной мины». С появлением адгезивных материалов 4 и 5 поколения стали использовать технику тотального протравливания (дентин — эмаль). В адгезивных системах 6 и 7 поколения отдельный этап протравливания кислотой отсутвует. Так адгезивы являются самопротравливающимися. Хотя некоторые производители все же рекомендуют для усиления адгезии кратковременно протравливать эмаль и при использовании самопротравливащих адгезивов. H4P2O7Дифосфорная кислота — неорганическое соединение, четырёхосновная кислородсодержащая кислота с формулой H4P2O7, бесцветные кристаллы, растворимые в воде, образует кристаллогидраты. Получение: Растворение оксида фосфора в воде: 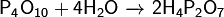 Нагревание ортофосфорной кислоты:
Нагревание ортофосфорной кислоты: 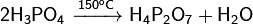 Реакция ортофосфорной кислоты с оксидом фосфора:
Реакция ортофосфорной кислоты с оксидом фосфора: 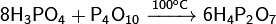 Физические свойства: Дифосфорная кислота — белое аморфное или кристаллическое вещество, очень гигроскопично. Существует в двух кристаллических модификациях с температурами плавления 54,3 и 71,5°С, смесь плавится при 61°С. Хорошо растворяется в воде, этаноле, эфире. Является четырёхосновной кислотой с константами диссоциации p K1 = 1, p K2 = 2, p K3 = 6,6, p K4 = 9,6. Образует кристаллогидраты вида H4P2O7•n H2O, где n = 1, 5 и 6 Химические свойства: При нагревании в вакууме разлагается:
Физические свойства: Дифосфорная кислота — белое аморфное или кристаллическое вещество, очень гигроскопично. Существует в двух кристаллических модификациях с температурами плавления 54,3 и 71,5°С, смесь плавится при 61°С. Хорошо растворяется в воде, этаноле, эфире. Является четырёхосновной кислотой с константами диссоциации p K1 = 1, p K2 = 2, p K3 = 6,6, p K4 = 9,6. Образует кристаллогидраты вида H4P2O7•n H2O, где n = 1, 5 и 6 Химические свойства: При нагревании в вакууме разлагается: 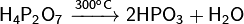 При кипячении водных растворов переходит в ортофосфорную кислоту:
При кипячении водных растворов переходит в ортофосфорную кислоту: 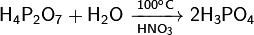 Реагирует с щелочами с образованием нормальных или кислых солей:
Реагирует с щелочами с образованием нормальных или кислых солей: 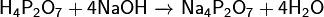
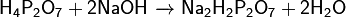 Вступает в обменные реакции:
Вступает в обменные реакции: 
Получение фосфата и йодида серебра
Источник: studfile.net
Презентация, доклад по химии к уроку в 9 классе по теме Оксид фосфора (V), фосфорная кислота, её соли
Слайд 1Где расположен фосфор в периодической таблице химических элементов Д. И. Менделеева?
Сколько
энергетических уровней у атома фосфора?
Сколько электронов на внешнем энергетическом уровне находится у атома фосфора?
Заряд ядра атома фосфора?
Назовите высшую и низшую степени окисления фосфора?
В виде каких аллотропных модификаций встречается фосфор?
Чем отличается белый фосфор от красного?
Какие свойства фосфор проявляет в реакциях?
Где применяется фосфор?
Подумай и ответь на вопросы:

Слайд 2P2O5
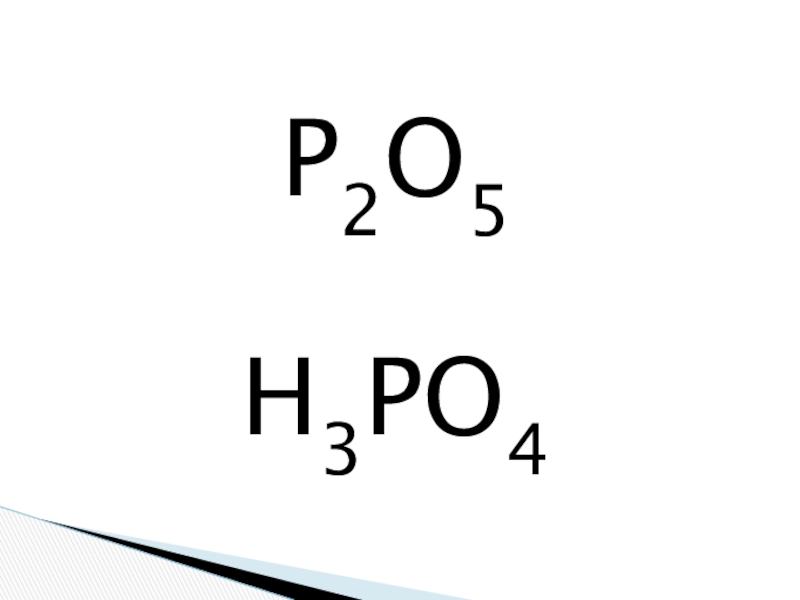
Слайд 3Оксид фосфора (V). Фосфорная кислота и ее соли

Слайд 4 Белый, рыхлый гигроскопичный порошок. Оксид фосфора(V) P2O5 образуется при горении
фосфора на воздухе:
4Р + 5О2 2Р2О5

Слайд 5Химические свойства оксида фосфора (V):
P2O5 – типичный кислотный оксид.
1) При взаимодействии
с водой образует на холоде метафосфорную кислоту НРО3:
P2O5 + H2O 2HPO3
при нагревании — ортофосфорную кислоту Н3РО4:
P2O5 + 3H2O 2H3PO4
2) Как кислотный оксид, вступает в реакции с основными оксидами:
P2O5 + 3CaO → Ca3(PO4)2
3) Реагирует со щелочами:
P2O5 +3Ca(OH)2 → Ca3(PO4)2 + 3H2O

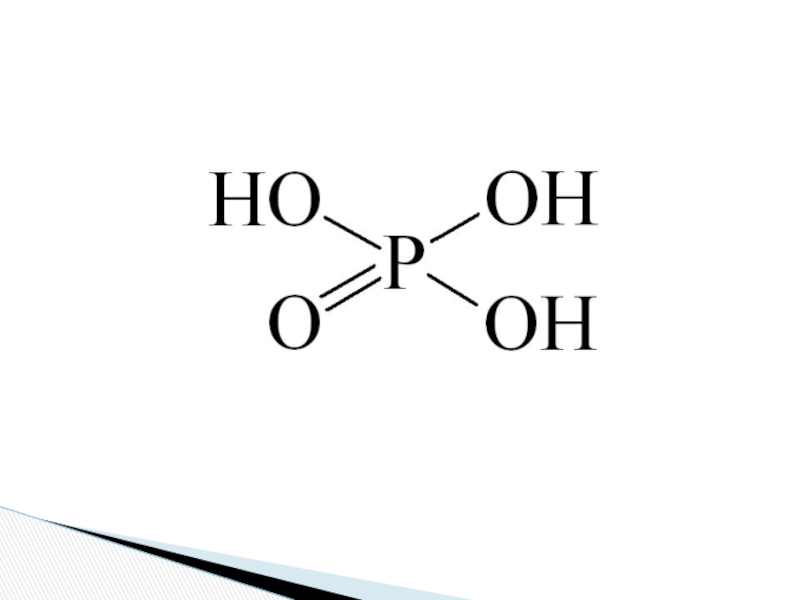
Слайд 6 H3PO4 — бесцветное твердое кристаллическое вещество. Температура плавления +42ºС, хорошо
растворяется в воде.
Фосфорная кислота — H3PO4

Слайд 7
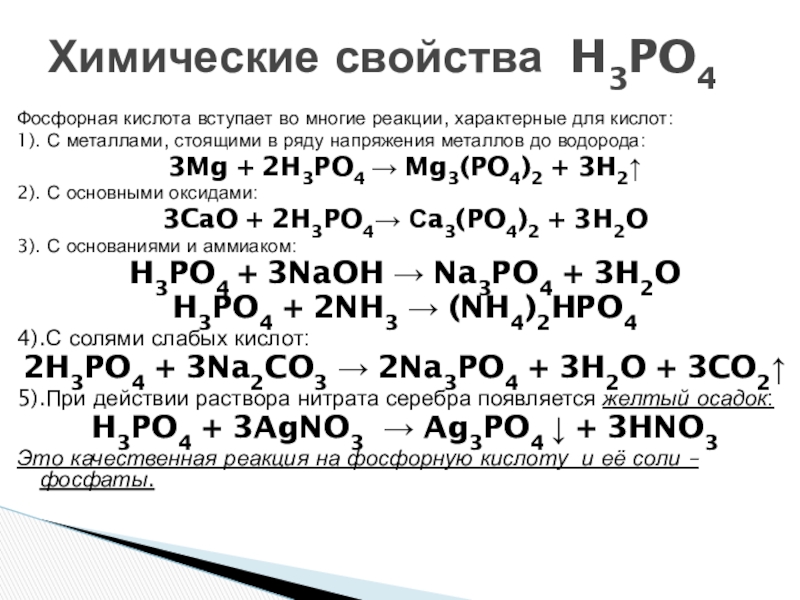
Слайд 8Химические свойства H3PO4
Фосфорная кислота вступает во многие реакции, характерные для кислот:
1). С металлами, стоящими в ряду напряжения металлов до водорода:
3Mg + 2H3PO4 Mg3(PO4)2 + 3H2↑
2). С основными оксидами:
3CaO + 2H3PO4 Сa3(PO4)2 + 3H2O
3). С основаниями и аммиаком:
H3PO4 + 3NaOH → Na3PO4 + 3H2O
H3PO4 + 2NH3 → (NH4)2HPO4
4).С солями слабых кислот:
2H3PO4 + 3Na2CO3 → 2Na3PO4 + 3H2O + 3CO2↑
5).При действии раствора нитрата серебра появляется желтый осадок:
H3PO4 + 3AgNO3 → Ag3PO4 ↓ + 3HNO3
Это качественная реакция на фосфорную кислоту и её соли – фосфаты.
Слайд 9Фосфорную кислоту используют:
в производстве фосфорных удобрений;
в производстве кормовых добавок для животноводства;
в
производстве моющих средств (фосфаты щелочных металлов);
для создания защитных покрытий на металлах.
Источник: shareslide.ru