Алюминий – металл с уникальными свойствами, которые применяются повсеместно. Он легкий, прочный, пластичный. Устойчив к разрушениям от воды, ветра, времени. Не магнитится, хорошо проводит ток. Его можно переплавлять бесконечное количество раз, изготавливая новые материалы.
История открытия
В 1808 году английский ученый-химик выдвинул теорию, что для получения алюминия (от латинского alumen –«квасцы») необходимо применить метод электролиза глинозема. Но сделать это удалось только спустя 17 лет.
Датский химик с помощью хлора, угля, глинозема создал нечистый металл, но он прекратил эксперименты. Их решил продолжить немецкий ученый, который спустя 2 года обнаружил алюминий в виде порошка. А после 18 лет изучений получил шарики из этого металла.

В 1856 году метод усовершенствовали, открыли первый алюминиевый завод. За 35 лет работы химическим способом изготовили около 200 тонн металла. Он был похож на серебро, но легкий по весу. Из-за трудностей добычи алюминий стал дорогим, элитным. Из него делали:
Про алюминий интересно
- ювелирные украшения;
- медали;
- статуэтки;
- другие предметы декора.
В 1886 году французский инженер с помощью постоянного электрического тока получил чистый алюминий. Это был простой, дешевый способ, требующий только электричества. Заводы, где применяли этот метод, строили вблизи воды и ГЭС. Благодаря этому материал получил широкое применение в промышленности.

Алюминий в таблице Менделеева
Элемент находится в III группе, главной подгруппе А третьего периода таблицы Д. И. Менделеева. Обозначается латинскими буквами Al. Порядковый номер 13, атомная масса алюминия равна 26,98. Степень окисления +3.
Рядом с ним располагаются:
- металл магний;
- неметалл кремний.
В природе нет изотопов алюминия.
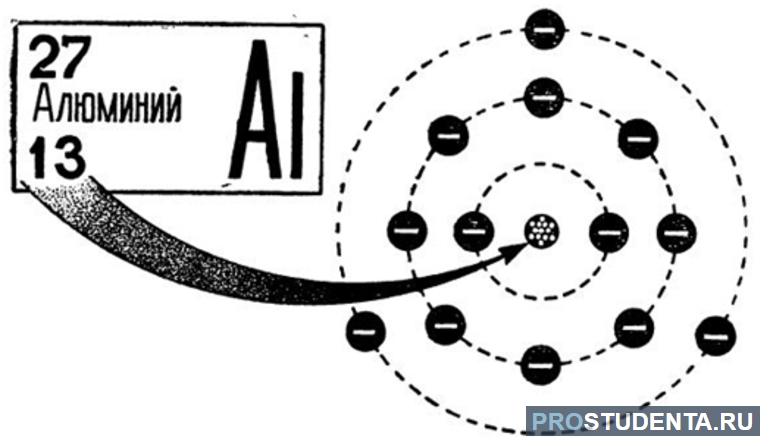
Строение атома алюминия
Электронная формула алюминия представлена на рисунке ниже.

Атом состоит из заряженного ядра, в котором 13 протонов и 14 нейтронов. Ядро окружают 3 оболочки, по которым распространяются 13 электронов. Валентных электронов – 3.
Физические свойства
Представляет собой серебристо-белый металл. Температура плавления алюминия 660°С.

Элемент имеет следующие основные физические свойства:
- высокую пластичность;
- малую прочность;
- низкое сопротивление электричеству;
- хорошую теплопроводность;
- низкую плотность;
- хорошую способность отражать свет;
- устойчивость к низким температурам.
Именно благодаря этим свойствам он применяется как в чистом виде, так и в составе разных сплавов. На воздухе быстро окисляется, покрывается оксидной пленкой, поэтому устойчив к коррозии.
Химические свойства
Они определяются способностью вещества вступать в реакции, образовывать соединения алюминия:
- при нагревании активно взаимодействует с серой, образует сульфид алюминия;
- при высоких температурах с азотом – нитрид алюминия;
- с фосфором – фосфид алюминия;
- с углеродом – карбид алюминия;
- с кислотами – образуются соли;
- при взаимодействии с солью ртути образуется амальгама;
- при комнатной температуре взаимодействует с галогенами, получаются галогениды.
Если смешать порошок алюминия с пероксидом натрия, добавить воды, смесь будет гореть белым пламенем. Он является хорошим восстановителем, при помощи реакции алюмотермии получают некоторые другие металлы, например ванадий и вольфрам.

Сплавы обладают уникальными свойствами:
- с марганцем – прочный, пластичный, не поддающийся негативным воздействиям природы материал;
- с магнием – гибкий, необычайно прочный, устойчивый к коррозии, вибрациям;
- с медью – высокотехнологичный материал, легкий, гибкий, но поддающийся разрушениям от воды.
Алюминий в природе
Есть в некоторых горных породах, рудах, минералах, но добыть его именно в природе можно только из бокситов. Их месторождения находятся в:
- Бразилии;
- Гвинее;
- Ямайке;
- Австралии.
Всего насчитывается около 300 минералов, в состав которых входит этот металл.

Морские обитатели способны накапливать его внутри себя в небольших количествах. Он достаточно токсичен, негативно влияет на нервную систему живых организмов.
Соединения алюминия были также найдены на Луне, Марсе.
[advice]Где и какими полезными ископаемыми богата Россия? Ответ в нашей статье по ссылке.[/advice]
Применение
Благодаря химическим, физическим свойствам этот элемент широко применяется в различных областях. Хорошо обрабатывается, поддается литью, ковке, можно спрессовать, штамповать.
- В электрической промышленности – для изготовления проводов.
- В авиации, машиностроении используют сплавы с медью, магнием, железом, кремнием и т. д. Такие соединения имеют высокую прочность и легкость одновременно. Они устойчивы к морозам, повышенным температурам. Из них делают винты для самолетов, запчасти для машин, вертолетов. Благодаря высокой стойкости к коррозии применяют при кораблестроении.
- В ракетостроении сам металл и его соединения применяют при строительстве шаттлов, реакторов. Используют для горения ракетного топлива.
- В железнодорожной сфере – при строительстве рельс, их сварке.
- При производстве военной техники (танков, самолетов артиллерийских установок и других) применяют сплавы. В ядерной энергетике, радиолокации их используют при конструировании деталей.
- В металлургической сфере из него получают хром, марганец, кальций. Применяют для сварки деталей, раскисания сталей.
- В пищевой промышленности используют для хранения продуктов (кухонные принадлежности, фольга и другие варианты). При контакте еда не теряет витаминов, других полезных свойств.
- В текстильном деле сульфат алюминия нужен для окрашивания тканей, различные его соединения применяют для получения синтетического каучука.
- В строительной промышленности востребован при изготовлении оконных рам, дверей, различных запчастей конструкций, каркасов.
- При добыче, переработке нефти сплавы используют при конструировании бурильных установок, нефтепроводных труб, для изготовления контейнеров, в которых хранится, перевозится нефть.
- Из соединений делают ювелирные изделия (в том числе искусственные камни) и бижутерию, лазерные, абразивные материалы, запчасти для часов, адсорбенты, применяемые при очищении жидкостей и газов.
- В туристической и армейской сферах производят столовые приборы, походную утварь (ложки, вилки, кружки, котелки и другие).
- Напыления применяют для повышения прочности поверхностей, устойчивости к коррозии, защиты от воздействия различных химических веществ.
Он активно применяется при приборостроении для конструирования:
- фото-, киноаппаратуры;
- радио;
- телефонов.
Чистый материал содержится в зеркалах, светоотражательных, осветительных приборах. При производстве стекла применяются алюминиевые соли.
В фармацевтике используют при лечении:
- язв;
- раздражения желудка;
- диспепсии.
Гидроксид алюминия – основной компонент медицинских препаратов, которые снижают кислотность желудка. Сульфат алюминия является хорошим коагулянтом, это химическое свойство применяется при очищении воды от бактерий.
В косметологии – дезодоранты и антиперспиранты содержат в себе соединения этого продукта. В емкостях, сделанных из него, транспортируют жидкие газы, кислоты (азотную и уксусную), перекись водорода и другие вещества. В сельском хозяйстве делают ангары для хранения зерна и других продуктов.
Горючие и взрывчатые средства содержат в составе алюмотол – смесь с алюминиевым порошком.
Алюминий легко поддается переработке. Собранный из него лом сортируется, прессуется, сушится, переплавляется.
Необычный и легкий материал широко используется во всех сферах деятельности человека. Он удобный и обладает уникальными свойствами, благодаря которым его применяют в быту и промышленности.
А что вы знаете об этом химическом элементе? Сохраните страницу в закладки, поделитесь статьей с друзьями в социальных сетях.
Предлагаем ознакомиться с несколькими
Источник: uchim.guru
Алюминий
Алюминий вошел в промышленное и бытовое применение относительно не так давно. На пересечении XIX – XX было освоено производство этого металла в промышленных масштабах.


Все дело в том, что началось производство множества товаров, в которых алюминий широко применялся, например, при строительстве катеров, железнодорожных вагонов и пр. Кстати, именно тогда был показан широкой публике автомобиль с кузовом, выполненным из алюминия.
Состав и структура алюминия

Алюминий – это самый распространенный в земной коре металл. Его относят к легким металлам. Он обладает небольшой плотностью и массой. Кроме того, у него довольно низкая температура плавления. В то же время он обладает высокой пластичностью и показывает хорошие тепло- и электропроводные характеристики. Предел прочности чистого алюминия составляет всего 90 МПа.
Но, если в расплав добавить некоторые вещества, например, медь и ряд других, то предел прочности резко вырастает до 700 МПа. Такого же результат можно достичь, применяя термическую обработку. Алюминий, обладающий предельно высокой чистотой – 99,99% производят для использования в лабораторных целях. Для применения в промышленности применяют технически чистый алюминий.
При получении алюминиевых сплавов применяют такие добавки, как – железо и кремний. Они не растворяются в расплаве алюминия, а из добавка снижает пластичность основного материала, но в то же время повышает его прочность.
Структура этого металла состоит из простейших ячеек, состоящих из четырех атомов. Такую структуру называют гранецентрической.
Проведенные расчеты показывают, что плотность чистого металла составляет 2,7 кг на метр кубический.
Свойства и характеристики
Алюминий – это металл с серебристо-белой поверхности. Как уже отмечалось, его плотность составляет 2,7 кг/м 3 . Температура составляет 660°C. Его электропроводность равняется 65% от меди и ее сплавов. Алюминий и бо́льшая часть сплавов из него стойко воспринимает воздействие коррозии. Это связано с тем, что на его поверхности образуется оксидная пленка, которая и защищает основной материал от воздействия атмосферного воздуха.
В необработанном состоянии его прочность равна 60 МПа, но после добавления определенных добавок она вырастает до 700 МПа. Твердость в этом состоянии достигает 250 по НВ. Алюминий хорошо обрабатывается давлением. Для удаления наклепа и восстановления пластичности после обработки алюминиевые детали подвергают отжигу, при этом температура должна лежать в пределах 350 °C.
Температура плавления алюминия
Получение алюминиевого расплава, как и многих других материалов, происходит после того, как к исходному металлу подвели тепловую энергию. Она может быть подведена как непосредственно в него, так и снаружи. Температура плавления алюминия напрямую зависит от уровня его чистоты:
- Сверхчистый алюминий плавится при температуре 660, 3 °C.
- При количестве алюминия 99,5% температура плавления составляет 657 °C.
- При содержании этого металла в 99% расплав можно получить при 643 °C.
Алюминиевый сплав может включать в свой состав различные вещества, в том числе и легирующие. Их наличие приводит к снижению температуры плавления. Например, при наличии большого количества кремния, температура может понизиться до 500 °C. На самом деле понятие температуры плавления относят к чистым металлам. Сплавы не обладают какой-то постоянной температурой плавления.
Этот процесс происходит в определенном диапазоне нагрева.
В материаловедении существует понятие – температура солидус и ликвидус.
Первая температура обозначает ту точку, в которой начинается плавление алюминия, а вторая, показывает, при какой температуре, сплав будет окончательно расплавлен. В промежутке между ними сплав будет находиться в кашеобразном состоянии.
Уменьшение температуры
Перед тем как приступать к плавке металла, можно выполнить определенные операции, которые позволят снизить температуру плавления. Например, иногда расплаву подвергают алюминиевый порошок. В порошкообразном состоянии металл начинает плавиться несколько быстрее.
Но при такой обработке возникает реальная опасность того, что при взаимодействии с кислородом, который содержится в атмосфере алюминиевый порошок, начнет окисляться с большим выделением тепла и образования оксидов металла, этот процесс происходит при температуре 2300 градусов. Главное, в этот момент плавления не допустить контакта расплава и воды. Это приведет к взрыву.
Процесс плавления в домашних условиях

Относительно низкая температура плавления алюминия позволяет проводить эту операцию в домашних условия. Надо сразу отметить, что в качестве сырья в домашней мастерской использовать порошкообразную смесь слишком опасно. Поэтому в качестве сырья применяют или чушки, или нарезанную проволоку.
Если к будущему изделию нет особых требований по качеству, то для плавления можно использовать все, что изготовленного из этого металла. При этом не особо важно, будет сырье покрыто краской или нет. Когда происходит плавление алюминия, все посторонние вещества просто выгорят и будут удалены вместе со шлаком. Для получения качественного результата плавки необходимо использовать материалы, которые называют флюсами. Они призваны решать задачу по связыванию и удалению из расплава посторонних примесей и загрязнений.
Средства защиты

Домашний мастер, решивший в домашних условиях выполнять плавление алюминия должен отдавать себе отчет в том, что это довольно опасный процесс. И поэтому без применения средств защиты не обойтись. В частности, должны быть использованы перчатки, фартук, очки. Дело в том, что температура расплава лежит в пределах 600 градусов.
Поэтому имеет смысл использовать средства защиты, которые применяют сварщики. Кстати, при плавлении алюминия и использовании очищающих химикатов необходимо защищать органы дыхания от продуктов их сгорания.
Выбор формы для литья
При выборе формы для отливки алюминия домашний мастер должен понимать, а для какой цели он обрабатывает алюминий. Если будущая отливка будет предназначена для использования в качестве припоя, то использовать, какие-то специальные формы, нет необходимости. Для этого можно использовать металлический лист, на котором можно остудить расплавленный металл. Но если возникает необходимость получения даже простой детали, то мастер должен определиться с типом формы для литья.

Форму можно изготовить из гипса. Для этого, гипс в жидком состоянии заливают в обработанную маслом форму. После того, как начнет застывать, в него устанавливают литейную модель. Для того, чтобы в форму можно было залить расплавленный металл необходимо сформировать литник. Для этого в форму устанавливают цилиндрическую деталь. Формы бывают разъемные и нет.
Процесс изготовления разъемной формы усложняется тем, что модель будет находиться в двух полуформах. После застывания их разделяют, удаляют модель и соединяют снова. Форма готова к работе. Для получения качественных отливок целесообразно использовать металлические формы (кокили), но изготавливать их целесообразно только в заводских условиях.
Источник: sterbrust.tech
Конфигурация и формула строения атома алюминия
Первое место среди известных металлов, находящихся в земной коре, занимает тринадцатый элемент в периодической таблице Менделеева — алюминий. Строение атома позволяет элементу обладать высокой электропроводностью и пластичностью. До момента открытия промышленного способа создания вещества оно стоило дороже золота. Из-за высокой сопротивляемости коррозии и низкого веса металл нашёл широкое применение в строительстве, быту, электрике и даже фармацевтике.
Оглавление:
- Физические и химические свойства
- Характеристики элемента
- Электронная конфигурация
- Составление строения

Физические и химические свойства
Процесс получения алюминия несложен. Современный способ разработал американский учёный Чарльз Холл. Что интересно, немного позже этот метод использовал французский химик Поль Эру, незнакомый с исследованиями американца. Суть создания алюминия заключается в растворении оксидированного алюминия в растворе криолита. Затем в жидкость погружают графические электроды.
Недостаток метода заключается в больших затратах электроэнергии, поэтому активно он начал использоваться только в начале двадцатого века.

К полезным свойствам алюминия относят его небольшую плотность — она втрое меньше, чем у железа и меди. Материал характеризуется довольно хорошей прочностью, имеет коррозийную стойкость и неплохую теплопроводность. Из-за своих характеристик он нашёл широкое применение как технический материал.
Отсутствие вредных примесей для человеческого организма в веществе, податливость к штамповке и лёгкость позволили применять элемент при изготовлении промышленной и бытовой фольги, кухонной посуды.
В природе алюминий содержится только в минералах.
Его можно извлечь из следующих соединений:

- Гидроокисла — Al2O3 * H20. Бокситы представляют собой глиноподобную массу. Это одна из наиболее важных руд алюминия.
- Алюмосиликата калия и натрия — (Na, K) AlSiO4. Породообразующий материал (элеолит) с шестиугольной кристаллической системой.
- Квасцового камня — KAl3 (SO4)2 (OH)6. Алунит образовывается при воздействии сернокислых вод с силикатами, что создаёт окись алюминия.
- Корунда — Al2O3. Кристаллический глинозём с высокой твёрдостью.
- Силиката — Al2O3. Породообразующий материал, содержащий порядка 19% оксида алюминия в своём составе.
Кроме этого, элемент можно извлечь из каолина, известняка, магнезита. В химических реакция вещество проявляет себя как восстановитель. С галогенами при температуре 20−24 градуса по Цельсию он образовывает галогениды: 2Al + 3Cl2 = 2AlCl3. С другими веществами создаёт бинарные соединения. Например, Al + P = AlP, 4Al + 3C = Al4C3, 2Al+ 3F2 = 2AlF3.
При взаимодействии этих соединений с водой образуются гидроксиды и летучие водородные соединения.
С металлами формирует сплавы с интерметаллическими соединениями.
При взаимодействии с кислотами результатом реакции становятся соли. Очищенный алюминий от оксида вступает в активную реакцию с водой: 2Al + 6 H2O = 2 Al (OH)3 + 3H2.
Характеристики элемента
Алюминий — элемент семейства лёгких металлов, уступающий в распространённости только кислороду и кремнию. В периодической таблице он располагается на тринадцатом месте, имеет серебристо-белый цвет. Общепринятое химическое обозначение — Al (от латинского слова aluminium).
Вещество имеет следующие характеристики:
- Относительная атомная масса — 26,981538. Показывает, во сколько раз атом алюминия превышает вес атомной единицы массы, принятой равной 1,67 * 10 -27 килограммов.
- Атомный номер — 13. Обозначает число протонов в ядре вещества равное количеству электронов, вращающихся вокруг атома.
- Радиус атома — 143 пикнометра. Определяется расстоянием между ядром и самой удалённой орбитой элемента.
- Ковалентный радиус — 121 пикнометр. Расстояние между ядрами, формирующими ковалентную связь и делённое на 2.
- Электронная формула атома алюминия — 1s 2 2s 2 2p 6 3s 2 3p 1 . Число электронов в оболочках в соответствии с энергетическим состоянием.
- Фазовые температуры — при достижении 660 градусов по Цельсию происходит плавление, а при 2518 °C закипание.
- Способность атомов удерживать электроны (электроотрицательность) — 1,61 по Полингу.
- Степень окисления — 3,0. Находится по числу электронов, смещённых от или к атому.
- Плотность — 2,7 г/см 3 . Отношение массы алюминия к его объёму.
- Молярный объем = 10,0 см 3 /моль. Определяется отношением объёма вещества к количеству.
Впервые искусственно алюминий был создан в 1825 году. Получить его сумел датский учёный Эрстед. В ядре вещества содержится 13 протонов и больше на один нейтронов. Всего же массовое число равняется 27. Электроны располагаются на трех энергетических уровнях.
На первом размещены 2 электрона, на втором 8 (три пары), а на третьем 3. Такое положение соответствует записи: +13Al)2)8)3.
При этом если атом возбудить, то в этом состоянии все три элемента могут быть отданы, тем самым достигая степени окисления +3 или вызывать образование ковалентных связей. Отсюда следует, что валентность алюминия равняется трём. В природе вещество встречается в глине, слюде, корунде. Взаимодействует со многими элементами, а вот с водородом нет.
При соприкосновении с кислородом образует оксидную плёнку, препятствующую реакциям с водой и азотной и серной кислотой.
Электронная конфигурация
Алюминий можно найти в таблице Менделеева в третьей группе главной подгруппы. Распределение зарядов по орбитали описывается как 1s22s22p63s23p1. Алюминий в периодической таблице имеет тринадцатый номер, так как атом элемента состоит из тринадцати электронов. В электронной конфигурации сумма верхних индексов как раз и составляет это число: 2+2+6+2+1 =13.
Другими словами, верхние индексы показывают количество заряда, распределённого по слоям и орбиталям. Если изобразить схему строения электронной оболочки атома алюминия, можно отметить, что последним заполняемым слоем будет р-орбиталь. А это значит, что вещество принадлежит семейству р-элементов.
Алюминий расположился в третьем периоде. Это значит, что у него 3 электронных слоя. На первом находится s-орбиталь, 3 орбитали расположились на p-слое, и 5 на d-орбитали. На 3d-орбитали пусто, на неё электронов не хватило. На каждом слое не может быть более двух электронов.
Заполняются же орбиты, начиная со слоев с меньшей энергией. Теоретически существует возможность возбужденного состояния для атома элемента за счет существования свободной 3d-орбитали. Однако распаривания ионов 3s-подуровня на практике не происходит.
Сначала электроны размещаются в первом слое, потом во втором, а уже затем в третьем. Орбитали каждого слоя заполняются с использованием принципа меньшей энергии. Так, сначала закрывается s-орбиталь, затем каждой орбитали достаётся по одному электрону, а затем по второму. Если их хватает, заполняются оставшиеся внешние р-орбитали.
В атоме алюминия полностью заполняются орбитали первых двух электронных слоев. На первом размещается 2 электрона, а на втором 8 носителей заряда. Два размещаются на s-орбиталь и по 2 на 3 р-орбитали. На третий слой переместятся 3 электрона: 13 — 8 — 2 = 3.
В соответствии с законом сначала до предела зарядами заполняется s-орбиталь третьего слоя, а на три р-орбитали хватает только 4 электрона. Из них 3 элементарные частицы занимают свою орбиталь, а после одна из р-орбиталей приобретает парный электрон.
Составление строения
На уроках химии в седьмом классе ученикам показывают, как графически изображают электронные формулы различных элементов. При составлении конфигураций учитывают правила Паули и Клечковского (Хунда). Модель записывается для атомов, находящихся в возбуждённом состоянии. При составлении учитывают, что порядковый номер периода элемента определяет количество энергетических оболочек, а порядок — число носителей заряда.
Беря во внимание, что согласно правилу Клечковского, энергетические уровни заполняются в соответствии с порядком возрастания главного и орбитального квантового числа, используют формулу n + 1. Так, действует следующее правило: 1 s < 2 s < 2 p < 3 s < 3 p < 4 s ≈ 3 d < 4 p < 5 s ≈ 4 d < 5 p < 6 s ≈ 5 d ≈ 4 f < 6 p. Перемещение атомов происходит согласно запретному принципу. Сформулировал его Паули. Он утверждал, что на одной орбитали могут разместиться только 2 иона, отличные квантовым числом спина.

Из его утверждения следует, что количество электронов на энергетических уровнях соответствует квадрату главного квантового числа, умноженному на 2. Форма обозначения подразумевает, что главное квантовое число обозначают арабской цифрой. Затем записывают букву, определяющую энергетический подуровень, характеризующий орбитальное квантовое число. Верхний индекс указывает на число электронов, формирующих подуровень.
При заполнении энергетических подуровней следует придерживаться правила Хунда. В соответствии с ним, частицы стремятся достигнуть наибольшего суммарного спина. Для валентных ионов алюминия электронно-графическая формула изображается с использованием квадратов и стрелок. Ячейки обозначают орбитали, а стрелки — спины. В одном квадрате не может быть больше двух электронов.
На первом уровне (s) для алюминия рисуют один квадрат с двумя стрелками. На втором (p) нужно изобразить 4 квадрата с заполненными стрелками.
На заполнение третьего уровня остаётся только 3 электрона, поэтому на последнем уровне (d), будет нарисовано только 2 квадрата, при этом во второй помещена только одна стрелка.
Источник: www.prostudenta.ru