Если вас заинтересовал вопрос о том, что такое графит, вы должны знать, что он представляет собой минерал, который является представителем класса самородных элементов. Это модификация углерода. Структура является слоистой. Расположение слоев в кристаллической решетке разное, это позволяет формировать политипы.
Графит хоть и был известен с давних времен, но определенных сведений об истории его использования не удается получить из-за сходств с другими материалами по типу молибденита. Материал проводит электрический ток. При сравнении с алмазом обладает незначительной твердостью и мягкостью. После воздействия внушительных температур становится тверже, но обретает хрупкость.
Основные свойства
Что такое графит? Если вы тоже задались этим вопросом, то должны знать о некоторых физических свойствах. Например, плотность может достигать 2,23 г/см³. Что касается цвета, то он является темно-серым с металлическим блеском. Структура неплавкая, она устойчива при отсутствии воздуха к нагреванию.
Графит и его прекрасные свойства | ElectroBOOM

На ощупь вещество скользкое и жирное. Природный графит содержит примеси глины в объеме 12% и окислы железа. В процессе трения происходит расслаивание на чешуйки, это свойство используется для производства карандашей. Что такое графит, вы не сможете узнать, если не ознакомитесь с основными характеристиками по типу теплопроводности.
Она достигает 354,1 Вт/(м*К), а минимальное значение равно 100. Конкретная цифра зависит от марки, температуры, а также направления по отношению к базисным плоскостям.
Электрическая проводимость анизотропна. Коэффициент теплового расширения может составить700 К. Теплоемкость варьируется от 300 до 3000К. Графит возгорается при 3500 °C, переходя в газообразное состояние, минуя жидкую фазу. Но если одновременно с повышением температуры давление увеличивается до 1000 атмосфер, можно получить расплавленный материал.
Кристаллическая решетка
Кристаллическая решетка графита состоит из атомов углерода. Ей присуща слоистая структура, а шаг между слоями равен 0,335 нм. Атомы связаны с тремя другими атомами углерода.

Решетка может быть двух типов:
- гексагональная;
- ромбоэдрическая.
В каждом слое атомы углерода находятся напротив центров шестиугольников в соседних слоях. Их положение повторяется через один. Каждый расположен со сдвигом в горизонтальном направлении на 0,1418 нм
Химические и механические свойства
Задаваясь вопросом о том, что такое графит, вы должны ознакомиться с основными свойствами. Материал химически инертен, он не растворяется в веществах, кроме расплавленных металлов. Это касается тех, у которых высокое плавление. При разбавлении образуются карбиды, самыми важными из которых выступают соединения:
- с бором;
- кальцием;
- железом;
- титаном;
- вольфрамом.
При обычных температурах соединить графит с другими веществами довольно трудно, но при воздействии внушительных температур происходит химическое соединение со многими элементами. Рассматривая свойства графита, вы выделите для себя еще и то, что материал не обладает эластичностью. Но его можно резать и изгибать. Проволока из него легко закручивается изгибается в спираль, а при вальцевании позволяет добиться 10-процентного удлинения.
ГИДРАВЛИЧЕСКИЙ ПРЕСС ПРЕВРАЩАЕТ ГРАФИТ В АЛМАЗ

При проверке проволоки на сопротивление на разрыв этот параметр составляет 2 кг/мм 2 , тогда как модуль изгиба эквивалентен 836 кг/мм 2 . Одними из важных свойств являются пластичность и жирность, которые позволили широко использовать материал в промышленности. С увеличением жирности уменьшается коэффициент трения. От этого зависит возможность использования в качестве смазочного материала. Сегодня применяется еще и способность прилипания графита к твердым поверхностям.
Оптические свойства
Среди свойств графита следует выделить еще и оптические. Коэффициент светопоглощения остается постоянным для всего спектра. На него не влияет температура лучеиспускания тела. Если рассматривать тонкие графитовые нити, то коэффициент светопоглощения будет равен 0,77. Этот параметр уменьшается до 0,55 с увеличением кристаллов графита.
Рассматривая чистый материал, вы отметите, что он обладает незначительным коэффициентом поглощения нейтронов и наивысшим коэффициентом замедления. Благодаря этому появилась возможность использования в атомных реакторах. Без графитовых электродов невозможно было бы развитие цветной и черной химической промышленности.

Основные виды
Формула графита выглядит следующим образом: С. Его молярная масса составляет 12 г/моль. Вещество является простым. Это минерал, неметалл, он представляет собой аллотропную модификацию углерода. Среди основных видов следует выделить:
- тигельный;
- литейный;
- аккумуляторный;
- элементный;
- для производства стержней;
- электроугольный;
- для изготовления смазок.
Первый используется для огнеупорных изделий, он отличается высокой теплопроводностью и устойчивостью к перепадам температур. Применение графита литейного кристаллического вида предусматривает использование материала при отливе деталей. Он имеет низкий коэффициент расширения и обладает прочностью при высоких температурах.

Аккумуляторная разновидность используется в качестве добавки, а также при производстве электродов. Среди основных характеристик – повышенные химические и технические свойства. При производстве стержней используется тонкодисперсный графит, который не содержит примесей железа. Для изготовления гальванических элементов применяется элементная разновидность, которая отличается высокой электро- и теплопроводностью. Серый графит применяется еще и для изготовления электропроводящей резины.
Искусственный графит
Формула графита вам известна, однако это не все, что следует знать, если вы занимаетесь изучением этого вещества. Например, сегодня производится искусственный графит, который может быть мелкозернистым, конструкционным, литейным или антифрикционным. Область использования достаточно широка.
Материал применяется при изготовлении электрических установок и машин, огнеупорных материалов, на производстве и в области горнодобывающей промышленности. Из искусственного графита изготавливаются краски, а также аккумуляторные батареи и покрытия. Незаменимо вещество в узконаправленных областях по типу ядерной промышленности.
В заключение
В последнее время интерес к описываемому минералу возрос. На основе его волокон изготавливаются материалы по типу углепластика, углеродных волокнистых сорбентов, композиционных материалов на основе углеродного волокна, а также углеродных волокнистых материалов. Особое внимание уделяется углепластику, который применяется в химической промышленности, а также машиностроении.
Источник: www.syl.ru
Графит как минерал

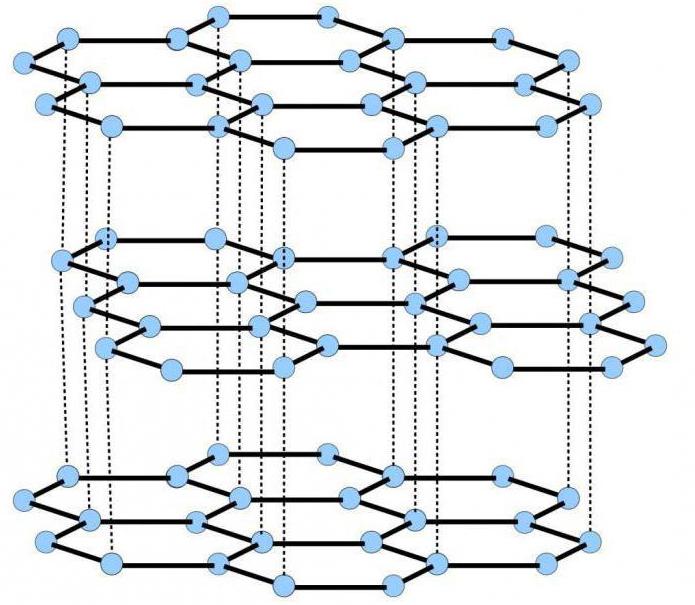
Графит (от др.-греч. γράφω — пишу) — минерал из класса самородных элементов, одна из аллотропных модификаций углерода. Структура слоистая.
Слои кристаллической решётки могут по-разному располагаться относительно друг друга, образуя целый ряд политипов, с симметрией от гексагональной сингонии (дигексагонально-дипирамидальный), до тригональной (дитригонально-скаленоэдрический). Слои слабоволнистые, почти плоские, состоят из шестиугольных слоёв атомов углерода. Кристаллы пластинчатые, чешуйчатые. Образует листоватые и округлые радиально-лучистые агрегаты, реже — агрегаты концентрически-зонального строения. У крупнокристаллических выделений часто треугольная штриховка на плоскостях (0001).
Схемы строения различных модификаций углерода
a: алмаз, b: графит, c: лонсдейлит
d: фуллерен — букибол C60, e: фуллерен C540, f: фуллерен C70
g: аморфный углерод, h: углеродная нанотрубка
1. Свойства
Хорошо проводит электрический ток. В отличие от алмаза обладает низкой твёрдостью (1—2 по шкале Мооса). Плотность 2,08—2,23 г/см³. Цвет тёмно-серый, блеск металлический. Неплавкий, устойчив при нагревании в отсутствие воздуха.
В кислотах не растворяется. Жирный (скользкий) на ощупь. Природный графит содержит 10—12 % примесей глин и окислов железа. При трении расслаивается на отдельные чешуйки (это свойство используется в карандашах).
Электрическая проводимость монокристаллов графита анизотропна, в направлении, параллельном базисной плоскости, близка к металлической, в перпендикулярном — в сотни раз меньше. Минимальное значение проводимости наблюдается в интервале 300-1300 К, причем положение минимума смещается в область низких температур для совершенных кристаллических структур. Наивысшую электрическую проводимость имеет рекристаллизованный графит.
Коэффициент теплового расширения графита до 700 К отрицателен в направлении базисных плоскостей (графит сжимается при нагревании), его абсолютное значение с повышением температуры уменьшается. Выше 700 К коэффициент теплового расширения становится положительным. В направлении, перпендикулярном базисным плоскостям, коэффициент теплового расширения положителен, практически не зависит от температуры и более чем в 20 раз выше среднего абсолютного значения для базисных плоскостей.
Монокристаллы графита диамагнитны, магнитная восприимчивость незначительна в базисной плоскости и велика в ортогональных базисным плоскостях. Коэффициента Холла меняется с положительного на отрицательный при 2400 К.
2. Структура

Каждый атом углерода ковалентно связан с тремя другими окружающими его атомами углерода.
Различают две модификации графита: α-графит (гексагональный P63/mmc) и β-графит (ромбоэдрический R(-3)m). Различаются упаковкой слоёв. У α-графита половина атомов каждого слоя располагается над и под центрами шестиугольника (укладка …АВАВАВА…), а у β-графита каждый четвёртый слой повторяет первый. Ромбоэдрический графит удобно представлять в гексагональных осях, чтоб показать его слоистую структуру.
3. Условия нахождения в природе
Сопутствующие минералы: пирит, гранаты, шпинель. Образуется при высокой температуре в вулканических и магматических горных породах, в пегматитах и скарнах. Встречается в кварцевых жилах с вольфрамитом и др. минералами в среднетемпературных гидротермальных полиметаллических месторождениях.
Широко распространён в метаморфических породах — кристаллических сланцах, гнейсах, мраморах. Крупные залежи образуются в результате пиролиза каменного угля под воздействием траппов на каменноугольные отложения (Тунгусский бассейн). Акцессорный минерал метеоритов. С помощью ионной масс-спектрометрии российским учёным удалось обнаружить в составе графита золото, серебро и платиноиды (платина, палладий, иридий, осмий и проч.)в форме металлоорганических нанокластеров.
4.Искусственный синтез
Искусственный графит получают разными способами:
- Ачесоновский графит: нагреванием смеси кокса и пека до 2800 °C;.
- Рекристаллизованный графит: термомеханической обработкой смеси, содержащей кокс, пек, природный графит и карбидообразующие элементы.
- Пирографит: пиролизом из газообразных углеводородов при температуре 1400—1500 °C в вакууме с последующим нагреванием образовавшегося пироуглерода до температуры 2500—3000 °C при давлении 50 МПа (образовавшийся продукт — пирографит; в электротехнической промышленности применяется наименование «электрографит»).
- Доменный графит: выделяется при медленном охлаждении больших масс чугуна.
- Карбидный графит: образуется при термическом разложении карбидов.
5. Переработка
Переработкой графита, получают различные марки графита и изделия из них.
Товарные сорта графита получают обогащением графитовых руд. В зависимости от степени очистки графитовые концентраты классифицируют на промышленные марки по областям применения, каждая из которых выдвигает специфические требования к физико-химическим и технологическим свойствам графитов.
В свете последних открытий российских учёных появилась перспектива получения из графитовых руд золота и платиноидов
5.1. Переработка графита в терморасширенный графит
На первом этапе исходный кристаллический графит окисляют. Окисление сводится к внедрению молекул и ионов серной или азотной кислоты в присутствии окислителя (перекись водорода, перманганат калия и др.) между слоями кристаллической решетки графита. Окисленный графит отмывают и сушат. Затем окисленный графит подвергают термообработке до Т=1000 °C со скоростью 400-600 °C/с.
Благодаря чрезвычайно высокой скорости нагрева происходит резкое выделение газообразных продуктов разложения внедренной серной кислоты из кристаллической решетки графита. В результате межслойное расстояние увеличивается примерно в 300 раз, а число маленьких частиц графита и объём пробы увеличивается в 60-400 раз. В полученном материале остается некоторое количество оксидов серы или азота в зависимости от применяемой технологии. Далее полученный терморасширенный графит прокатывают, иногда армируют, добавляют присадки и прессуют для получения изделий.
5.2. Переработка графита для получения различных марок искусственного графита
Для производства искусственного графита используют в основном нефтяной кокс как наполнитель и каменноугольный пек как связующее. Для конструкционных марок графита в качестве добавок к наполнителю применяют природный графит и сажу. Взамен каменноугольного пека как связующего или пропитывающего вещества используют некоторые синтетические смолы, например, фурановые или фенольные.
Производство искусственного графита складывается из следующих основных технологических этапов:
- подготовки кокса к производству (предварительного дробления, прокаливания, размола и рассева кокса по фракциям);
- подготовки связующего;
- приготовления углеродной массы (дозировки и смешивания кокса со связующим);
- формования так называемых «зелёных» (необожжённых) заготовок в глухую матрицу или через мундштук прошивного пресса;
- обжига заготовок;
- графитации заготовок;
- механической обработки заготовок до размеров изделий.
В смесильную машину вначале загружают сухие компоненты, а затем добавляют жидкий пек. После смешивания массу равномерно охлаждают до температуры прессования (80-100 °C). Заготовки прессуют или методом выдавливания массы через мундштук, или в пресс-форме. При прессовании холодных порошков изменяют технологию подготовки помола и смешения.
Для карбонизации связующего и скрепления отдельных зёрен в монолитный материал заготовки обжигают в многокамерных газовых печах при температуре 800—1200 °C. Продолжительность цикла обжига (нагрев и охлаждение) составляет 3-5 недель в зависимости от размера и плотности заготовок. Графитация — окончательная термическая обработка — превращает углеродный материал в графит.
Графитацию проводят в печах сопротивления Ачесона или в печах прямого нагрева Кастнера при температурах 2400-3000 °C. При графитировании углеродистых нефтяных заготовок идет процесс укрупнения кристаллов углерода. Из мелкокристаллического «амфорного» углерода получается крупнокристаллический графит, атомная решетка которого ничем не отличается от атомной решетки природного графита.
Некоторые изменения технологического процесса получения искусственного графита зависят от требуемых свойств конечного материала. Так, для получения более плотного материала углеродные заготовки пропитывают (после обжига) в автоклавах один или несколько раз пеком с последующим обжигом после каждой пропитки и графитацией в конце всего технологического процесса. Для получения особо чистых материалов графитацию проводят одновременно с газовой очисткой в атмосфере хлора.
5.3. Переработка графита для получения композиционных материалов
Антифрикционные углеродные материалы изготавливают следующих марок: обожженный антифрикционный материал марки АО, графитированный антифрикционный материал марки АГ, антифрикционные материалы, пропитанные баббитом, оловом и свинцом марок АО-1500Б83, АО 1500СО5, АГ-1500Б83, АГ-1500СО5, Нигран, Химанит и графитопластовые материалы марок АФГМ, АФГ- 80ВС, 7В-2А, КВ, КМ, АМС.
Антифрикционные углеродные материалы изготавливают из непрокаленного нефтяного кокса, каменноугольного пека с добавкой природного графита. Для получения плотного непроницаемого антифрикционного материала применяют пропитку его металлами. Таким методом получают антифрикционные материалы марок АГ-1500 83, АГ-1500СО5 АМГ-600Б83, АМГ-600СО5 и им подобные.
Допустимая рабочая температура на воздухе и в газовых средах, содержащих кислород для АО — 250—300 °C, для АГ — 300 °C (в восстановительных и нейтральных средах 1500 и 2500 °C соответственно). Углеродные антифрикционные материалы химически стойки во многих агрессивных газовых и жидких средах. Они стойки почти во всех кислотах (до температуры кипения кислоты), в растворах солей, во всех органических растворителях и ограниченно стойки в концентрированных растворах едких щелочей.
5.4. Графит как золотосодержащее сырьё
6. Применение
Cувенирный графитовый блок.
Использование графита основано на ряде его уникальных свойств.
- для изготовления плавильных тиглей, футеровочных плит — применение основано на высокой температурной стойкости графита (в отсутствие кислорода), на его химической стойкости к целому ряду расплавленных металлов
- электродов, нагревательных элементов — благодаря высокой электропроводности и химической стойкости к практически любым агрессивным водным растворам (намного выше, чем у благородных металлов).
- Для получения химически активных металлов методом электролиза расплавленных соединений. В частности, при получении алюминия используются сразу два свойства графита:
- Хорошая электропроводность, и как следствие — его пригодность для изготовления электрода
- Газообразность продукта реакции, протекающей на электроде — это углекислый газ. Газообразность продукта означает, что он выходит из электролизёра сам, и не требует специальных мер по его удалению из зоны реакции. Это свойство существенно упрощает технологию производства алюминия.
- твёрдых смазочных материалов, в комбинированных жидких и пастообразных смазках
- наполнитель пластмасс
- замедлитель нейтронов в ядерных реакторах
- компонент состава для изготовления стержней для чёрных графитовых карандашей (в смеси с каолином)
- для получения синтетических алмазов
- для изготовления контактных щёток и токосъёмников для разнообразных электрических машин, электротранспорта и мостовых подъёмных кранов с троллейным питанием, мощных реостатов, а также прочих устройств, где требуется надёжный подвижный электрический контакт.
- как токопроводящий компонент высокоомных токопроводящих клеёв
Источник: itpgrafit.ru
Структура графита, характеристики: 31 полная краткая информация
В этой статье ниже обсуждаются различные свойства «структуры графита», такие как структурные свойства, характеристики, использование с некоторыми соответствующими темами.
Графит также известен как плюмбаго или черный свинец, и это минерал, состоящий из углерода. Он имеет двумерную слоистую структуру с кольцами из шести атомов углерода. Графит кристаллизуется в гексагональных системах. Он относительно мягкий и черно-серого цвета.
Давайте сосредоточимся на следующих темах, связанных со структурой графита.
Какова структура графита?
Графит в основном является одним из самых стабильных аллотропов углерода. Он является хорошим проводником электричества и тепла с плотностью 2.09-2.23 г/см. 3 с большой ковалентной структурой, в которой каждый атом углерода соединен с соседними тремя атомами углерода.
В графите каждый атом углерода находится в состоянии sp 2 гибридизированный, который образует слоистую структуру с гексагональным расположением атомов углерода. Эти слои слабо связаны друг с другом. Из-за наличия слабой силы между слоями они очень легко проскальзывают.
У углерода четыре валентных электрона, и один атом углерода связан с тремя другими атомами углерода, таким образом, остается один валентный электрон, и этот валентный электрон делокализован в структуре.

Как нарисовать графитовую структуру Льюиса?
к знай льюиса структура любой молекулы, сначала должны быть определены атомы, входящие в состав этой молекулы. Фактическая структура Льюиса графита очень сложна из-за его слоистой структуры.
Графит состоит только из атома углерода, в котором один атом углерода связан с тремя другими атомами углерода. Таким образом, один из четырех валентных электронов остается несвязывающей электронной парой. Всего 3*2=6 электронов от каждого атома углерода участвуют в связывании электронных пар.

Структура Льюиса графита
Графит Структура Льюиса Формальный заряд
- Формальный заряд = общее количество валентных электронов — количество электронов, оставшихся несвязанными — (количество электронов, участвующих в образовании связи / 2)
- Формальный заряд центрального атома углерода = 4 – 1 – (4/2) = 1
Таким образом, один электрон остается несвязывающим и становится делокализованным по структуре.
Угол структуры графита Льюиса
Угол указывает в основном угол между двумя связями, соединенными центральным атомом. Валентный угол зависит от гибридизации центрального атома любой молекулы в большей степени, чем от факторов отталкивания, присутствующих в этой конкретной молекуле.
- Отталкивание одинокой пары-одинокой пары
- Отталкивание одинокой пары — пары связи
- Связь пара-связь пары отталкивания.
В графите в sp участвуют одна s- и две p-орбитали. 2 гибридизация. Из приведенной выше таблицы видно, что валентный угол будет равен 120°. 0 и длины связи 1.421 A 0 .
Правило октета структуры графита Льюиса
Правило октета — одно из наиболее важных правил неорганической химии, в котором утверждается, что любой атом должен иметь такую электронную конфигурацию, которая напоминает электронную конфигурацию ближайшего инертного газа в периодической таблице.
С одной точки зрения, графит не подчиняется правилу октетов. Таким образом, он не должен быть стабильным. Но экспериментально показано, что стабильность графита очень высока. Потому что лишний или несвязанный электрон в структуре графита делокализован по всем атомам углерода.
Следовательно, графит стабилен, хотя и не удовлетворяет правилу октетов.