
Гипс — минерал из класса сульфатов, по составу гидрат сульфата кальция.Волокнистая разновидность гипса называется селенитом, а зернистая — алебастром.
| CaSO4·2H2O |
| Белый, оттенки серого и красного |
| Белый |
| Стеклянный до перламутрового |
| 1,5—2,0 |
| Весьма совершенная |
| Неровный; гибок, но не эластичен |
| 2,2—2,4 г/см³ |
| Моноклинная |
| 1,52 |
Свойства
Блеск стеклянный или шелковистый (у волокнистых разновидностей), спайность весьма совершенная в одном направлении (расщепляется на тонкие пластинки). Цвет белый, серый, иногда красноватый, при наличии примесей имеет серую, желтоватую, розоватую, бурую окраску. Волокнистые разности дают занозистый излом. Черта белая. Сингония моноклинная.
Делаем пиротехнический состав и другие опыты с щелочноземельными металлами
Плотность — 2,3 г/см³, твёрдость по шкале Мооса — 2. Текстура — массивная.
Распространение
Гипс — типичный осадочный минерал. Встречается в пластах осадочных пород в форме чешуйчатых, волокнистых или плотных мелкозернистых масс, бесцветных или белых кристаллов, иногда окрашенных захваченными ими при росте включениями и примесями в бурые, голубые, жёлтые или красные тона. Образует прожилки параллельно-волокнистой структуры (селенит) в глинистых осадочных породах, а также сплошные мелкозернистые агрегаты, напоминающие мрамор (алебастр). Иногда в виде землистых агрегатов, а также слагает цемент песчаника. В почвах аридной зоны формируются новообразования гипса: одиночные кристаллы, двойники («ласточкины хвосты»), друзы, «гипсовые розы» и т. д.
Месторождения гипса распространены по всему миру. В России они есть в Пермском крае (Кунгур), в Тульской области (Новомосковск), в Нижегородской области (Пешелань, Гомзово), Самарской области (Самара), Краснодарском крае (Мостовской, Шедок, Псебай), Карачаево-Черкесской республике (Хабез, Черкесск), Волгоградской области.
Применение
Волокнистый гипс (селенит) используют для недорогих ювелирных изделий. Из алебастра издревле вытачивали крупные ювелирные изделия — предметы интерьера (вазы, столешницы, чернильницы и т. д.).
В «сыром» виде используется как удобрение и в целлюлозно-бумажной промышленности, в химической для получения красок, эмали, глазури. Гипс применяют, как вяжущий материал в строительном деле, в медицине. Также гипс применяется для создания декоративных элементов в классическом стиле (барельефы, карнизы и т. д.). Широкое применение в архитектуре гипс получил в Античной культуре.
Какой гипс лучше | Виды гипса для творчества
Желтоватые и более плотные разновидности гипса являются хорошим поделочным материалом.
Источник: chemicalportal.ru
Гипс

Бесцветный, белый, серый, жёлтоватый. Примеси придают жёлтый, коричневый, красный, чёрный или голубой оттенок.
Цвет черты (цвет в порошке): Белый
Прозрачность: Прозрачный, Просвечивающий
Спайность: Весьма совершенная
Излом: Занозистый, Раковистый, Ровный, Ступенчатый
Блеск: Жирный, Перламутровый, Стеклянный, Шелковистый
Твёрдость: 1,5-2
Удельный вес, г/см 3 : 2,32
Особые свойства:
Мягкий, не эластичный, но гнущийся. Кристаллы гипса с включениями иногда проявляют голубовато-белую, жёлтую, зелёную флюоресценцию.
Форма выделения
Тонко- и толстотаблитчатые кристаллы, часто двойники срастания кристаллов в виде ласточкина хвоста, волокнистые и листоватые агрегаты, зернистые и сплошные массы.
Сопутствующие минералы
Происхождение
Гипс редко первичный гидротермальный, преимущественно осадочный и как продукт выветривания (окисления). Встречается в виде прослоев в осадочных породах, часто переслаивается с глинистыми сланцами, известняками, галитом. Как аутигенный минерал встречается в соляных озёрах и ямах, в эвапоритах.
Месторождения / проявления
Прозрачные разновидности гипса известны в Германии, тонкозернистая разновидность (алебастр) — в Италии, селенит (волокнистой разновидности) известен в Пермской и Самарской областях, Россия. В пустыне Сахара встречаются большие количества гипсовых роз.
Применение
Гипс используют в медицине, в строительной и химической промышленности.
Источник: kristallov.net
Формула гипса
Выделяют две разновидности гипса – волокнистую (селенит) и зернистую (алебастр). Окраска гипса различна, от белого, серого или красноватого, до серого, желтого, розового или бурого, что зависит от наличия и типа примесей (рис. 1).

Рис. 1. Гипс. Внешний вид.
При нагревании до 150-170 o C гипс теряет ¾ содержащейся в нем кристаллизационной воды и переходит в так называемый жженый гипс, а будучи замешанным с водой в жидкое тесто довольно быстро затвердевает, снова приобретая первоначальную структуру.
Химическая формула гипса
Химическая формула гипса CaSO4×2H2O. Она показывает качественный и количественный состав молекулы вещества (сколько и каких атомов входят в её состав). По химической формуле можно вычислить молекулярную массу гипса:
Mr(CaSO4) = 40 + 32 + 4×16 = 40 + 32 + 64 = 136.
Mr(H2O) = 2×1 + 16 = 2 + 16 = 18.
Mr(CaSO4×2H2O) = 136 + 2×18 = 136 + 36 = 172.
Структурная (графическая) формула гипса
Структурная (графическая) формула гипса является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
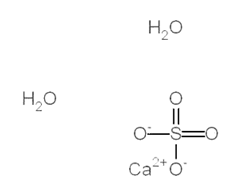
Ионная формула
Диссоциация кристаллогидрата сульфата кальция протекает согласно следующему уравнению:
Примеры решения задач
| Задание | При полном сгорании некоторого количества углеводорода образовалось 14,08 г оксида углерода (IV) и 3,6 г воды. Найдите молекулярную формулу вещества, если относительная плотность его паров по водороду равна 39. |
| Решение | Составим схему реакции сгорания аминокислоты обозначив количество атомов углерода, водорода, кислорода и азота за «x», «у», «z» и «k» соответственно: |
Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м.
Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль.
m(C) = [14,8 / 44]×12 = 4,04 г;
m(H) = 2×3,6 / 18 ×1= 0,4 г.
Определим химическую формулу углеводорода:
x:y= 0,34 : 0,4 = 1 : 1.
Значит его простейшая формула CH, а молярная масса 13 г/моль [M(CH) = Ar(C) + Ar(H) = 12 + 1 =13 / моль].
Значение молярной массы органического вещества можно определить при помощи его плотности по водороду:
Msubstance = 2 × 39 = 78 г/моль.
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Msubstance / M(CH) = 78 / 13 = 6.
Значит индексы атомов углерода и водорода должны быть в 6 раз выше, т.е. формула вещества будет иметь вид C6H6.Это бензол.
| Задание | В некотором соединении массовые доли азота, водорода и кислорода соответственно равны 35,5%, 5% и 60%. Выведите простейшую формулу этого соединения. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Обозначим число атомов азота в молекуле через «х», число атомов водорода через «у» и число атомов кислорода за «z».
Найдем соответствующие относительные атомные массы элементов азота, водорода и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Ar(N) = 14; Ar(H) = 1; Ar(O) = 16.
x:y:z = ω(N)/Ar(N) : ω(H)/Ar(H) : ω(O)/Ar(O);
x:y:z = 35,5/14 : 5/1 : 60/16;
x:y:z = 2,5 : 5 : 3,75 = 1: 2 : 1,5 = 2 : 4: 3.
Значит простейшая формула соединения калия, хрома и кислорода имеет вид N2H4O3или NH4NO3. Это нитрат аммония.
Источник: ru.solverbook.com