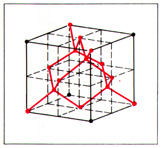
Структура алмаза. Элементарная ячейка пространственной кристаллической решётки алмаза представляет собой гранецентрированный куб с 4 дополнительными атомами, расположенными внутри куба (рис.).
Размер ребра элементарной ячейки а0 = 0,357 нм (при t = 25°С и Р = 1 атм). Кратчайшее расстояние между двумя соседними атомами С = 0,154 нм. Атомы углерода в структуре алмаза образуют прочные ковалентные связи, направленные под углом 109°28′ относительно друг друга, благодаря чему алмаз — самое твёрдое из известных в природе веществ. В зонной структуре алмаза ширина запрещённой зоны для невертикальных переходов равна 5,5 эВ, для вертикальных — 7,3 эВ, ширина валентной зоны 20 эВ. Подвижность электронов mn = 0,18 м 2 /В•с, дырок mr = 0,15 м 2 /В•с.
Алмаз
Морфология алмаза. Кристаллы алмаза имеют форму октаэдра, ромбододекаэдра, куба и тетраэдра с гладкими и пластинчато-ступенчатыми гранями или округлыми поверхностями, на которых развиты разнообразные акцессории.
Характерны уплощённые, удлинённые и сложноискажённые кристаллы простой и комбинированной форм, двойники срастания и прорастания по шпинелевому закону, параллельные и произвольно ориентированные сростки. Разновидности алмаза представляют собой поликристаллические образования: борт — сростки многочисленных мелких огранённых кристаллов и зёрен неправильной формы, серого и чёрного цвета; баллас — сферолиты радиально-лучистого строения; карбонадо — скрытокристаллические, плотные, с эмалевидное поверхностью или шлакоподобные пористые образования, состоящие преимущественно из субмикроскопических (около 20 мкм) зёрен алмаза, тесно сросшихся друг с другом. Размер природных алмазов колеблется от микроскопических зёрен до весьма крупных кристаллов массой в сотни и тысячи карат (1 карат = 0,2 г). Масса добываемых алмазов обычно 0,1-1,0 карат; крупные кристаллы (свыше 100 карат) встречаются редко. В таблице приведены крупнейшие в мире алмазы, извлечённые из недр.
Химический состав. В алмазе присутствуют примеси Si, Al, Mg, Ca, Na, Ba, Mn, Fe, Cr, Ti, В номером. С помощью а-частиц радиоизотопных Н, N, О, Ar и других элементов. Азот является главной примесью, оказывающей большое влияние на физические свойства алмаза. Кристаллы алмаза, непрозрачные к ультрафиолетовому излучению, называются алмазом I типа; все остальные относятся к типу II.
Содержание азота в подавляющем большинстве кристаллов алмаза, относящихся к типу I, составляет около 0,25%. Реже встречаются безазотные алмазы, относящиеся к типу II, в которых примесь азота не превышает 0,001%. Азот изоморфно входит в структуру алмаза и образует самостоятельно или в совокупности со структурными дефектами (вакансиями, дислокациями) центры, ответственные за окраску, люминесценцию, поглощение в ультрафиолетовой, оптической, инфракрасной и микроволновой областях, характер рассеивания рентгеновских лучей и др.
Физические свойства. Алмазы могут быть бесцветными или с едва заметным цветовым оттенком, а также в различной степени ясно окрашенными в жёлтый, коричневый, розовато-лиловый, зелёный, голубой, синий, молочно-белый и серый (до чёрного) цвета. При облучении заряжёнными частицами алмаз приобретает зелёный или голубой цвет.
Обратный процесс — превращение окрашенного алмаза в бесцветный — до сих пор не удалось провести. Для алмаза характерны сильный блеск, высокий показатель преломления (n = 2,417) и сильно выраженный эффект дисперсии (0,063), что обуславливает разноцветную игру света в бриллиантах.
Как правило, в кристаллах алмаза проявляется аномальное двулучепреломление из-за напряжений, возникающих в связи со структурными дефектами и включениями. Кристаллы алмаза прозрачны, полупрозрачны или непрозрачны в зависимости от насыщенности микроскопическими включениями графита, других минералов и газово-жидких вакуолей.
При освещении ультрафиолетовыми лучами значительная часть прозрачных и полупрозрачных кристаллов алмаза люминесцирует синим, голубым и реже жёлтым, жёлто-зелёным, оранжевым, розовым и красным цветами. Кристаллы алмаза (за редким исключением) люминесцируют под действием рентгеновских лучей. Свечение алмаза возбуждается катодными лучами и при бомбардировке быстрыми частицами. После снятия возбуждения часто наблюдается послесвечение различной длительности (фосфоресценция). В алмазе проявляется также электро-, трибе- и термолюминесценция.
Алмаз как самое твёрдое вещество в природе используется в разнообразных инструментах для распиловки, сверления и обработки всех других материалов. Относительная твёрдость по шкале Mоcca 10, максимальная абсолютная микротвёрдость, измеренная индентором на грани (111), 0,1 ТПа.
Твёрдость алмаза на различных кристаллографических гранях не одинакова; наиболее твёрдой является октаэдрическая грань (111). Алмаз очень хрупок, обладает весьма совершенной спайностью по грани (111). Модуль Юнга 0,9 ТПа. Плотность прозрачных кристаллов алмаза 3515 кг/м 3 , полупрозрачных и непрозрачных — 3500 кг/м 3 , у некоторых австралийских алмазов — 3560 кг/м 3 ; у борта и карбонадо из-за их пористости может снижаться до 3000 кг/м 3 . Чистая поверхность кристаллов алмаза обладает высокой гидрофобностью (краевой угол 104-105°). В природных алмазах, особенно в алмазах из россыпных месторождений, на поверхности образуются тончайшие плёнки, которые повышают её смачиваемость.
Алмаз — диэлектрик. Удельное сопротивление r у всех азотных кристаллов алмаза типа I равно 10 12 -10 14 Ом•м.
Среди безазотных алмазов типа II иногда встречаются кристаллы, у которых r ниже 10 6 Ом•м, иногда до 10-10 -2 . Такие алмазы обладают проводимостью r-типа и фотопроводимостью, причём при одинаковых условиях фототок в алмазе типа II на порядок больше фототока, возбуждаемого в алмазе типа I. Алмаз диамагнитен: магнитная восприимчивость, отнесённая к единице массы, составляет 1,57•10 -6 единиц СИ при 18°С. Алмаз стоек по отношению ко всем кислотам даже при высокой температуре.
В расплавах щелочей KOH, NaOH и других веществ в присутствии О, OH, CO, CO2, Н2О происходит окислительное растворение алмаза. Ионы некоторых элементов (Ni, Co, Cr, Mg, Ca и др.) обладают каталитической активностью и ускоряют этот процесс. Алмаз обладает высокой теплопроводностью (особенно безазотные алмазы типа II).
При комнатной температуре теплопроводность их в 5 раз выше Си, причём коэффициент теплопроводности уменьшается с увеличением температуры в интервале 100-400 К от 6 до 0,8 кДж/м•К. Полиморфный переход алмаза в графит при атмосферном давлении происходит при температуре 1885±5°С по всему объёму кристалла. Образование плёнок графита на поверхности граней (III) кристаллов алмаза под влиянием кислорода может происходить начиная с 650°С. На воздухе алмаз сгорает при температуре 850°С.
Распространённость и происхождение. Алмазы обнаружены в метеоритах, импактных породах, связанных с метеоритными кратерами (астроблемами), в Кимберлитах и находящихся в них небольшого размера ксенолитах глубинных мантийных пород передо-гитового и эклогитового составов, а также во вторичных источниках — различных по возрасту и генезису россыпях (аллювиальных, делювиальных, элювиальных, прибрежно-морских, пролювиальных и др.).
По вопросам происхождения алмазов нет единого мнения. Некоторые учёные полагают, что алмазы кристаллизуются в самих кимберлитовых трубках при их становлении или в промежуточных очагах, возникающих на небольших (3-4 км) глубинах (субвулканические очаги). Другие считают, что алмазы образуются на большой глубине в родоначальном кимберлитовом расплаве и продолжают кристаллизоваться при подъёме его в верхнюю часть земной коры. Наиболее обоснованно развиваются представления о том, что алмазы генетически связаны с разнообразными перидотитовыми и эклогитовыми породами верхней мантии и выносятся из них вместе с другим ксеногенным материалом, находящимся в кимберлитах. Существуют и другие представления о генезисе алмаза (например, кристаллизация при низких давлениях с использованием углерода из метана глубинного происхождения и карбонатов вмещающих пород).
В CCCP известны как коренные, так и россыпные месторождения алмазов (например, в Западной Якутии, на Урале).
Добыча алмазов. Верхние горизонты кимберлитовых трубок разрабатываются открытым способом, нижние — подземным (вскрытие вертикальным стволом и квершлагами); разработка — с магазинированием кимберлитовой породы и выдачей её через рудоспуски на транспортные горизонты. Россыпные месторождения разрабатываются открытым способом с применением экскаваторов, скреперов или драг.
Обогащение. На россыпных месторождениях порода сначала промывается в гидровашгердах для удаления связующей глинистой массы и отделения крупного обломочного материала; выделенный, рыхлый материал разделяется на четыре класса: -16+8, -8+4, -4+2, -2+0,5 мм.
Обогащение производится гравитационными методами (мокрая и воздушная отсадка, обогащение в тяжёлых суспензиях, в концентрационных чашах). Для извлечения мелких алмазов и алмазной крошки применяются плёночная и пенная флотация с предварительной очисткой поверхности. Реагенты: амины, аэрофлоты, жирные кислоты, керосин, крезиловая кислота.
Для извлечения алмазов наибольшее распространение получил жировой процесс (для зёрен с крупностью 2-0,2 мм), основанный на избирательной способности алмазов прилипать к жировым поверхностям. В качестве жирового покрытия используют вазелин, нефть, автол и его смесь с парафином, олеиновую кислоту, нигрол и др. Наряду с жировым процессом применяют (для зёрен крупностью 3-0,1 мм) электростатическую сепарацию, основанную на различной проводимости минералов (алмаз — плохой проводник электричества). Используется рентгенолюминесцентный метод извлечения относительно крупных алмазов, основанный на способности кристаллов алмаза люминесцировать (рентгенолюминесцентные автоматы).
Применение. Алмазы разделяются на ювелирные и технические. Первые обладают высокой прозрачностью. Наиболее ценными являются алмазы бесцветные («чистой воды») или с хорошей окраской. К техническим относятся все прочие добываемые алмазы вне зависимости от их качества и размеров.
В CCCP сортировка алмазов производится по техническим условиям, которые дополняются по мере расширения областей применения алмазов. В зависимости от видов и назначения алмазное сырьё по качеству классифицируется на категории; в каждой категории выделяются группы и подгруппы, которые определяют размер, форму, конкретные условия назначения кристаллов алмазов. Около 25% добываемых в мире алмазов используется в ювелирной промышленности для изготовления бриллиантов.
Обладая исключительно высокой твёрдостью, алмазы незаменимы для изготовления различных инструментов и приборов (буровые коронки и долота, инденторы для измерения твёрдости материалов, волоки, иглы к профилометрам, профилографам, пантографам, свёрла, резцы, накладные камни к морским хронометрам, стеклорезы и т.д.). Алмазы широко используются для изготовления абразивных порошков и паст, для заправки алмазных пил.
Алмазным инструментом обрабатываются некоторые металлы, полупроводниковые материалы, керамика, строительные железобетонные материалы, хрусталь и др. По совокупности ряда уникальных свойств алмазы могут быть использованы для создания электронных приборов, предназначенных для работы в сильных электрических полях, при высоких температурах, в условиях повышенного уровня радиации, в агрессивных химических средах. На основе алмазов созданы детекторы ядерных излучений, теплоотводы в электронных приборах, термисторы и транзисторы. Прозрачность алмазов для инфракрасного излучения и слабое поглощение рентгеновских лучей позволяют применять их в инфракрасных приёмниках, в камерах для исследования фазовых переходов при высоких температурах и давлениях.
Синтетические алмазы. В середине 50-х гг. началось освоение промышленного синтеза технических алмазов. Синтезируются в основном мелкие монокристаллы и более крупные поликристаллические образования типа балласа и карбонадо.
Основные способы синтеза: статический — в системе металл — графит при высоких давлениях и температурах; динамический — полиморфный переход графита в алмазах при воздействии ударной волны; эпитаксиальный — наращивание алмазных плёнок на алмазные затравки из газообразных углеводородов при низких давлениях и температуре около 1000°С. Синтетические алмазы используются также, как природные технические. Общий объём производства синтетических алмазов значительно превышает объём добычи природных.
Источник: www.mining-enc.ru
Молярная масса, физическая формула и структура алмаза
Невероятно дорогой минерал алмаз, что превращается в удивительно сверкающие бриллианты при огранке, обладает особыми физическими и химическими свойствами. Ученые долго разгадывали его формулу, а затем и вовсе научились получать камни синтетическим путем.
Физико-механические свойства алмаза

Алмаз – не что иное, как одна из разновидностей углерода, только самая красивая и самая дорогая. В естественных условиях он отличается невероятной стабильностью, в нем не происходит никаких изменений столетиями и тысячелетиями. Зато, если поместить алмаз в среду инертных газов, создать условия вакуума, то он превратится в графит – другую форму углерода.
Этот бесцветный минерал – эталон твердости по шкале Мооса. Если сравнивать с кварцем, то плотность алмаза выше в тысячу раз и в 150 раз от корунда. Алмаз невозможно поцарапать каким-либо веществом, кроме другого алмаза. Минералу не страшны даже кислоты, способные растворять металлы.
В расплавленных щелочах алмаз начинает постепенно растворяться.
Формула и структура минерала
С точки зрения химии, формула алмаза помещается в одну букву С, обозначающую углерод. Он обладает кристаллической решеткой, причем, гранецентрированной кубической. Атомы молекул углерода связаны между собой очень прочно, поэтому минерал обладает такой твердостью. Однако при этом он хрупкий, разрушение (раскалывание) будет идти только по определенным плоскостям.
Каждый из углеродных атомов занимает ровно середину тетраэдра, в вершинах которого располагается ближайшая четверка атомов. Именно строго упорядоченная структура обеспечивает самоцвету уникальные свойства. Атомное расстояние имеет одинаковую периодичность, оно равняется 0,15 нм.
В свое время алмаз считали не чем иным, как кварцем. Только в XVIII веке Лавуазье, сжигая камень, обнаружил, что тот выделяет оксид углерода. В начале XIX века ученые окончательно определили, что алмаз, уголь и графит – химически одно и то же. Сажа и графен – также ближайшие родственники алмаза. Молярная масса алмаза – 12,01.
Вместе с графитом алмаз – лидеры по показателю теплопроводности, у алмаза она даже выше – до 2300 Вт/(м⋅К). За счет того, что на гранях формируются специфические пленки адсорбированных газообразных веществ, у минерала невероятно низкий коэффициент трения по металлу (в условиях воздуха) – только 0,1.
Окраска

Большинство добываемых алмазов – полностью прозрачные и совершенно бесцветные камни. Однако они могут светиться под воздействием рентгеновских, ультрафиолетовых, катодных лучей голубоватым, синим или зеленым цветом. Минерал отличается сильным блеском. Это обеспечивает дисперсия вместе с высоким показателем преломления и прозрачностью минерала.
Также в природе встречаются цветные алмазы, что бывает очень редко. Причем камень не обязательно должен быть окрашен полностью, он может быть пятнистым, иметь цветными отдельные участки.
Наиболее распространенные оттенки – коричневый и желтый, что возникает из-за дефектов в структуре минерала. Цветные камни – редкое явление, особенно если они крупные. Так, желтый алмаз под названием «Тиффани» имел вес в 57 г (равный 287 каратам), а уникальный бриллиант зеленого цвета «Дрезденский» весил 8,2 г (41 карат). Такой необычный цвет камня обусловлен его естественной радиоактивностью. Еще реже находят красные, синие или розовые алмазы.
Встречаются даже черные алмазы, именуемые карбонадо. Некоторые ученые считают, что они образовались на Земле, другие считают их пришельцами из Космоса.
Гигантский черный алмаз весом более 3 тысяч карат был обнаружен на территории Бразилии.
Вес и масса алмаза

Стандартная единица для массы – это грамм, но для алмазов, а также полученных из них бриллиантов применяют другую единицу обозначения – карат. Один карат составляет 0,2 г. Такая единица измерения массы камня была окончательно принята в мире в 1907 году.
Чем объемнее минерал, тем в разы возрастает его цена. Большинство добываемых камней довольно мелкие, порядка 0,1 карата. Алмазы крупнее 5 карат встречаются очень редко, а более 15 карат – историческое событие. Рекордсменом по весу в алмазном мире считается «Звезда Африки» или «Куллинан». Вес минерала составил практически 3107 карат (относительно граммам – это 621 г).
Этот рекорд, установленный в 1905 году, побить так и не удалось. Из-за природных появлений трещин огранить этот гигант в один бриллиант было нельзя, поэтому его раскололи.
Наличие трещин – это знак, который указывает на низкое качество самоцвета.
Синтезированные алмазы
Алмаз представляет большую ценность как режущий и абразивный элемент ввиду своей исключительной твердости. Но для этих целей природные камни слишком дорогие. Поэтому еще в XVII веке ученые экспериментировали с минералом, пытались сделать из мелких камней один крупный, исследовали химическую формулу алмаза. Первые экземпляры стали получать синтетическим путем в 1953-1954 годах, а массовое производство искусственных камней стартовало с 1963 года. При помощи специального «алмазного щупа» – прибора, что замеряет теплопроводность камня, искусственный минерал можно однозначно отличить от природного самоцвета.

Существуют три технологии получения искусственных минералов:
- Методом взрыва. За счет ударной волны, что формируется в замкнутом металлическом контейнере (трубке), получается высокая температура и давление, графит трансформируется в алмаз.
- Химический способ. В этом случае происходит осаждение графита в виде алмазов за счет того, что процесс происходит в среде метана. Этот метод также называют CVD.
- При методе HPTH создают условия, близкие к природным, в которых формируются кристаллы алмаза. Два самых важных фактора для этого – высокое давление и температура. В роли центра кристаллизации используют мельчайшие алмазы, полученные другими технологиями, которые вырастают в более крупные камни.
Искусственные алмазы для изготовления ювелирных украшений не используют, хотя они полностью повторяют химический состав природных камней.
Примеси в составе алмаза
Синтетические минералы находят применение в ядерной промышленности, для изготовления часовых механизмов и компьютерной техники. Для некоторых случаев требуются особые свойства алмаза. Их можно придать камню, если вводить определенные добавки (примеси). Это может быть бор или фосфор.
Алмаз в таблице Менделеева является углеродом.

Даже натуральные алмазы включают микроколичества алюминия, кремния, азота, бора, кальция или магния. Также в роли примесей встречается титан, марганец или железо, которое обеспечивает желтоватый отлив окрашенных алмазов. За счет присутствия примеси бора камень приобретает голубой тон. Основная «добавка» в составе природных камней – это азот.
Для ювелирных целей используют лишь те самоцветы, которые состоят не более чем из 5% примесей, причем, на долю одного вещества не должно выпадать более 2%. Если количество посторонних соединений, кроме углерода, выше, то из драгоценного камня он сразу переходит в технический. Преобразить промышленный алмаз можно с помощью молекулярного преобразователя.
Драгоценные камни всегда были востребованы. Природные минералы пользуются популярностью среди ювелиров, а искусственно созданные «работают» во многих отраслях промышленности. У алмазов нет конкурентов по твердости и многим другим характеристикам. Это всего лишь углерод, но особой структуры.
Источник: velestone.ru
АЛМАЗ

Один из аллотропных модификации углерода. Кристаллы алмаза обладают такими ценными физико-механическими свойствами, как исключительная твердость, износостойкость , высокая теплопроводность, коррозионная стойкость, высокие показатель преломления и дисперсия света. Эти свойства и определили области его применении: механическая обработка различных материалов, приборостроение, полупроводниковая электроника, ювелирной промышленность.
Алмаз что это такое
Теоретические и экспериментальные исследования алмазов ведутся в направлении изыскания возможностей как для наиболее эффективною использования их в традиционных областях, гак и для расширения областей применения, а также в направлении разработки новых методов синтеза монокристаллов с заданными свойствами. Наиболее изучены оптические свойства алмазов, значительно меньше — их теплопроводность, работа разрушения, электромагнитные свойства в широком температурном интервале.
Благодаря твёрдости алмаз широко применяется для резки стекла , бурения твёрдых пород , в машинах для волочения проволоки , шлифовальных дисках и т.д . Для этих целей этих целей используют алмазы , загрязнённые разными примесями .
Чистые бесцветные кристаллы подвергают огранке и шлифовке алмазным порошком и превращают в бриллианты . Чем больше граней тем больше « играет » он . Бриллианты бывают чаще всего небольшими , их вес измеряется в каратах ( 1 карат равен 0,2 г ) , но встречаются и крупные бриллианты .
Структура модификаций углерода алмаза
Основное состояние атома — это состояние с максимальным чистом неспаренных валентных электронов. Образованию химической связи между атомами углерода предшествует переход атомов в возбужденное состояние с максимальным числом неспаренных электронов по схеме 2 s ² 2 p ² → 2s ¹ 2 p ¹ 2 p ¹ 2 p ¹ . Потенциал ионизации атома углерода 11,256 эВ . Атомы углерода, соединяясь, образуют ковалентные связи (металлическая связь не может образоваться, так как слишком велика энергия отрыва электрона: сродство к электрону атома углерода — 1,27 эВ).
В результате s p ³ -гибридизации валентных электронов образуются четыре равноценные σ -связи под углом 109 ° 28′ друг к другу, направленные к вершинам правильного тетраэдра. Так связаны атомы в алмазе, лонсдейлите, метане, адамантане.
Атомы углерода ( алмаз )могут быть в состоянии, при котором происходит 2 sp ² — гибридизация электронов. Каждый атом углерода образует три σ -связи в одной плоскости под углом 120 ° относительно друг друга и, кроме того, дополнительно имеет по одному p -электрону. Вследствие перекрывания электронных облаков над и под плоскостью, в которой находятся атомы с σ -связями, р-электроны образуют π -связи. Так связаны атомы углерода в графите и ароматических соединениях.
Возможна также sp -гибридизация атомов углерода, при которой образуются две σ -связн под углом 180° друг к другу и в результате перекрывания двух орбиталей каждого из атомов углерода две π -связи. Так связаны атомы в карбине, ацетилене и его производных.
Существуют аморфные и частично кристаллические переходные формы углерода (сажа, кокс, стеклоуглерод и др.), и которых сочетаются различные типы связей.
Модификации с sp ³ -гибридизацией валентных электронов
Алмаз. Сингония кубическая; ячейка решетки — гранецентрированный куб, в четырех из восьми октантов которого также размещены атомы углерода; Z = 8; К. Ч. — 4; а 0 = 0,357 нм ; меж плоскостные расстояния ρ 0 = 3,515 г/см ³ ; экспериментально определенные значения ρ э , природных алмазов, г/см ³ ; тип I — 3,51537 ± 0,00005, тип II — 3,51506 ± 0,00005; ρ э , синтетических алмазов зависит от совершенства строения кристаллов, содержания механических включений и имеет значения 3,485—3,580
Вы читаете, статья на тему алмаз
Похожие страницы:
Аллотропия углерода В свободном состоянии углерод известен в виде трех аллотропических модификаций: алмаза, кристаллизующегося в правильной системе; графита, принадлежащего к.
ПРОВЕРКА ВЫПОЛНЕНИЯ ЗАДАНИЙ И ОТВЕТОВ НА ВОПРОСЫ 1. а) (Углерод; б) свинец; в) CO2, SiO2,GeO2, SnO2, РbO2; г) H2CO3 и.
ЧТО ТАКОЕ АТОМЫ БЛАГОРОДНЫХ ГАЗОВ Причиной газообразного состояния элементов главной подгруппы восьмой группы, так же как и полного отсутствия у.
ГРУППА УГЛЕРОДА Название элемента Символ Атомный вес Порядковый номер Распределение электронов По слоям Углерод С 12,011 6 2 4 .
Гибридизация атомных орбиталей В нормальном состоянии атом углерода имеет на внешнем слое два не спаренных электрона. При возбуждении один s-электрон переходит.
ЧТО ТАКОЕ ХИМИЯ ИНЕРТНЫХ ГАЗОВ Уже в опытах Рамзая с открытыми им газами было предпринято множество попыток получить сколько-нибудь прочные.
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Источник: znaesh-kak.com