Газы, жидкие и твердые тела состоят из атомов, молекул или ионов. Молекулами называют электрически нейтральные частицы, образованные из двух или более связанных ковалентными связями атомов (часто к молекулам причисляют также и свободные атомы). Ион – это электрически заряженная частица (атом или молекула), получаемая в процессе ионизации.
В зависимости от строения внешних электронных оболочек атомов в молекулах могут образовываться различные виды связей.
Ковалентная связь возникает при обобществлении электронов двумя соседними атомами. Иными словами происходит образование общей пары электронов, которые ранее принадлежали отдельным атомам. При образовании общей одной пары электронов от каждого объединяемого атома вносится по одному валентному электрону. Например:
5. Строение вещества. Атомы и молекулы (часть 1)
Молекулы, в которых центры положительных и отрицательных зарядов совпадают, являются неполярными. Если же в отдельных молекулах центры противоположных по знаку зарядов не совпадают и находятся на некотором расстоянии друг от друга, то такие молекулы называются полярными или дипольными.
Ионная связь определяется силами притяжения между положительными и отрицательными ионами.
Металлическая связь. Металлы можно рассматривать как системы, построенные из расположенных в узлах решетки положительно заряженных ионов, находящихся в среде свободных электронов
Молекулярная связь (связь Вандер-Вальса). Такая связь существует в некоторых веществах между молекулами с ковалентными внутримолекулярными связями. Межмолекулярное притяжение в этом случае обусловливается согла сованным движением валентных электронов в соседних молекулах. В любой момент времени электроны максимально удалены друг от друга и максимально приближены к положительным зарядам. При этом силы притяжения валентных электронов положительно заряженными остовами соседних молекул оказывается сильнее сил взаимного отталкивания электронов внешних орбит.
Раздела 1. Конструкционные материалы.
Тема №1. Строение и свойства металлов.
Металлы обычно имеют кристаллическое строение. В узлах кристаллической решетки металлов расположены положительно заряженные ионы, а часть валентных электронов, отщепившихся от атомов, становятся свободными. Свободные электроны обобществляются, образуя электронный газ, который взаимодействует с положительными ионами металла и связывает их в прочную систему.
Наиболее распространенными являются три типа кристаллической решетки: кубическая объемноцентрированная (о.ц.к.), кубическая гранецентрированная (г.ц.к.) и гексагональная плотноупакованная (г.п.у.)
Сколько Железа можно достать из Яблок? Химия Растений!
Чистые металлы обладают низкой прочностью, поэтому в технике используют редко. Наиболее широко применяют в технике в качестве конструкционных материалов металлические сплавы.
Под сплавом понимают вещество, полученное сплавлением двух или более элементов. Большинство сплавов, кроме сплавов с неорганической растворимостью компонентов в твердом состоянии, можно представить как систему, состоящую из нескольких фаз, находящихся в равновесии при определенных внешних условиях (температуре, давлении). Фазой называют однородную по химическому составу и строению часть системы, отделенную от другой части системы поверхностью раздела, при переходе через которую изменяются состав, строение и свойства сплава.
Строение металлического сплава зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав. Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. При образовании сплавов в процессе их затвердевания возможно различное взаимодействие компонентов. В зависимости от характера взаимодействия компонентов различают сплавы:
1. Механические смеси (гетерогенная структура) – образуются, когда компоненты не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Образуются между элементами значительно различающимися по строению и свойствам, когда сила взаимодействия между однородными атомами больше чем между разнородными. Каждая фаза имеет кристаллическую решетку, соответствующую данному компоненту.
2. Химические соединения образуются между элементами, значительно различающимися по строению и свойствам, если сила взаимодействия между разнородными атомами больше, чем между однородными.
3. Твердые растворы – это сплавы, в которых кристаллическая решетка построена из атомов двух или большего числа компонентов, при этом один из них является растворителем, а другой – растворимым. Твердый раствор имеет сильно деформированную кристаллическую решетку, тип которой соответствует типу решетки одному из образующих компонентов.
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом. Различные кристаллические формы одного вещества называются полиморфными модификациями. Полиморфные модификации обозначают строчными греческими буквами α, β, γ, δ.
В углеродистых сталях эти компоненты взаимодействуют, образуя, в зависимости от их количественного соотношения и температуры, разные фазы, представляющие собой однородные части сплава. Это взаимодействие заключается том, что углерод может растворяться как в жидком (расплавленном) железе, так и в различных его модификациях в твердом состоянии.
Кроме того, он может образовывать с железом химическое соединение. Таким образом, в углеродистых сталях различают следующие фазы:
Феррит – твердый раствор углерода и других примесей в α-железе (кристаллическая решетка – о.ц.к.). Предельная растворимость углерода – 0,02% в низкотемпературном феррите и 0,1% в высокотемпературном. Имеет невысокую прочность и твердость (НВ=800 МПа; σ = 250 МПа) и высокую пластичность.
Аустенит – твердый раствор углерода и других примесей в γ-железе (кристаллическая решетка – г.ц.к.). Предельная растворимость углерода – 2,14%. Механические свойства: НВ=1600-2000 МПа; σ = 500-800 МПа; δ = 40-50%.
Цементит – химическое соединение железа с углеродом – карбид железа Fe3C2, содержащий 6,67% углерода. Имеет очень высокую твердость (НВ=8000 Мпа) и очень малую пластичность.
Как следует из приведенных выше характеристик, главной составляющей стали, определяющей ее свойства, является углерод. С увеличением содержания углерода возрастают прочность и твердость стали, снижаются показатели пластичности (относительное удлинение и относительное сужение), а также ударная вязкость. При 0,8 % углерода прочность стали достигает максимального значения, после чего она начинает снижаться.
ACD – линия ликвидуса. Показывает температуру начала затвердевания сталей и чугунов.
AECF – линия солидуса. Показывает температуру конца затвердевания сплавов.
При охлаждении твердых сплавов в них происходят фазовые и структурные изменения, связанные с аллотропическими превращениями Fe и изменением растворимости в нем углерода. Эти изменения (фазовые превращения) в сплавах Fe-С характеризуют линии GSE, PSK, GPQ.
Источник: megalektsii.ru
Урок » Железо и его свойства»

Муниципальное казённое образовательное учреждение «Средняя общеобразовательная школа №4» г. Исилькуль, Омская область. Кирейто Наталья Михайловна учитель химии 1 категория.
Подробный конспект урока.
2.« Положение железа в периодической системе химических элементов и строение его атома». Презентация работы учащихся группы — Эксперты (Выясняем положение железа в ПСХЭМ, учащиеся записывают схему строения атома железа, проверяют правильность записи по слайду.
Формулируем вывод о свойствах железа на основе строения атома.) Что можно дополнительно сказать о железе на основании положения его в периодической системе химических элементов? ( Ученики сообщают: место положение Fe — 8 группа, побочная подгруппа, 4 большой период, d-элемент. Химическое знак – Fe. Порядковый номер – 26. Относительная атомная масса (Ar) – 56 Число протонов Z =26 число нейтронов N = 30. C тепень окисления +2, +3).
УЧИТЕЛЬ. А теперь я прошу вас написать строение атома, электронную и графическую формулы железа? ( к доске приглашается ученик).
Ученики составляют следующую запись:
Схема строения атома: Fe +26 )2 )8 )14 )2. 2 2 6 2 6 2 6 Электронная формула атома 1s 2s 2p 3s 3p 4s 3d. Вывод : железо – d-элемент, и наиболее устойчивые его соединения со степенью окисления +3 , т. к. данный ион Fe 3+ имеет наиболее устойчивый d-подуровень (5e–), а соединения Fe +2 устойчивы в кислой среде
3. Нахождение в природе. Презентация работы учащихся группы — Геологи
Учитель — Встречается ли железо в природе в чистом виде? Если нет, то в виде чего встречается?
- Железо может отдавать электроны, находящиеся на двух ( внешнем и предпоследнем) слоях.
Степень окисления железа зависит от окислительной способности
реагирующих с ним веществ.
- Железо, отдавая два внешних электрона, проявляет степень окисления +2;
- отдавая три электрона (два внешних и один сверхактивный с предпоследнего энергетического уровня), проявляет степень окисления +3.
- Fe-2e=Fe Fe-3e=Fe
- Железо проявляет восстановительные свойства.
Итак, химические свойства железа:
Исходя из знаний о химических свойствах металлов, как вы думаете, какими химическими свойствами будет обладать железо как простое вещество?
Взаимодействие с: неметаллами, кислотами, солями, водой.
А теперь давайте проведём лабораторную работу в виртуальном виде.
Учащиеся записывают уравнения реакций в тетради.
1.С кислородом во влажном воздухе образуется Fe 2 O 3 • nH 2 O
С кислородом проявляет степень окисления равную +2,+3
3 Fe +2 O 2= Fe 2 O 3 • FeO
2. C разбавленными H С l и H 2 SO 4 проявляет степень окисления равную +2
Fe +2 HCl = FeCl2 + H2
Fe + 2 H = Fe + H 2
3.Железо, реагируя с хлором, проявляет степень окисления равную +3
2 Fe +3 Cl 2=2 FeCl 3
4. C серой проявляет степень окисления равную +2
5. Железо вытесняет из растворов солей металлы, находящиеся в электрохимическом ряду напряжений правее железа :
С солями проявляет степень окисления равную +2
Fe +CuCl2 = FeCl2 + Cu
3 Fe +4 H 2 O = Fe 3 O 4 + 4 H 2
С HNO 3 (конц.) и H 2 SO 4 (конц.) не реагирует
при обычной температуре, но при нагревании реакция идёт с образованием сульфата железа, оксида серы ( или оксида азота) и воды
Fe + H2SO4 (k) = Fe2(SO4)3 + SO2 + H2O
Fe + 6 HNO3(k) = Fe(NO3)3 + 3NO2 + 3H2O
6. Биологическая роль железа .
Презентации работ учащихся (Приложение 6).
Беседа по вопросам:
– Какова роль железа в жизни человека и растений?
Проверка творческого домашнего задания.
Железо — это биогенный элемент.
Биохимики открыли важную роль железа в жизни растений, животных и человека. Входя в состав чрезвычайно сложно построенного органического соединения, называемого гемоглобином, железо обусловливает красную окраску этого вещества, от которого в свою очередь, зависит цвет крови человека и животных.
Гемоглобин состоит из двух частей: крупной белковой молекулы — глобина и встроенной в нее небелковой структуры — гема, в сердцевине которого и находится ион железа. Это железо легко вступает в связь с кислородом и именно соединение кислорода с железом окрашивает кровь в красный цвет.Кислород — это окислитель. Но союз кислорода и железа в гемоглобине — невероятное исключение.
Здесь никакого окисления не происходит. Ион железа как бы «берет за руку» молекулу кислорода и «ведет» ее к месту свершения действительного окисления и там ее «отпускает». За это свойство английский физиолог, один из основателей науки о дыхании Дж. Баркрофт, назвал гемоглобин «самым удивительным веществом в мире».
Кроме того, гемоглобин выполняет и другую очень важную функцию — выведение с места окисления углекислого газа. И если кислород вводится в клетку гемом, то углекислоту оттуда «выносит» глобин.
Таким образом, красные кровяные тельца, «набитые» миллионами молекул гемоглобина, выступают в роли автобусов, которые никогда не делают холостых пробегов: в одну сторону (от легких к клеткам) они «везут» кислород, а в другую (от клеток к легким) — «вывозят» углекислоту. Вот так все рационально устроено в природе! Но не весь кислород, доставленный гемоглобином, сразу же идет в дело.
Часть его остается в мышцах про запас. И вот для чего. В экстремальной ситуации, при повышенной физической нагрузке, когда мышцы начинают усиленно работать, им может не хватить доставленного кислорода, тогда они обратятся к своим запасникам. Роль таких запасников в мышцах играет другой гемосодержащий белок — миоглобин — «младший брат» гемоглобина. Впервые железо в крови человека было обнаружено в XIX в. Это открытие стало настоящей сенсацией.
( таблица на слайде)
– Какова роль железа и его сплавов в быту и промышленности?
Примерно 90% используемых человечеством металлов – это сплавы на основе железа. Железа выплавляется в мире очень много, примерно в 50 раз больше, чем алюминия, не говоря уже о прочих металлах. Сплавы на основе железа универсальны, технологичны, доступны, дешевы. Железу еще долго быть фундаментом цивилизации.
Проверка и оценивание ЗУНКов
Закрепление изученного материала
Самоконтроль с взаимопроверкой. Верно — неверно
Проверить на основе сопоставления с эталоном своё умение запоминать и ориентироваться в новом материале.
Используя опорную схему, записанную в тетради, сделайте вывод: что же представляет собой железо и каковы его свойства?
Графический диктант (заранее приготовить листочки с начерченной прямой, разделенной на 8 отрезков и пронумерованной соответственно вопросам диктанта. Отметить знаком «+» в таблице номер положения, которое считается верным).
Железо – это активный щелочной металл.
Источник: www.uchmet.ru
Что такое молекула?
На протяжении тысячелетий ученые размышляли над загадкой жизни, а именно над тем, из чего она создается? Согласно большинству древних культур, жизнь и все сущее состояли из основных элементов природы — Земли, Воздуха, Ветра, Воды и Огня. Однако со временем многие философы начали выдвигать идею о том, что все вещи состоят из крошечных неделимых вещей, которые нельзя ни создать, ни уничтожить (т.е. частицы).
Однако это было в значительной степени философское понятие, и только с появлением атомной теории и современной химии ученые начали постулировать, что частицы, взятые в сочетании, производят основные строительные блоки всех вещей. Молекулы, как они их называли, взяты из латинского «moles» (что означает тяжесть, глыба, громада, массивная структура — с уменьшительным суффиксом -cula). Но используемый в контексте современной теории частиц термин относится к малым единицам массы.
Определение:
По классическому определению молекула — это наименьшая частица вещества, сохраняющая химические и физические свойства этого вещества. Она состоит из двух или более атомов, группы подобных или различных атомов, удерживаемых вместе химическими силами.
В космосе обнаружены как простые, так и сложные органические (углеродосодержащие) молекулы. Углерод образуется в ядрах красных гигантских звезд, где он циркулирует на поверхности и распределяется в пространстве.

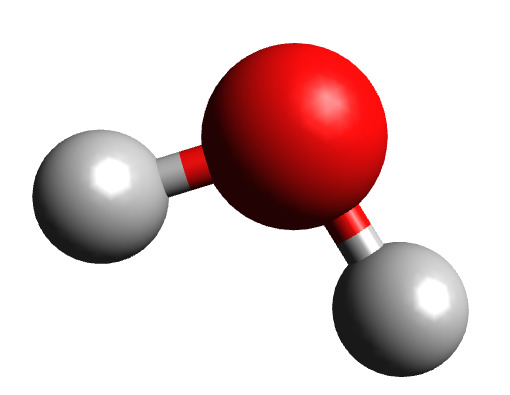
Она может состоять из атомов одного химического элемента, как в случае с кислородом (O2), или из различных элементов, как в случае с водой (H2O). Как компоненты материи, молекулы распространены в органических веществах (и, следовательно, в биохимии) и являются тем, что позволяет создавать жизнетворные элементы, таким как жидкая вода и воздухопроницаемые атмосферы.
Типы связей:
Молекулы удерживаются вместе одним из двух типов связей — ковалентными связями или ионными связями. Ковалентная связь — это химическая связь, которая включает обмен электронными парами между атомами. Связь, которую они образуют, является результатом стабильного баланса сил притяжения и отталкивания между атомами, известна как ковалентная связь.
Ионная связь, напротив, представляет собой тип химической связи, которая включает электростатическое притяжение между противоположно заряженными ионами. Ионы, участвующие в такой связи, — это атомы, которые потеряли один или несколько электронов (называемые катионами), и те, которые приобрели один или несколько электронов (называемые анионами). В отличие от ковалентности, этот перенос называется электровалантом.
В простейших формах ковелантные связи возникают между атомом металла (как катион) и атомом неметалла (анион), что приводит к таким соединениям, как хлорид натрия (NaCl) или оксид железа (Fe²O³), также известные как. соль и ржавчина. Однако могут быть сделаны и более сложные устройства, такие как аммоний (NH 4+) или углеводороды, такие как метан (CH 4) и этан (H 3 CCH 3).
История
Исторически молекулярная теория и атомная теория тесно переплетены. Первые упоминания о том, что материя состоит из “отдельных единиц”, появились в Древней Индии, где последователи джайнизма придерживались идеи, что все вещи состоят из мелких неделимых элементов, которые, соединяясь, образуют более сложные объекты.
В Древней Греции философы Левкипп и Демокрит ввели термин «атомос», имея в виду «мельчайшие неделимые части материи», от которых мы получаем современный термин «атом».
Затем в 1661 году натуралист Роберт Бойл в трактате по химии под названием «Скептический химик» утверждал, что материя состоит из различных комбинаций «корпускул» (устаревший термин для обозначения мельчайшей частицы материи), а не земли, воздуха, ветра, воды и огня. Однако эти наблюдения ограничивались областью философии.
Только в конце 18-го и начале 19-го веков Закон сохранения массы Антуана Лавуазье и Закон множественных пропорций Дальтона привели атомы и молекулы в область точной науки. Первые предположили, что элементы являются основными веществами, которые не могут быть подвергнуты дальнейшему разложению, в то время как последние предположили, что каждый элемент состоит из одного уникального типа атома и что они могут соединяться вместе, образуя химические соединения.

Еще одна находка пришла в 1865 году, когда Иоганн Йозеф Лошмидт измерил размер молекул, составляющих воздух, что дало ощущение масштаба молекул. Изобретение сканирующего туннельного микроскопа (СТМ) в 1981 году позволило впервые непосредственно наблюдать атомы и молекулы.
Сегодня наше понятие молекул получает дальнейшее развитие благодаря постоянным исследованиям в области квантовой физики, органической химии и биохимии. А когда речь заходит о поисках жизни в других мирах, необходимо понимание того, что нужно органическим молекулам, чтобы выйти из комбинации химических строительных блоков.
Источник: new-science.ru