КАРБИДЫ (от латинского carbo – уголь) – соединения углерода с металлами, а также с бором и кремнием. Эти соединения обладают удивительным разнообразием физических и химических свойств. Так, карбид золота Au2C2 взрывается уже при попытке пересыпать его с листочка фильтровальной бумаги, на котором он был высушен. С другой стороны, карбиды некоторых элементов (например, бора и тантала) не разлагаются даже при температуре белого каления и настолько химически инертны, что на них не действует царская водка, а по твердости они приближаются к алмазу!
Также по теме:
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ
Впервые необычное соединение металла с углеродом (К2С2) получил в 1809 знаменитый английский химик Гемфри Дэви. В 1863 французский химик Марселен Бертло изучил свойства другого карбида – очень неустойчивого и легко взрывающегося карбида одновалентной меди Cu2C2.
В 1878 немецкий металлург Ф.Мюллер, растворив образцы стали в разбавленной серной кислоте, выделил карбид железа Fe3C. Но только в конце 19 в. французский химик Анри Муассан, прославившийся получением фтора, синтезировал многие из этих необычных соединений и изучил их свойства. Он получал карбиды, нагревая до очень высокой температуры смеси древесного угля с разными металлами, их оксидами или карбонатами. Для этого он использовал жар вольтовой дуги в электрической печи собственной конструкции.
55. Реакция карбида кальция с водой и образование ацетиленидов
Карбиды, как оказалось, можно получить не только в лаборатории. Еще до работ Муассана австрийский ученый Э.Вайнсхенк в 1889 открыл в метеоритах минерал когенит, представляющий собой смешанный карбид железа, кобальта и никеля состава (FeNiCo)3C. А сам Муассан в 1904 обнаружил в метеорите, привезенном из каньона Диабло в штате Аризона, темно-зеленый минерал, представляющий собой карбид кремния SiC. Этот минерал в честь ученого назвали муассанитом.
Также по теме:
Раньше карбиды классифицировали по их устойчивости к действию воды и кислот, а также по тому, какие газы выделяются при их разложении. Современная классификация учитывает тип химической связи между атомами в карбидах – именно от этого зависят в основном физические и химические свойства. В соответствии с этой классификацией, карбиды можно разделить на три группы, которые довольно сильно отличаются по своим свойствам.
К первой группе относятся так называемые солеобразные карбиды с ионной связью. Эти карбиды образуют щелочные и щелочноземельные металлы, алюминий, редкоземельные элементы, а также актиноиды. Их состав иногда соответствует типичным валентностям металлов (Al4C3), а иногда – нет (Ве2С).
Многие ионные карбиды можно получить непосредственно из элементов (Са + 2С ® СаС2) или восстановлением оксидов углеродом (СаО + 3С ® СаС2 + СО). Ионный характер связи приводит к высокой температуре плавления; например, карбид кальция СаС2 плавится при 2300° С, карбид тория ThC2 – при 2655° С. Водой или разбавленными кислотами ионные карбиды легко разлагаются – гидролизуются.
При этом образуются различные углеводороды и гидроксид металла. Самый известный пример – получение ацетилена гидролизом карбида кальция: СаС2 + 2Н2О ® Ca(OH)2 + С2Н2. Ацетилен выделяется также при гидролизе Na2C2, К2С2 и др.
Реакция CaC2 с водой и образование ацетиленидов
Поэтому такие карбиды можно рассматривать как производные ацетилена, в которых атомы водорода замещены атомами металла. При этом катионы металла и анионы С2 –2 размещаются в соответствующих узлах кристаллической решетки. Солеобразный характер этих карбидов подтверждается возможностью их электролиза в расплавленном состоянии. Интересно отметить, что чистый карбид кальция – бесцветные кристаллы, хотя увидеть их непросто, так как обычный технический продукт имеет цвет от бурого до черного.
Взаимодействие карбидов щелочных металлов с водой протекает исключительно бурно. Так, если карбид калия просто облить водой, произойдет бурная реакция, которая сопровождается взрывом такой силы, что выделяющийся ацетилен сразу же разлагается с выделением угля. Чтобы провести реакцию К2С2 + 2Н2О ® 2КОН + С2Н2, надо медленно пропускать над карбидом водяной пар.
В ряде случаев карбиды ионного типа образуются непосредственно при пропускании ацетилена через растворы солей металлов. Так карбиды серебра, меди(I), золота и ртути, которые чаще называют ацетиленидами. Ацетилениды щелочных металлов можно получить действием ацетилена на свободные металлы. В сухом виде ацетилениды тяжелых металлов легко разлагаются со взрывом.
Гидролиз ионных карбидов других металлов показывает, что они «происходят» из других углеводородов. Например, при гидролизе карбида алюминия выделяется метан: Al4C3 + 12H2O ® 4Al(OH)3 + 3CH4 (так же гидролизуется карбид бериллия Ве2С), а при гидролизе карбида магния получается метилацетилен: Mg2C3 + 4H2O ® 2Mg(OH)2+ НС≡С–СН3.
Интересно, что карбид магния другого состава, MgC2, дает при гидролизе только ацетилен. Иногда при гидролизе ионных карбидов углеводороды выделяются совместно с водородом, который частично гидрирует непредельные углеводороды. С выделением почти равных количеств водорода и метана разлагается карбид марганца: Mn3C + 6H2O ® 3Mn(OH)2 + CH4 + H2.
Карбиды редкоземельных металлов и тория при разложении разбавленными кислотами выделяют не чистый ацетилен, а его смесь с метаном, этиленом и другими углеводородами. Например, при гидролизе карбида церия СеС2 получается смесь ацетилена с метаном в соотношении 4:1, а также немного этилена и жидких и твердых углеводородов (состав продуктов зависит от условий проведения реакции). Еще больше жидких и твердых углеводородов дает при гидролизе карбид урана.
Выделение углеводородов при гидролизе карбидов позволило Д.И.Менделееву выдвинуть так называемую карбидную теорию происхождения нефти в глубинах Земли из неорганических веществ. По представлению Менделеева, в глубинах земного шара должны быть расплавленные металлы, в основном железо, которое с углеродом дает карбид.
Во время горообразования в земной коре образуются трещины, по которым в глубины проникает вода. Воздействуя на карбид железа и карбиды других металлов, вода (в виде пара) образует углеводороды, например: 2FeC + 3H2O ® Fe2O3 + C2H4. Газообразные углеводороды по тем же трещинам поднимаются ближе к поверхности, где скапливаются в пористых пластах.
Однако когда в 60-е гг. 20 в. был подробно изучен состав углеводородов нефти, оказалось, что смесь «искусственных углеводородов», образующихся при гидролизе карбидов, по своему составу резко отличается от природной смеси. Кроме того, все нефти, полученные неорганическим путем, оптически неактивны, тогда как природная нефть оптически активна. На основании этих, а также ряда других фактов неорганическая теория происхождения нефти была подвергнута критике, и в настоящее время многие ученые полагают, что нефть имеет биологическое происхождение.
Ко второй группе относятся карбиды, которые образуют переходные металлы IV–VII групп, а также кобальт, железо и никель. Это металлоподобные соединения с другой структурой. В них атомы углерода, имеющие небольшие размеры, не связаны друг с другом и располагаются в пустотах между атомами металлов.
Различная упаковка атомов металла в кристаллической решетке приводит к разному составу карбидов даже для одного и того же металла; например, хром образует карбиды состава Cr3C2, Cr4C, Cr7C3 и др. Эти карбиды (их называют карбидами внедрения) часто отличаются большой твердостью и очень высокими температурами плавления. Например, карбиды тантала и гафния TaC и HfC – наиболее тугоплавкие из известных веществ (плавятся при 3985 и 3890° С соответственно).
Металлоподобные карбиды обладают высокой электропроводностью и очень высокой химической стойкостью к агрессивным средам (многие из них не растворяются даже в царской водке). Они используются для упрочнения чугуна и стали (карбиды железа, хрома, вольфрама, молибдена), а также для производства очень твердых сплавов, которые применяют для обработки металлов резанием (карбиды WC, TiC, TaC, VC, Cr3C2). Например, твердые наконечники резцов, сверл делают из победита – спеченного порошка карбида вольфрама WC с добавкой металлического кобальта. Очень важную роль играет карбид железа Fe3C (цементит) – твердые кристаллы, входящие в структуру чугуна и стали.
Карбид вольфрама WC используют также для изготовления буровых коронок, деталей аппаратуры для производства синтетических алмазов, для нанесения износостойких покрытий на поверхности металлов. Карбид титана интересен ярким проявлением нестехиометрии: состав этого соединения выражается формулой TiCх, где х колеблется в пределах от 0,49 до 1 (см. СТЕХИОМЕТРИЯ). Это вещество, как и карбид вольфрама, используют как компонент жаропрочных, жаростойких и твердых сплавов, для получения износостойких покрытий, для изготовления тугоплавких тиглей, в которых можно плавить почти любые металлы (сам карбид плавится при 3257° С). Карбидом титана выкладывают внутренние стенки высокотемпературных печей.
К третьей группе относятся ковалентные карбиды. Их образуют кремний и бор – соседи углерода по периодической таблице, близкие к нему как по размеру атомов, так и по электроотрицательности. Карбид кремния SiC (техническое название – карборунд) в чистом виде – бесцветные кристаллы, но примеси часто окрашивают его в различные цвета, вплоть до черного.
По своей структуре это соединение аналогично алмазу; решетку карбида кремния можно получить, если в немного расширенной решетке алмаза заменить половину атомов углерода на атомы кремния. Это вещество обладает очень высокой твердостью; помимо этого оно имеет свойства полупроводника. Из него делают шлифовальные бруски и круги, огнеупорные материалы для печей и литейных машин, нагревательные элементы для электропечей, полупроводниковые диоды.
Бор образует по два карбида с точно известной структурой – В4С и В13С2. Наибольшее значение имеет первый из них – черные блестящие кристаллы, которые по твердости уступают лишь алмазу и нитриду бора BN. Этот карбид применяют для изготовления абразивных и шлифовальных материалов и в качестве полупроводника. Карбид, обогащенный изотопом 10 В, используется как поглотитель нейтронов в ядерных реакторах.
Источник: www.krugosvet.ru
bskamalov
Э. нет , батенька! Что же Вы так не внимательно информацию собираете, уж надо было узнать как получают карбид кальция!
К сожалению — Впервые получен в 1862 году Ф. Вёлером нагреванием сплава цинка и кальция с углём.
В настоящее время получают прокаливанием в электрических печах (температура 1900—1950 °C) смеси оксида кальция с коксом.
+CO>>> <mathsf +CO>>
Полученный таким образом технический продукт имеет грязную окраску вследствие загрязнения углём и другими красящими примесями. Он содержит также примеси фосфида и сульфида кальция, вследствие чего такой карбид кальция и полученный из него ацетилен имеют неприятный запах.
В любом случае это коксохимия!
Вы это ПРОЧИТАЛИ у придуркопедов ? Вы не считаете что Вам гонят лажу ? Вы считаете что народ придурок и брал бы на покраску стен — потолков карбид с загрязнением ?
Я персонально в начале 1980-х видел как этот самый карбид получают в очень ЧИСТОМ виде чурки в зачуханой деревне ККАССР.
Процесс очень прост:
1. Из мраморного карьера берутся отходы производства куски мрамора размером с кулак
2. Куски мрамора складывается в огромную печь типа тандыр (у них там все на тандыре готовят, лепешки, карбид, ракетное топливо . )
3. В самом низу две стальные трубы типа газовая горелка
4. После закладки входное отверстие заделывают, остается только верхнее отверстие для выпуска газов
5. Горелка зажигается просто, чуток открыли крантик и кинули внутрь факел, само вспыхнет.
6. Ждем несколько дней.
7. Тушим горелку. Открываем нижнее отверстие, ждем когда готовый карбид чуток остынет.
8. Торгуем карбид мешками.
Нужно выбирать куски очень легкие и желательно сверху горелки, то есть кто первый прибыл к разбору, тот закупает лучшее.
Могу смоделировать процесс в глыбь истории. Как всегда народ просто увеличивает нечто как в «большие деньги» из фильма «Абдуладжон» 1995 года. То есть валялся кусок мрамора в тандыре , пекли олепешки и со временем этот камень вдруг стал шипеть когда тандыр сбрызгивали водой.
ЭВРИКА . Сделаем большой тандыр . Процесс пошел.
В окопах 1 МВ карбид скорее всего получаали в обычных окопных печах :

French Trench Kitchen WW1

Kitchen in the trench. WW1
Мел под ногами, накопали чуток и сунули в духовочку, через какое то время мрамор обезвожится и вуаля, боеприпасы готовы .
Источник: bskamalov.livejournal.com
Карбид кальция: свойства и применение. Получение ацетилена
Карбиды – это группа неорганических соединений углерода с металлами, а также с кремнием или бором (поскольку эти элементы проявляют металлические свойства). Карбид кальция – одно из наиболее востребованных веществ этой группы. О свойствах и применении соединения читайте ниже.
История получения
Карбид кальция – соединение, получившее широкое применение в современной промышленности. В 1862 году немецкий химик Фридрих Велер впервые синтезировал молекулу этого вещества. Получение карбида кальция он осуществил следующим образом. Ученый приготовил расплав кальция с цинком, а затем нагрел его с углем. В результате получился карбид.
Химическая формула соединения – CaC2. Промышленный способ получения карбида предложил ученый Муассан в 1892 году. Другие названия вещества – ацетиленид кальция, или углеродистый кальций. Кристаллическая решетка соединения выглядит следующим образом:
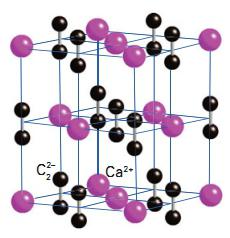
Физические свойства
По своим физическим свойствам карбид кальция является кристаллическим веществом с температурой плавления 2300 о С. Эта цифра является справедливой лишь для чистого соединения. Карбид, содержащий примеси, может иметь другие показатели температуры плавления. Основное агрегатное состояние вещества – твердое, а цвет варьирует от серого до коричневого.
Химические свойства
Карбид кальция хорошо впитывает воду. Этот процесс сопровождается химической реакцией разложения. Важно, что карбидная пыль обладает раздражающим действием на слизистые оболочки, кожу и органы дыхания. Поэтому во время работы с соединением необходимо использовать противогазы либо противопылевые респираторы.
С кислородом карбид кальция взаимодействует при высокой температуре с образованием карбоната кальция. Реакция с азотом приводит к синтезу цианамида кальция. Также при высоких температурах карбид кальция вступает в реакции соединения с хлором, фосфором, мышьяком. Но все-таки одним из важнейших свойств соединения считается разложение водой.

Получение
Производство карбида кальция заключается в следующем. Негашеную известь и предварительно измельченный кокс смешивают. Полученную смесь подвергают расплавлению в электрических печах. Кокс и оксид кальция берутся в равных по массе частях. Процесс происходит при температуре 1900 о С. Расплав выходит из печи и в дальнейшем разливается по специальным формам.
Затем уже затвердевший карбид кальция дробят и сортируют по размеру кусков. Гранулы вещества разделяются на четыре фракции в соответствии с их размерами: 25×80, 15×25, 8×15, 2×8, которые определяются ГОСТом 1460-56. По своему составу технический карбид кальция содержит 75-80% основного вещества.
На долю примесей, таких, как углерод, известь и других, приходится до 25% от общей массы полученной смеси. Кроме того, содержащийся в техническом карбиде сульфид и фосфид кальция обусловливают довольно неприятный его запах. Представим реакцию получения СаС2: СаО + 3С → СаС2 + СО↑. Образование ацетиленида кальция сопровождается поглощением тепла. Поэтому логично предположить, что реакция его разложения, напротив, идет с выделением энергии.

Транспортировка и хранение
По причине того, что влага моментально разлагает карбид с выделением большого количества тепла и образованием взрывоопасного газа ацетилена, хранить вещество необходимо в герметично закупоренных барабанах или бидонах. Следует помнить, что ацетилен легче воздуха и способен скапливаться в верхних зонах помещения.
Этот газ, помимо наркотического действия, обладает способностью к самовоспламенению. Поэтому использовать карбид кальция необходимо с большой осторожностью. Расфасовке на производстве уделяется особое внимание. Готовое вещество помещается в специальные барабаны (тара, напоминающая консервные банки). Такая упаковка требует аккуратного вскрытия.
При этом должен использоваться инструмент, не приводящий к образованию искр (молоток или специальный нож). В случае попадания карбида на кожу или слизистые оболочки необходимо немедленно промыть пораженный участок водой и обработать место вазелином или жирным кремом. Транспортировка соединения осуществляется с использованием только крытых видов транспорта.
Воздушная доставка карбида запрещена. Помещения, где хранится СаС2, должны быть хорошо проветриваемыми. Также не разрешается хранить карбид совместно с другими химическими веществами. Это может привести к нежелательным, а, возможно, и опасным, реакциям. Срок хранения карбида составляет полгода.

Применение
Область применения карбида кальция чрезвычайно широка. В первую очередь это промышленный синтез. Карбид кальция используется для производства синтетического каучука, уксусной кислоты, ацетона, этилена, винилхлорида, стирола. Также он находит применение в получении цианамида кальция. Это вещество ценно своим использованием в синтезе различных удобрений и цианистых веществ.
В сельском хозяйстве любому агроному известно такое название, как карбидно-карбамидный регулятор. Он применяется для регуляции роста растений. А для его получения также используется карбид кальция. Кроме того, это соединение находит применение в процессе производства цианамида кальция. Эта реакция основана на нагревании карбида кальция с азотом.
Восстановление щелочных металлов также не обходится без применения описываемого нами вещества. Карбид кальция применяется и в процессе газосварки. Например, широко используются карбидные лампы. Принцип их работы основан на взаимодействии в специальной емкости карбида с водой и сгорании на выходе из аппарата конечного вещества реакции – ацетилена. Посмотрите на фото карбидной лампы.

Производство ацетилена
Одной из важнейших областей применения карбида кальция является его использование в получении ацетилена. Заслуга в открытии этого способа также принадлежит немецкому ученому-химику Фридриху Велеру. В основе этого промышленного процесса лежит реакция разложения карбида под воздействием воды. СаС2 + 2 Н2О → С2Н2 + Са(ОН)2↓.
На выходе образуется газ ацетилен и гашеная известь, выпадающая в осадок. Процесс сопровождается выделением большого количества тепла. Объем газа на выходе зависит от того, насколько чистый используется для реакции карбид кальция. Ацетилен, образующийся в результате, может иметь различный объем – 1 кг исходного вещества может дать от 235 до 290 литров газа.
Что касается скорости протекания реакции, то она зависит как от малого процента примесей в карбиде кальция, так и от температуры воды, а также ее чистоты. Если рассматривать теоретическую реакцию производства ацетилена из карбида, то в ней на 1 кг карбида достаточно 560 мл воды. Однако на практике объем воды для проведения реакции увеличивается.
На 1 кг карбида кальция в условиях промышленного синтеза требуется от 5 до 20 литров воды. Такое количество необходимо для того, чтобы ацетилен лучше охлаждался, а также для обеспечения оптимальной безопасности при работе. Ниже изображен немецкий химик Фридрих Велер.

Лабораторный опыт получения ацетилена
Многим из школьных уроков химии знакома реакция взаимодействия карбида с водой. Обычно этот опыт позволяет продемонстрировать реакцию получения ацетилена, а также физические и химические его свойства. Процесс выделения газа при этом происходит достаточно бурно, поэтому трубка, отводящая ацетилен из колбы с действующими веществами, помещается в чашу с водой.
Это обеспечивает менее активное и стремительное движение газа. Кроме того, в лабораторных условиях можно использовать и другой способ, чтобы сделать не слишком бурной реакцию разложения такого соединения, как карбид. Ацетилен при этом идет равномерно и спокойно. Для этого вместо воды необходимо взять насыщенный раствор поваренной соли. Также в лаборатории при проведении этой реакции следует осторожно добавлять воду в карбид, помещенный в объемную колбу, а не наоборот.
Источник: www.syl.ru