Контрольная работа № 7 по химии в 9 классе «Металлы» с ответами для УМК Рудзитис, Фельдман. Автор работы: Т.А.Боровских. Цитаты из пособия использованы в учебных целях. Химия 9 Рудзитис Контрольная работа 7.
Контрольная работа № 7
«Металлы» (9 класс)
КР-7. Вариант 1
- 1) Составьте электронную формулу и схему распределения электронов по орбиталям атомов натрия.
2) Какие степени окисления натрий проявляет в соединениях? Составьте формулы высшего оксида и гидроксида, а также гидрида натрия.
3) Расположите символы химических элементов (Na, Rb, Li, Cs, К) в порядке:
а) возрастания атомного радиуса
б) возрастания восстановительной способности
в) ослабления основных свойств образуемых гидроксидов. - Какой вид химической связи и тип кристаллической решётки у кальция? Используя значки изобразите схему строения кристалла кальция.

- Из перечисленных металлов — натрий, хром, серебро, ртуть — выберите самый
1) электропроводный _______; 2) пластичный ________; 3) хрупкий ________; 4) тяжёлый ________; 5) мягкий ________; 6) твёрдый _______; 7) легкоплавкий ________. - Приведите пример металла, встречающегося в природе только в виде соединений _______________. Как такой металл получают? Приведите соответствующее уравнение реакции.
- Изучите схему, описывающую химические свойства металлов (см. табл. 28 в учебнике). Приведите по одному примеру для каждой группы реакций. Составьте уравнения соответствующих реакций.
- а) Закончите уравнения реакций:
1) МоO3 + H2 →t→ _________; 4) Zn + NaOH + H2O →t→ _________;
2) К + O2 →t→ __________; 5) Сu + HNO3(конц.) →t→ __________;
3) Fe3O4 + Mg →t→ __________; 6) Аl + H2O →t→ ___________.
б) Хлорид меди(II) можно получить: 1) взаимодействием гидроксида меди(II) с соляной кислотой; 2) растворением в соляной кислоте предварительно обожжённой на воздухе меди; 3) при горении меди в хлоре. Составьте уравнения реакций, укажите, какие из них окислительно-восстановительные. Определите окислитель и восстановитель. Для реакции ионного обмена составьте сокращённое ионное уравнение. - 1) Рассмотрите рисунок. Поясните причину возникновения накипи на чайнике. Какие процессы происходят при кипячении воды? Составьте уравнение реакции. Что такое жёсткость воды? Что такое временная жёсткость?
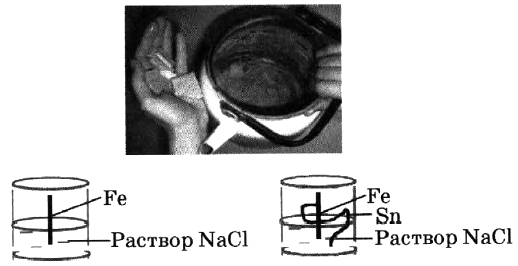 2) Что такое коррозия металлов? Перед вами рисунок, на котором изображены два стакана. Какие реакции будут происходить там? В каком стакане реакция прошла быстрее? Почему?
2) Что такое коррозия металлов? Перед вами рисунок, на котором изображены два стакана. Какие реакции будут происходить там? В каком стакане реакция прошла быстрее? Почему? - 1) В пробирку с раствором соли X добавили вещество Y. В результате реакции наблюдали образование металла, имеющего в слитке красный цвет. Из предложенного перечня веществ выберите вещества X и Y, которые могут вступать в описанную реакцию: 1) карбонат калия; 2) сульфат меди(II); 3) цинк; 4) калий. Составьте уравнение реакции: _____________________
2) В четырёх пронумерованных пробирках находятся растворы хлоридов магния, железа(II), алюминия и натрия. Как идентифицировать эти вещества? Составьте план эксперимента и уравнения соответствующих реакций.
Хром — Самый ТВЕРДЫЙ МЕТАЛЛ НА ЗЕМЛЕ!
УРАНОВЫЙ ЛОМ В РТУТИ / классика и оригинал
| Реактив | FeCl2 | MgCl2 | NaCl | АlСl3 |
| 1) | ||||
| 2) | ||||
| 3) | ||||
| 4) |
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1) FeS2 → Fe2O3 → Fe → FeCl2 → Fe(OH)2 → FeSO4
2) Металл красного цвета сожгли в хлоре, а продукт реакции растворили в воде. В полученный раствор добавили щёлочь, выпавший осадок синего цвета отфильтровали и прокалили, при нагревании продукта прокаливания чёрного цвета с коксом был получен исходный металл.
3) Даны вещества: СаСO3, СuО, растворы NaOH, K2SO4, HNO3, H2O2, СаСO3. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид меди(II). Опишите признаки проводимых реакций. Для одной реакции напишите сокращённое ионное уравнение реакции. - Рассчитайте:
1) массу оксида лития, который образуется при сжигании в кислороде 4,2 г лития.
2) массу алюминия, требуемого для получения водорода (н.у.) из соляной кислоты, необходимого для восстановления оксида меди(II), образовавшегося при разложении 63,7 г гидроксида меди(II).
3) массовую долю металлов в смеси алюминия и меди при взаимодействии 10 г смеси с избытком раствора серной кислоты. При этом выделился водород объемом 6,72 л (н. у.).
Указания по решению заданий Варианта 1:
№ 1. 1) 2; 8; 2; 2) +1, Na2O; NaOH; NaH; 3) a) Li, Na, К, Rb, Cs; б) Li, Na, K, Rb, Cs.
№ 2. Металлическая.
№ 3. 3124124.
№ 4. —.
№ 5. —.
№ 6. a) 1) MoO3 + 3H2 → Mo + 3H2O; б) 1) Cu(OH)2 + 2HCl = CuCl2 + 2H2O.
№ 7. 1) B воде растворены гидрокарбонаты кальция и магния. Они неустойчивы к нагреванию;
2) необходимо сравнить активность металлов, в первую очередь разрушается более активный металл.
№ 8. 1) сульфат меди(II) + цинк; 2) У этих солей разное отношение к раствору щёлочи. Соединения железа(+2) легко окисляются кислородом воздуха и меняют цвет.
№ 9. 1) +O2; +СО; +НСl; +NaOH; +H2SO4;
2) Сu + Cl2 = СuCl2; СuCl2 + 2NaOH = Сu(ОН)2 + 2NaCl; Сu(ОН)2 = СuО + H2O; СuО + С = Сu + СО;
3) СuО + HNO3 →; Cu(NO3)2 + NaOH →.
№ 10. 1) 9 г; 2) 11,7 г; 3) 54%.
Указания по решению заданий Вариантов 2 и 3:
Открыть ОТВЕТЫ на Вариант 2
Источник: uchitel.pro
Из перечисленных металлов — натрий, хром, серебро, ртуть — выберите самый 1) электропроводный
2) пластичный
3) хрупкий
4) тяжелый
5) мягкий
6) твёрдый
П) легкоплавкий

а почему учитель это делает? конечно,он не имеет право снижать .ты должен обратиться к директору.или у тебя не достаточно знаний по мнению учителя,ведь -это сложный урок.но в любом случае обратись к директору! )

Ответ разместил: 27sergey1
ответ:электропроводный алюминий, легкоплавкий ртуть, натрий пластины, мягкий, хром тяжелый
Похожие вопросы:

Химия, 13.03.2019 22:31
Чем различаются отбеливающее моящее средство от цветного моящего средства? в , свойства, состав

Химия, 14.03.2019 11:04
Какой объем сероводорода надо растворить в воде чтобы получить по массе 2 % раствор

Химия, 19.03.2019 14:21
Який об”єм спирту (густина 0,8г/мл) можна добути в результаті бродіння 80 кг суміші, що містить 80% глюкози, якщо вихід спирту – 80%?

Химия, 20.03.2019 11:32
1)ферум(2) сульфат + магний карбонат2)хром(2) оксид + карбон (4) оксд

Химия, 20.03.2019 15:22
9.где не выделяется свободный металл?

Химия, 21.03.2019 10:01
Найти объем кислорода и массу образующегося оксида меди 2 при сгорании меди массой 350гр и массовой долей примесей 36%

Химия, 21.03.2019 23:41
Яка сіль і якої маси утвориться при пропусканні продуктів згоряння пентану об’ємом 21,5 л через розчин натрій гідроксиду. скорі

Химия, 29.03.2019 09:45
Составьте уравнения реакций между высшими тех элементов, которые, на ваш взгляд, должны взаимодействовать. у меня 55 , забирайте все.

Химия, 01.04.2019 20:06
Як готується стандартний розчин точної концентрації? 1. за наважкою, що взяли на аналітичних терезах і розчинили у циліндрі. 2. за наважкою, що взяли на технічних терезах і розчинили у циліндрі. 3. наважку беруть на аналітичних терезах і розчиняють у мірній колбі.
4. наважку беруть на технічних терезах і розчиняють у мірній колбі. іі. чому дорівнює молярна маса еквівалента na2co3 при взаємодії з нсі? 1. м/2 – при нейтралізації до н2со3. 2. м – при нейтралізації до н2со3. 3. м – при нейтралізації до гідрокарбонату.
4. м/2 – при нейтралізації до гідрокарбонату. ііі. напишіть рівняння стандартизації нсі за тетраборатом натрію у молекулярному вигляді. чому дорівнює сума коефіцієнтів рівняння? 1. 6. 2. 9. 3. 12. 4. 14. іv. від чого залежить забарвлення індикаторів методу нейтралізації? v. скільки мілілітрів 20 %-ї h2so4 густиною 1,14 г/см3 необхідно взяти для приготування 500,0 мл 0,2м розчину цієї кислоти? 1. 12,2. 2. 10,7.
3. 21,4. 4. 43,0. vі. як можна відтитрувати хлорид амонію (pk(nh4oh)=4,8)? 1. прямим титруванням нсі. 2. прямим титруванням гідроксидом натрію. 3. методом заміщення: заміщують сіль амонію лугом, який титрують розчином нсі. 4. методом заміщення: заміщують сіль амонію кислотою, яку титрують гідроксидом натрію.
5. методом зворотного титрування: залишок гідроксиду натрію, що не прореагував з nh4cl, титрують соляною кислотою. 6. методом зворотного титрування: залишок нсі, що не прореагував з nh4cl, титрують гідроксидом натрію vіі. чому дорівнює рн суміші 0,м розчину оцтової кислоти і 0,1м розчину ацетату натрію (pk(ch3cooh)=4,8)? 1. 3,8. 2. 4,8. 3. 5,8. 4. 8,4.
5. 2,9. vііі. у яких реакціях може бути використаний індикатор метиловий червоний (рт=5) для фіксування точки еквівалентності? 1. naoh + hcl. 2. nh4oh + hcl. 3. naoh + ch3cooh. 4. na2b4o7+hcl. іх. як титрується винна кислота, якщо дві її константи дисоціації такі: k1=9,1∙10-4, k2=4,3∙10-5? 1. відтитрувати не можна, тому що не фіксуються точки еквівалентності.
2. можна відтитрувати тільки до кислої солі.3. можна відтитрувати тільки до середньої солі.4. можна відтитрувати як до кислої, так і до середньої солі. х. визначити молярну концентрацію розчину нсі, якщо на титрування хімічно чистого карбонату натрію масою 0,1946 г витрачається 20,45 мл цього розчину. 1. 0,1795. 2. 0,08977. 3. 0,04487. 4. 0,09700.

Химия, 02.04.2019 16:37
Какие ионы ca2+ или ca- будут оказывать коагулирующее действие на золь agcl, если стабилизатором является kcl

Химия, 02.04.2019 18:47
39 ! в пробирках находятся растворы сахарозы, глюкозы, глицерина, мыла и крахмала. составить план распознавания веществ. обязательно ухр (реакции).
Источник: otvetovik.com
Из перечисленных металлов — натрий, хром, серебро, ртуть — выберите самый 1) электропроводный
2) пластичный
3) хрупкий
4) тяжелый
5) мягкий
6) твёрдый
П) легкоплавкий


Mr(H2SO4)=Ar(H)*2+Ar(S)+Ar(O)*4=1*2+32+16*4=98

Ответ оставил: Гость

Дано
m(HCL) = 40 g
m(C2H2) = 11.2 g
η = 70%
—————————
m(C2H3CL)-?
M(HCL)= 36. 5 g/mol
n(HCL) = m/M= 40 / 36.5 = 1.09 mol
M(C2H2)= 26 g/mol
n(C2H2) = m/M = 11.2 / 26 = 0.43 mol
n(HCL) > n(C2H2)
HCL+C2H2—>C2H3CL
n(C2H2) = n(C2H3CL) = 0.43 mol
V(C2H3CL) = n*Vm = 0.43*22.4 = 9.632 L — теорет.объем
V(C2H3CL) = V*η / 100% = 9.632*70% / 100% = 6.74 L
ответ 6.74 л

Ответ оставил: Гость

М(ВаСО3)=137+12+16*3=197г/моль
Другие вопросы по химии

Химия, опубликовано 09.01.2019 16:01

Химия, опубликовано 09.01.2019 16:01

Химия, опубликовано 09.01.2019 16:01

Химия, опубликовано 09.01.2019 16:01
✅ Ответов: 1 на вопрос по химии: Из перечисленных металлов — натрий, хром, серебро, ртуть — выберите самый 1) электропроводный2) пластичный3) хрупкий4) тяжелый5) мягкий6) твёрдыйП) легкоплавкий. ты найдешь на сайте. Также ты можешь добавить свой вариант ответа, если считаешь, что он не верен или твой ответ более полный. Пожалуйста, добавляй только правильные ответы.
Источник: yznay.com