Концентрированная соляная кислота – это бесцветный раствор, сильно дымящий во влажном воздухе, с резким запахом.
Получение соляной кислоты:
Соляная кислота HCl получается при растворении газа хлороводорода воде. Хлороводород можно получить действием концентрированной серной кислоты на поваренную соль.
NaCl + H 2 SO 4 = HCl↑ + NaHSO 4 (хлороводород + гидросульфат натрия)
Химические свойства:
Раствор хлороводорода в воде — соляная кислота — сильная кислота:
1) реагирует с металлами , стоящими в ряду напряжений до водорода:
2Al + 6HCl = 2AlCl 3 + 3H 2
3) с оксидами металлов :
MgO + 2HCl = MgCl 2 + H 2 O
4) с основаниями и аммиаком :
HCl + KOH = KCl + H 2 O
5) с солями :
Образование белого осадка хлорида серебра — AgCl, нерастворимого в минеральных кислотах используется в качестве качественной реакции для обнаружения анионов Cl — в растворе.
Хлориды металлов — соли соляной кислоты, их получают взаимодействием металлов с хлором или реакциями соляной кислоты с металлами, их оксидами и гидроксидами; путем обмена с некоторыми солями
CaO + 2HCl = CaCl 2 + H 2 O
Большинство хлоридов растворимы в воде (за исключением хлоридов серебра, свинца и одновалентной ртути).
Применение соляной кислоты и ее солей:
1. Соляная кислота входит в состав желудочного сока и способствует перевариванию белковой пищи у человека и животных.
2. Хлороводород и соляная кислота используются для производства лекарств, красителей, растворителей, пластмасс.
3. Применение основных солей соляной кислоты:
KCl — удобрение, используется также в стекольной и химической промышленности.
HgCl 2 — сулема — яд, используется для дезинфекции в медицине, для протравливания семян в сельском хозяйстве.
Hg 2 Cl 2 — каломель — не ядовита, слабительное средство.
NaCl — поваренная соль — сырье для производства соляной кислоты, гидроксида натрия, водорода, хлора, хлорной извести, соды. Применяется в кожевенной и мыловаренной промышленности, в кулинарии и консервировании.
ZnCl 2 — для пропитки древесины против гниения, в медицине, при паянии.
AgCl — применяется в черно-белой фотографии, так как обладает светочувствительностью — разлагается на свету с образованием свободного серебра: 2AgCl = 2Ag + Cl 2
Задания для повторения и закрепления
№1. Осуществите превращения по схеме:
№2. Расставьте коэффициенты методом электронного баланса в следующей реакции:
Укажите окислитель и восстановитель; процессы окисления и восстановления.
Какое количество алюминия прореагирует с избытком соляной кислоты для получения 5,6 л водорода (н.у.)?
Источник: sites.google.com
HCl + AgCl = ? уравнение реакции
Составьте химическое уравнение по схеме HCl + AgCl = ? Запишите уравнение в ионном виде, если это возможно. Дайте краткую характеристику физических и химических свойства хлорида серебра, приведите способы его получения.
Xumuk Админ. ответил 6 лет назад
Хлорид серебра образуется в виде белого творожистого нерастворимого в воде и кислотах осадка (значит в реакцию взаимодействия с хлороводородом [HCl + AgCl = ?] не вступает) при взаимодействии ионов серебра с хлорид-ионами. На свету хлорид серебра постепенно темнеет, разлагаясь с выделением металлического серебра:
![]()
Хлорид серебра вступает в реакции взаимодействия с концентрированными растворами щелочей, гидратом аммиака.
![]()
![]()
Переводится в раствор за счет комплексообразования.
![]()
![]()
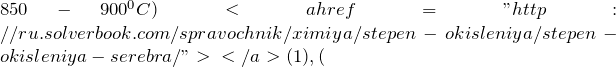
При сплавлении с карбонатом натрия (серебро (1), равно как и в реакции с оксидом бария (» width=»616″ height=»67″ />> 324^C$) (2):
Источник: ru.solverbook.com
Хлорид серебра AgCl(I) может быть получен несколькими способами: обработкой металлического серебра хлорной водой(1.32), действием газообразного HCl на серебро при температуре выше +1150 С(1.28), обработка растворов солей серебра соляной кислотой или раствором какого-либо хлорида.
Хлорид серебра AgCl представляет собой диамагнитные белые кубические кристаллы с температурой плавления +455 С и температурой кипения +1554 єС. Это вещество не растворяется в воде и кислотах, но растворяется в растворах хлоридов (NaCl, KCl, NH4Cl, CaCl2, MnCl2)(1.61),цианидов(1.62), тиасульфатов(1.20), нитратов щелочных металлов и в аммиаке(1.63) с образованием растворимых и бесцветных координационных соединений:
AgCl + KCl = K(AgCl2) (1.61)
AgCl + 2KCN = K[Ag(CN)2] + KCl (1.62)
При комнатной температуре реагирует со фтором(1.64) образовывая фторид серебра (II), а также с сульфидом натрия, образовывая сульфид(1.65):
2AgCl + 2F = 2AgF + Cl (1.64)
AgCl + NaS(конц.) = Ag S + 2NaCl (1.65)
Под действием света хлорид серебра постепенно темнеет, разлагаясь с выделением металлического серебра и хлора:
AgCl = Ag + 1/2Cl (1.66)
Источник: vuzlit.com