Гетерогенные системы, состоящие из двух или более фаз, одна из которых равномерно раздроблена в другой, называются дисперсными.
Фаза, которая раздроблена, называется дисперсной фазой (в дальнейшем именуемой «д.ф.»).
Фаза, в которой раздроблена дисперсная фаза, носит название дисперсионной среды (сокращенно «д.с.»).
Классифицируют дисперсные системы по следующим признакам:
1) по степени раздробленности дисперсной фазы различают высокодисперсные и грубодисперсные дисперсные системы. Мерой раздробленности вещества является дисперсность, обозначаемая буквой «D». Она обратно пропорциональна среднему линейному размеру его частиц и измеряется в обратных метрах:
Если частица имеет сферическую форму, то d – это длина ее диаметра, если – кубическую, то размер ребра куба.
Чем больше дисперсность, тем выше удельная поверхность (площадь поверхности, приходящаяся на единицу массы) измельченного вещества. С увеличением площади поверхности увеличивается поверхностная энергия частиц, находящихся на границе раздела фаз гетерогенной системы. Это приводит к повышению реакционной способности вещества и, как следствие, делает возможным самопроизвольное протекание различных поверхностных явлений (адсорбции, смачивания и т. п.).
Химия 11 класс (Урок№6 — Дисперсные системы.)
Средний размер частиц дисперсной фазы высокодисперсных систем лежит в интервале 10 −9 – 10 -7 м. Такие системы называют коллоидными. Природные коллоидные системы – это космическая пыль, сок растений. В технике используют высокодисперсные краски, аэрозоли.
Грубодисперсные системы состоят из частиц размером от 10 -7 до 10 — 4 м. Такие системы называют микрогетерогенными, так как их частицы можно увидеть в обычный микроскоп. К ним относятся биологические жидкости (кровь), продукты питания (молоко, хлеб), природные системы (туман, облака), технические материалы (краски, эмульсии, пены);
2) по агрегатному состоянию (твердому, жидкому и газообразному) дисперсной фазы и дисперсионной среды различают 8 типов дисперсных систем. По этой классификации дисперсную систему записывают в виде дроби, в числителе которой указывают агрегатное состояние дисперсной фазы, а в знаменателе — дисперсионной среды, т. е. «д.ф./д.с». Каждый из восьми типов (девятый тип «г/г» относится к истинным растворам) имеет специфическое название. Примеры указанных систем представлены в таблице 1.
| Дисперсионная среда | Дисперсная фаза | ||
| Газообразная | жидкая | твердая | |
| Газообразная | ─ | аэрозоли, ж / г туман, облака, духи, лекарства | аэрозоли, т / г пыль, дым, песчаные бури |
| Жидкая | жидкие пены, г / ж мыльная пена, пена огнетушителя | эмульсии, ж / ж молоко, сливочное масло, мазь, крем, СОЖ, нефть | коллоидные растворы, суспензии, т / ж соусы,кисели, клеи,краски |
| Твердая | твердые пены, г / т хлеб, шоколад, почва, пенопласт | гели, ж / т жемчуг | т / т сплавы металлов, драгоценные камни, цветные стекла |
Коллоидные растворы. Дисперсные системы
3) по наличию взаимодействия частиц дисперсной фазы между собой различают свободно – и связнодисперсные (структурированные) системы, схемы которых представлены на рис. 1 и 2.
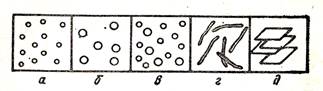
Рис.1. Свободнодисперсные системы: корпускулярно – (а–в), волокнисто (г) – и пленочнодисперсные (д).
Рис.2. Связнодисперсные системы: гель (а); коагулят с плотной (б) и рыхлой (в) структурой.
По определению условием образования дисперсных систем является ограниченная растворимость или взаимная нерастворимость частиц дисперсной фазы и дисперсионной среды. По этой причине такие системы термодинамически неустойчивы и со временем должны расслаиваться на две отдельные фазы. Для обеспечения агрегативной устойчивости (способности частиц дисперсной фазы не слипаться, сохраняя определенную степень дисперсности) и кинетической устойчивости (способности не оседать с образованием отдельной фазы) дисперсных систем в них вводят третий компонент – стабилизатор.
Дисперсные системы занимают промежуточное положение между растворами и гетерогенными системами, поэтому для их получения используются два способа – диспергирование (раздробление уже имеющейся фазы, нерастворимой в дисперсионной среде) или конденсацию (создание новой фазы из гомогенной системы и получение таким образом двухфазной системы).
Методы диспергирования делятся на физические и химические. Физическое диспергирование может осуществляться механическим методом (взбалтыванием, дроблением на шаровых мельницах), ультразвуковым, электрическим (испарение металла электрода при образовании вольтовой дуги). Химическое диспергирование, или пептизация, основано на обработке свежевыпавшего рыхлого осадка раствором электролита или растворителя, приводящей к дезагрегированию его частиц и распределению их по объему дисперсионной среды.
Конденсационные методы также могут быть физическими или химическими. При химическом методе новая фаза образуется за счет химической реакции. Это может быть окислительно – восстановленная реакция для получения коллоидных растворов металлов (серебра) или неметаллов (серы):
С помощью реакции гидролиза получают коллоидный раствор гидроксида железа (III):
Физическая конденсация может быть осуществлена методом замены растворителя на нерастворитель для растворенного вещества, что приводит к образованию гетерогенной системы. Так можно получить водную дисперсию серы или канифоли из их спиртового раствора.
К наиболее распространенным дисперсным системам относятся эмульсии, суспензии, пены и аэрозоли.
· Эмульсии – микрогетерогенные системы, по агрегатному состоянию фаз обозначаемые как «ж/ ж». Они образованы двумя взаимно несмешивающимися жидкостями, одна из которых в виде капель раздроблена в другой. В зависимости от полярности фаз существует два типа эмульсий: прямая эмульсия, обозначаемая как «м/в» и обратная эмульсия, которую записывают как «в/м».
Полярную фазу называют «водой» (обозначают буквой «в»), а неполярную — «маслом» (обозначают буквой «м»). Примером природной эмульсии первого типа, т. е. типа «вода в масле» является молоко, состоящее из капелек жира, распределенных в воде, а второго типа, т.е. «вода в масле», — сливочное масло, нефть. Специфическим свойством эмульсий является обращение их фаз, означающее обратимый переход из одного типа в другой. Это явление может быть вызвано механическим воздействием (встряхиванием) или заменой стабилизатора эмульсии, называемого «эмульгатором». Стабилизируют эмульсии обычно поверхностно- – активные вещества (ПАВ).
Эмульсии применяют в технике в качестве смазочноохлаждающих жидкостей (СОЖ). Авторемонтные предприятия сбрасывают в сутки от 30 до 100 м 3 сочных вод, содержащих масляные эмульсии, для разрушения которых применяют деэмульгирование.
· Суспензии – микрогетерогенные системы, соответствующие типу «т/ж». Разбавленные суспензии называют взвесями, к ним относится кровь (биологическая жидкость), применяемые в технике строительные (цементные, известковые) растворы и краски. Взвеси устойчивы только со стабилизаторами, роль которых могут выполнять порошки или ПАВ. Концентрированные суспензии называют пастами.
В технике применяют абразивные пасты, в строительстве используют грунтовки, щпатлевки, мастики, краски. Концентрированные суспензии относятся к структурированным системам и являются устойчивыми.
· Пены – микрогетерогенные системы, представляющие собой дисперсию газов в жидкой (жидкие пены) или в твердой (твердые пены) дисперсионной среде. Примером природной твердой пены является пемза – продукт вулканической деятельности, искусственными твердыми пенами — хлеб, пенопласт, поролон. Стабилизатор жидкой пены называется пенообразователем.
Хорошими пенообразователями являются мыла – соли высших органических кислот. Устойчивость пены определяется временем, за которое ее объем уменьшается вдвое. Она зависит от природы пенообразователя, температуры и вязкости дисперсионной среды. К свойствам пены относится кратность, т.е. отношение объема полученной пены к объему жидкости, из которой она образована.
Кратность хорошей пены может достигать 1000 единиц. Концентрированные пены состоят из пузырьков газа или воздуха, окруженных тонкими структурированными жидкими пленками дисперсионной среды Пены используются для обогащения руд металлов методом флотации, при пожаротушении и т. д. Иногда явление пенообразования является нежелательным. Оно может также препятствовать перемешиванию при очистке сточных вод или в каких – либо технологических процессах. В этих случаях пены «гасят», добавляя специальные вещества – пеногасители, вытесняющие пенообразователь. Хорошими пеногасителями являются органические спирты.
· Аэрозоли – это высокодисперсные или грубодисперсные системы с газообразной дисперсионной средой, обозначаемые как ж/г или т/г. Название аэрозолей зависит от способа получения. Полученные методом диспергирования капелек жидкости в газообразной среде аэрозоли называются «спреями», к ним относятся косметические средства (духи, дезодоранты), лекарства.
При диспергировании твердых частиц горных пород в воздухе образуется пыль, разносимая ветром на огромные расстояния. Аэрозоли, таким образом, играют важную роль в круговороте химических элементов в природе. Методом конденсации капелек влаги в воздухе получаются облака и туманы, а при конденсации твердых частичек углерода – дымы.
Аэрозоли устойчивы без стабилизатора по причине изоляционных свойств газообразной среды, не дающей слипаться рассеянным частицам, даже в том случае, если они заряжены. С коллоидными системами аэрозоли объединяет проявление светорассеивания (опалесценции). Специфическое свойство аэрозолей – явление термофореза (перемещение частиц аэрозоля от горячего к более холодному участку), вызванное большей интенсивностью ударов со стороны молекул газообразной среды на участках с повышенной температурой. Образующийся в атмосфере крупных промышленных городов, смог представляет собой аэрозоль сложного состава, состоящий из частиц твердой, жидкой и газообразной фаз, рассеянных в воздухе и обозначаемый как
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Характеристика дисперсных систем и их виды
Неоднородной, или гетерогенной, считается система, которая состоит из двух или нескольких фаз. Каждая фаза имеет свою поверхность раздела, которую можно механически разделить.
Неоднородная система состоит из дисперсной (внутренней) фазы и дисперсионной (внешней) среды, окружающей частицы дисперсной фазы.

Системы, в которых внешней фазой являются жидкости, называются неоднородными жидкими системами, а системы, в которых внешней фазой являются газы, – неоднородными газовыми системами. Гетерогенные системы часто называют дисперсными системами.
Различают следующие виды неоднородных систем: суспензии, эмульсии, пены, пыли, дымы, туманы.
Суспензия – это система, состоящая из жидкой дисперсионной фазы и твердой дисперсной фазы (например, соусы с мукой, крахмальное молоко, патока с кристаллами сахара). Суспензии в зависимости от размеров частиц делятся на грубые (размер частиц более 100 мкм), тонкие (0,1–100 мкм) и коллоидные (0,1 мкм и менее).
Эмульсия – это система, состоящая из жидкости и распределенных в ней капель другой жидкости, не смешивающейся с первой (например, молоко, смесь растительного масла и воды). Под действием силы тяжести эмульсии расслаиваются, но при незначительных размерах капель (менее 0,4–0,5 мкм) или при добавлении стабилизаторов эмульсии становятся устойчивыми, не способными к расслоению в течение продолжительного периода.
Увеличение концентрации дисперсной фазы может вызвать ее переход в дисперсионную фазу, и наоборот. Такой взаимный переход называется инверсией фаз.Имеются газовые эмульсии, в которых дисперсионная среда – жидкость, а дисперсная фаза – газ.
Пена – это система, состоящая из жидкой дисперсионной фазы и распределенных в ней пузырьков газа (газовая дисперсная фаза) (например, кремы и другие взбитые продукты). Пены по своим свойствам близки к эмульсиям. Для эмульсий и пен характерна инверсия фаз.
Пыли, дымы, туманы представляют собой аэрозоли.

Аэрозолями называют дисперсную систему с газообразной дисперсионной средой и твердой или жидкой дисперсной фазой, которая состоит из частиц от квазимолекулярного до микроскопического размера, обладающих свойством находиться во взвешенном состоянии более или менее продолжительное время (например, мучная пыль, образуемая при измельчении зерна, просеивании, транспортировке муки; сахарная пыль, образуемая при сушке сахара, и др.). Дым образуется при сжигании твердого топлива, туман – при конденсации пара.
В аэрозолях дисперсионной средой является газ или воздух, а дисперсной фазой в пыли и дыме – твердые вещества, в туманах – жидкость. Размеры твердых частиц пыли составляют 3–70 мкм, дыма – 0,3–5 мкм.
Туман – это система, состоящая из газовой дисперсионной среды и распределенных в ней капель жидкости (жидкая дисперсная фаза). Размер жидких капель, образовавшихся в результате конденсации в тумане, составляет 0,3–3 мкм. Качественным показателем, характеризующим однородность частиц аэрозоля по размеру, является степень дисперсности.
Аэрозоль называют монодисперсным, когда составляющие его частицы имеют одинаковый размер, и полидисперсным при содержании в нем частиц разного размера. Монодисперсных аэрозолей в природе практически не существует. Лишь некоторые аэрозоли по размерам частиц приближаются к монодисперсным системам (гифы грибов, специально получаемые туманы и др.).
Дисперсные, или гетерогенные, системы в зависимости от количества дисперсных фаз могут быть одно– и многокомпонентными. Например, многокомпонентной системой являются молоко (имеет две дисперсные фазы: жир и белок); соусы (дисперсными фазами являются мука, жир и др.).
ЧИТАЙТЕ ДАЛЕЕ:
Публикации по теме:
- Разделение газов неоднородных систем
- Способы очистки при разделение газов неоднородных систем
- Методы разделения гетерогенных систем. Центрифугирование
- Процессы пенообразования
- Очистка газов в циклонах
Источник: proiz-teh.ru
Дисперсные системы


Как образуются облака? Почему у берегов на море образуется пена? Откуда приходит туман? Ответ кроется в существовании дисперсных систем. Некоторые вещества не могут вступать в реакции друг с другом.
Когда пузырьки газа равномерно распределяются в воде, то формируется дисперсная система – морская пена.



В быстроразвивающемся мире уже мало учиться только в рамках школьной программы, важно получать полезные знания о финансах и инвестициях, чтобы гарантировать материальное благополучие
Создай себе задел на будущее, получай уже сегодня расширенный объем знаний и навыков по ФИНАНСОВОЙ ГРАМОТНОСТИ в режиме онлайн


Зарегистрируйся сейчас, ПРИБЛИЗЬ СВОЙ УСПЕХ
План урока:
Дисперсная система – гетерогенная структура, в которой вещества не смешиваются между собой и не растворяются друг в друге. Она включает дисперсионную среду (большая часть смеси) и дисперсную фазу (раздробленное вещество), между которыми есть поверхность раздела.

Классификация в зависимости от агрегатного состояния
Среда и фаза могут существовать в различных агрегатных состояниях. Таким образом, есть 9 видов систем.

Классификация в зависимости от интерактивности частиц
Частицы взаимодействуют друг с другом. В зависимости от интерактивности частиц дисперсные системы делятся на два типа.
- Свободнодисперсные – аэрозоли и растворы (фаза подвижна).
- Связнодисперсные– твердые или полутвердые смеси (частицы не взаимодействуют между собой).
Если в смеси частицы имеют одинаковый размер, то систему называют монодисперсной, если разный – полидисперсной. Реальные системы обычно полидисперсны. Существуют сложные структуры с несколькими фазами.Если нагреть жидкую дисперсионной среду с твердой дисперсной фазой, то образуется сложная система «пар-капли-твердые вещества».

Сложная дисперсная система – молоко.
Пример сложной системы – молоко. Дисперсионной средой в структуре является вода, а дисперсной фазой – жир, казеин и молочный сахар. Жир – эмульсия, которая при длительном стоянии поднимается кверху в виде сливок. Казеин – коллоидный раствор, который может осаждаться в виде творога при окислении молока. Молочный сахар – молекулярный раствор, который выделяется только при испарении воды.
Типы в зависимости от размера частиц
Дисперсные системы классифицируются на несколько видов в зависимости от размера частиц.

Отдельные вещества относятся к нескольким типам. Некоторые золи при определенной температуре текучи, поэтому их относят к свободнодисперсным. При понижении температуры частицы этого золя слипаются между собой, становясь твердыми и переходя в связнодисперсную форму.
Грубодисперсные системы (размер частиц > 1000 мкм)
Взвеси – грубодисперсные смеси, в которых агрегаты можно увидеть без помощи специальных устройств. Они отличаются непрозрачностью. Взвеси классифицируются на три вида.

Производство сельскохозяйственных удобрений основано на уникальных свойствах взвесей. При образовании почвы или насыщении грунта полезными элементами также участвуют грубодисперсные структуры.
Коллоидные системы (размер частиц 1-1000 мкм)
Коллоидные частицы нельзя разделить без специальной техники или препаратов, в отличие от взвесей. Внешне они схожи с однородными смесями. Коллоидные системы делятся на два вида.

Истинные растворы (размер частиц < 1 мкм)
Истинные растворы – однофазные системы, в которых между фазой и средой есть прочная связь.Они долгое время сохраняют гомогенность. Истинные растворы всегда прозрачны. Их частицы не видны даже в электронный микроскоп.С истинными растворами мы сталкивается каждый день. Например, к ним относятся сахар в чае или соль в супе.
Высокомолекулярные вещества
Полимеры могут быть представителями как коллоидных систем, так и истинных растворов. Они отличаются между собой типом фазы и среды, температурой кипения и другими характеристиками. Высокомолекулярные дисперсные системы обладают рядом свойств.
- Медленно смешиваются.
- Перед смешиванием вещество набухает.
- Истинные и коллоидные растворы одних и тех же высокомолекулярных соединений подчиняются разным химическим законам.
- Повышенная вязкость.
Если полимер начинает набухать, то дисперсная система прекращает существовать. Это связано с тем, что фаза растворяется в среде, что не характерно для дисперсных систем.
Заряд на поверхности коллоидных частиц
Для частиц характерен заряд, который позволяет им находиться в электрическом поле. Заряд образуется при двух случаях:
- при притяжении ионов к поверхности частиц;
- при ионизации молекул, которые не растворимы.
В золях и истинных растворах есть броуновское движение – хаотичное движение мелких агрегатов. Все частицы в дисперсных системах могут иметь как положительный, так и отрицательный заряд. Агрегаты с одноименными зарядами не слипаются друг с другом. Благодаря этой особенности золи и истинные растворы устойчивы.
Коагуляция коллоидных растворов
Коагуляция – процесс слипания мелких частиц в крупные агрегаты. Ее можно создать искусственным путем с помощью продолжительного нагревания золя или при взаимодействии смеси с частицами, которые противоположно заряжены. Если частицы практически не вступают в реакцию со средой, то формируется осадок. Если они хорошо взаимодействуют с растворителем, то они вбирают в себя часть жидкости и образуют гелевую структуру.
Решение задач
№1. Чтобы приготовить насыщенный раствор хлорида натрия NaCl надо в 100 мл воды растворить 42 г соли. Какое количество вещества нужно растворить в 400 мл раствора.
- Найти массу раствора, учитывая 42 г соли.
m (насыщенного раствора) = m(Н2О) + m(NaCl) = 100 г + 42 г = 142 г
- Найти массу соли в 400 мл раствора.
142 г р-ра – 42 г соли
400 г р-ра – х г соли
m (NaCl)= (400 х 42)/142 = 118,3 г
- Вычислить молярную массу соли.
M (NaCl) = 23г/моль + 35г/моль = 58 г/моль
- Посчитать количество вещество в 118,3 г хлорида натрия.
n (NaCl) = m (NaCl)/М (NaCl) = 118,3 г/58 г/моль = 2,03 моль
Ответ: n (NaCl) = 2,03 моль
№2. Какой объем 0,1 М раствора гидроксида калия КOH можно приготовить из 100 мл раствора гидроксида калия с массовой долей 15% и плотностью 1,138 г/см 3 ?
- Найти массу раствора.
m (раствора KOH) = V (KOH) x p (KOH) = 100 мл х 1,138 г/см 3 = 113,8 г
- Найти массу гидроксида калия в 113,8 г 15%-ного раствора.
100 г р-ра – 15 г в-ва
113,8 г р-ра – х г в-ва
m (KOH) = (113,8 х 15)/100 = 17,07 г
- Посчитать молярную массу гидроксида калия.
М (КОН) = 39 г/моль + 16 г/моль + 1 г/моль = 56 г/моль
- Найти количество гидроксида калия.
n (КОН) = m (КОН)/М (КОН) = 17,07 г/56 г/моль = 0,305 моль
- Найти объем раствора с концентрацией гидроксида калия 0,1 М.
1000 мл – 0,1 моль
V мл – 0,305 моль
V (КОН)= (1000 мл х 0,305 моль)/0,1 моль = 3050 мл
Ответ: V (КОН) = 3050 мл
Применение дисперсных систем
Не только на производстве встречаются дисперсные системы, но и в природных условиях. Кровяная плазма, белок яйца,вода в реке и озере – золи. Дисперсными системами являются такие природные явления как облака, туман, дым, морская пена и т.д.
Человек в строительстве применяют краски, клеи, лаки. Также популярны косметические крема и медицинские мази, которые также относятся к дисперсным системам. Мы даже употребляем дисперсные системы в пищу в виде зефира, мармелада, киселя и других продуктов.
Дисперсные системы окружают нас и дома, и в живой природе. Без дисперсных систем невозможно представить жизнь на нашей планете. Таким образом, коллоидная химия – это наука о жизни.
Источник: 100urokov.ru