Хлорсеребряный электрод применяют в тех случаях, когда по тем или иным причинам недопустимо применение каломельного полуэлек — Водород трода. Кроме того, отмечается [5], — что применение хлорсеребряного электрода предпочтительнее в тех случаях, когда имеются колебания температуры, так как в этом случае отсутствует заметный гистерезис в показаниях электрода. [2]
Хлорсеребряный электрод также может применяться в качестве электрода сравнения. [3]
Хлорсеребряные электроды применяют и в лабораторной практике. [4]
Хлорсеребряный электрод — электрод второго рода, состоящий из серебряной — проволоки, погруженной в насыщенный раствор хлорида калия, содержащий небольшое количество хлорида серебра. Лучше хлорид серебра предварительно расплавить и серебряную проволоку окунуть в расплавленную массу. [5]
Хлорсеребряный электрод изготовляется из серебряного стержня, на поверхности которого осаждают слой малорастворимой соли AgCl. При погружении электрода в раствор, содержащий ионы С1 -, он приобретает потенциал, величина которого является функцией активной концентрации ионов хлора. [7]
Почему липнут электроды и как с этим бороться!? / УОНИ 13/55
Хлорсеребряные электроды 3 ж 4 [14] длиной 25 — 30 мм и диаметром 2 — 3 мм вставляют в стеклянные трубки с зазором около 1 — 1 5 мм. [8]
Хлорсеребряный электрод состоит из серебряной пластинки, покрытой слоем хлористого серебра. Электрод опускается в испытуемый раствор. [9]
Хлорсеребряный электрод имеет следующие преимущества перед каломельным: отпадает необходимость работы со ртутью, меньше габаритные размеры, отсутствует контакт измеряемой среды со ртутью. Наиболее широко применяют хлорсеребряный электрод, изготовленный из серебряного стержня, на поверхность которого осажден слой малорастворимой соли AgCl. При погружении хлорсеребряного электрода в раствор, содержащий ионы С1 -, электрод приобретает потенциал, величина которого является функцией активности ионов хлора. [10]
Хлорсеребряный электрод ввинчивается в дно сосуда, в котором находится раствор хлорида калия. [11]
Хлорсеребряный электрод обладает постоянным и хорошо воспроизводимым потенциалом. Электрод используется в качестве вспомогательного в растворах, содержащих ион хлора в водных, неводных и смешанных растворителях. [12]
Хлорсеребряный электрод ( рис. 53) находит широкое распространение в практике электрохимических измерений в качестве удобного стандартного электрода сравнения. Он состоит из серебряной проволоки со слоем AgCl, помещенной в раствор КС1 или НС1 определенной концентрации. Электродный сосуд представляет пробирку, снабженную пришлифованной пробкой в нижней части. Электролитический контакт осуществляется через шлиф. Вместо серебряной проволоки может быть взята платиновая, на которую осаждается тонкий слой электролитического серебра ( процесс серебрения описан в Приложении, стр. [14]
Хлорсеребряный электрод хорошо воспроизводим и довольно прост в изготовлении. [15]
Источник: www.ngpedia.ru
Как правильно выбрать электроды? Урок 6
2.12.2. Хлорсеребряный и кáломельный электроды
Хлорсеребряный и кáломельный электроды относятся к электродам второго рода. В общем случае электродная реакция может быть записана в виде:
, где ν+ и ν– – стехиометрические коэффициенты, z+ и z– – валентности иона металла М и аниона А, ν+z+ + ν–z– = 0 (электронейтральность), n = ν+z+ = ν–|z–|. Соль – окисленная форма соединения, ион металла и анион – восстановленная. Через границу металл–соль могут проходить только ионы металла, поэтому потенциал металла будет определяться активностью его ионов , химический потенциал которых должен быть одним и тем же в металле, соли и растворе. Уравнение Нернста в этом случае имеет вид:
Так как соль малорастворима, для нее выполняется соотношение
, где Ls = const. – произведение растворимости соли. Выразив активность ионов металла из этого выражения
и подставив в уравнение Нернста, получим:
, где учтено условие электронейтральности, а . Таким образом, потенциал электрода второго рода определяется активностью аниона в растворе.
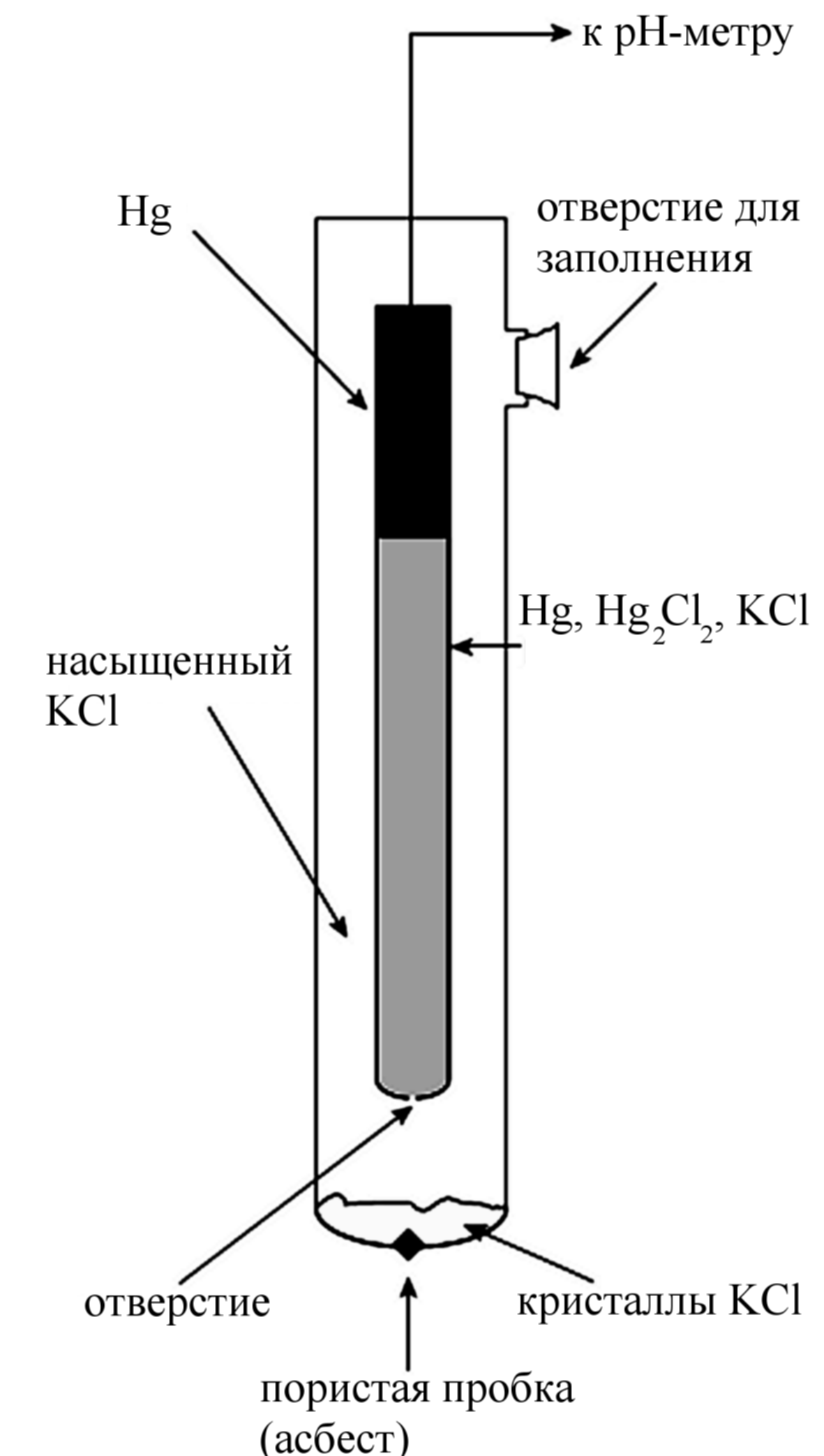
Устройство каломельного электрода (насыщенного) ясно из рисунка. Электродная реакция имеет вид:
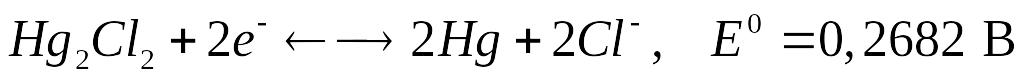
.
Хлорсеребряный электрод устроен сходным образом: серебряная проволочка, покрытая слоем малорастворимой соли хлорида серебра, погружена в раствор хлорида калия с известной активностью (обычно используется насыщенный раствор). Для хлорсеребряного электрода реакция имеет вид:
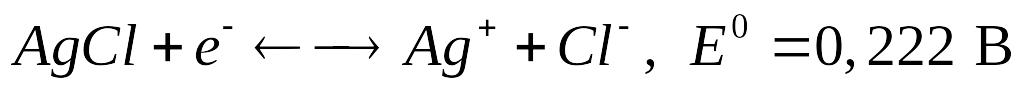
.
Уравнение Нернста для обоих электродов записывается одинаково:
Таким образом, для насыщенного каломельного электрода при 298 К потенциал относительно стандартного водородного электрода равен 0, 2444 В, а для насыщенного хлорсеребряного электрода E = 0,197 В.
2.12.3. Сурьмяный электрод
Сурьмяный электрод представляет собой сурьмяную проволочку, впаянную в стеклянный капилляр. Его используют для измерения рН в малых объемах. Электродная реакция имеет вид:
Равновесный потенциал (в вольтах) такого электрода (при 298 К) равен
ESb = 0,64 – 0,059pH.
2.12.4. Стеклянный электрод
В 1906 г. Кремер обнаружил, что между сторонами тонкой стеклянной пластинки, разделяющей два раствора, возникает разность потенциалов, если концентрации H3O + в растворах различны. Это наблюдение позволило Ф.Габеру создать в 1909 г. стеклянный электрод для измерения рН.
Стеклянный электрод относится к ионоселективным электродам: стекло ведет себя как катионообменник: внутри стекла имеются неподвижные отрицательно заряженные группы (например, кремниевой кислоты), с которыми связаны относительно подвижные катионы. Число центров связывания считается фиксированным и называется ионообменной емкостью системы C, при этом , где индекс m относится к ионам в стекле.. Разные катионы обладают разным сродством к центрам связывания и разной подвижностью в стекле. Если в стекле присутствуют подввижные ионы Na + и H + , на обеих границах мембраны с растворами, также содержащими эти ионы, идут ионообменные реакции
где символы без индекса относятся к ионам в в растворе. Константа равновесия для этой реакции называется константой селективности ионообменника:
Исходно стеклянный электрод представлял собой тонкостенный стеклянный шарик, заполненный неким стандартным раствором, в который был погружен электрод сравнения. Для измерения рН раствора использовали два электрода: стеклянный и внешний электрод сравнения. Позже стали использовать так называемые комбинированные электроды, которые в одном корпусе содержали и стеклянный электрод и внешний электрод сравнения. Схематически устройство такого электрода приведено на рисунке.
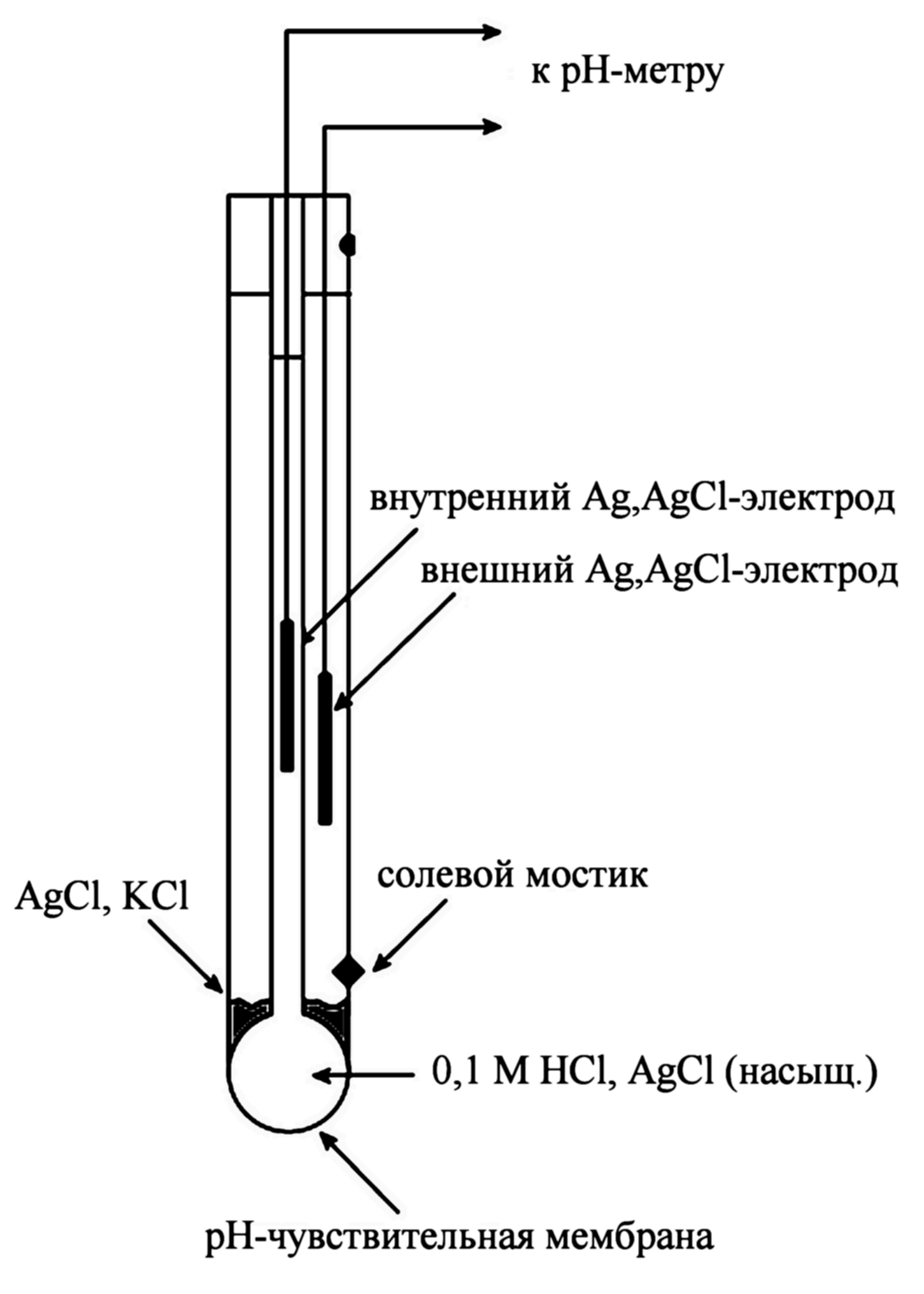
В идеальном случае мембрана должна была бы быть проницаемой только для одного типа ионов в присутствии других ионов.
Краткая запись для системы мембрана–растворы имеет вид:
Раствор 1 | Мембрана | Раствор 2.
Разность потенциалов между двумя растворами равна сумме двух гальвани-потенциалов на каждой границе раздела фаз и диффузионного потенциала внутри мембраны:
, где индексы 1 и 2 относятся к фазам 1-го и 2-го растворов, соответственно. Если один из растворов, например, 2-й, выбран стандартным (индекс s), то соответствующая разность потенциалов станет стандартной (–Δφ°):
Ионообменные процессы протекают быстро, поэтому можно считать, что на границах мембрана-раствор устанавливается равновесие. Тогда из равенства электрохимических потенциалов ионов в 1-м растворе и в мембране, получим
, откуда, учитывая, что , имеем:
В случае, когда в мембране присутствуют два подвижных иона, например, А + и В + , необходимо учитывать ионный обмен: . Для упрощения записи будем обозначать активности компонентов их символами в записи уравнения реакции, например, . Тогда, используя константу равновесия указанной реакции, получим
Для гальвани-потенциала на границе мембраны с раствором 1 тогда получаем:
Для оценки диффузионного потенциала будем пока считать, что оба иона присутствуют в обоих растворах (при измерении концентрации A z+ в стандартном растворе не должно быть ионов B z+ ). Из ионообменных равновесий награницах мембраны следует:
, где Am,i и Bm,i – концентрации ионов на границе мембраны с i-м раствором. Тогда из общей формулы для диффузионного потенциала ионов получим:
где , а uA и uB – подвижности ионов в мембране (считаем их постоянными). Теперь положим B2 = 0. Тогда
Подставив полученные выражения в уравнение для потенциала раствора 1 относительно стандартного раствора, получим уравнение Никольского:
Величина KAB определяет селективность А-электрода по отношению к иону В, и для хорошего электрода должно выполняться неравенство KAB
Если стеклянный электрод поместить в стандартный раствор, то его потенциал не обратится в нуль. Этот остаточный потенциал называется потенциалом асимметрии. Он обусловлен различием свойств наружной и внутренней поверхностей стеклянного электрода, возникающим при изготовлении электрода. Потенциал асимметрии является характеристикой электрода и входит в его стандартный потенциал.
При потенциометрическом определении активности какого-либо компонента раствора этот раствор с измерительным электродом образует один полуэлемент, а электрод сравнения – второй. Электрод сравнения в растворе постоянного состава имеет постоянный потенциал, а потенциал измерительного (индикаторного) электрода линейно зависит от логарифма активности соответствующего компонента. По договоренности электрод сравнения принято считать анодом. Краткая запись потенциометрической ячейки выглядит следующим образом:
Электрод сравнения (reference) || Измерительный электрод (indicator)
В соответствии с принятыми обозначениями двумя параллельными линиями обозначается жидкостное соединение (солевой мостик), для которого характерно наличие разности потенциалов на каждой границе с другими растворами. Поэтому разность потенциалов ячейки должна быть записана так:
E = Ei – Er + Elj, где Elj – потенциал жидкостного соединения (диффузионный потенциал). В идеальном случае у электрода сравнения потенциал должен быть постоянным, так чтобы все изменения измеряемой разности потенциалов были обусловлены только изменениями потенциала измерительного электрода, т.е. изменениями концентрации анализируемого раствора.
Различные стеклянные электроды используют для измерения рН в разных диапазонах. Обычный (с Na2O) стеклянный электрод имеет хорошую избирательность при 0,5
Для потенциала стеклянного электрода в рабочей области при 25 °С можно использовать уравнение вида:
E = E 0 – 0,05916 рН.
Для точного измерения потенциала электрода необходимо использование вольтметра с очень высоким входным сопротивлением (10 12 Ом и более).
«Абсолютные» значения pH нельзя определить из-за невозможности определения коэффициентов активности отдельных ионов и наличия диффузионных скачков потенциала. Экспериментально определяются так называемые «инструментальные» величины pH с использованием колориметрического, кондуктометрического или потенциометрического методов. Разработаны методы определения pH с достаточно высокой точностью, в частности по измерениям в цепях без жидкостного соединения, которые используются для определения pH стандартных буферных растворов.
Примеры стандартных (эталонных) буферных растворов:
Состав и моляльные концентрации (моль/кг H2O) растворов
Источник: studfile.net
Примерами электродов второго рода могут служить хлорсеребряный и каломельный
Активные металлы (магний, цинк, железо, кобальт и т.д.) и в воде, и в растворе собственной соли, как правило, заряжаются отрицательно. Пластинки малоактивных металлов (таких как медь, ртуть, серебро и т.д.) в растворе собственной соли, наоборот, заряжаются положительно, т.к. их катионы с поверхности кристаллической решетки могут переходить в раствор в незначительных количествах и поэтому до наступления равновесия преобладает обратный процесс – осаждение катионов из раствора на металл. В результате пластинка приобретает положительный заряд, а раствор, в котором остались анионы соли – отрицательный заряд.
Рис. 86. Схема, объясняющая возникновение разности электрического потенциала на границе металл – вода
Схематически протекающие при этом процессы можно изобразить следующим образом:
Двойной электрический слой, возникающий на границе раздела между металлом и жидкостью, имеет не плоское, а диффузионное строение. Электростатическому притяжению катионов со стороны пластинки противодействуют силы взаимного отталкивания между ионами Ме n+ и их тепловое движение. По мере удаления от поверхности металла концентрация его катионов в водном слое убывает.
Если металлическую пластинку опустить не в воду, а в раствор соли этого металла, то величина заряда, возникающего на пластинке при установлении равновесия, будет определяться ещё и концентрацией ионов металла в исходном растворе.
Это связано с тем, что в ионообменных процессах в данном случае смогут принимать участие и катионы добавленного электролита.
Система, состоящая из металлической пластинки, опущенной в раствор собственной соли, называется металлическим электродом. Разность потенциалов, которая устанавливается между пластинкой и прилегающим к ней водным слоем, называется электродным потенциалом.
Его величина будет определяться не только прочностью связей в кристаллической решетке металла и температурой системы, но и активностью катионов металла соли в растворе. Эта зависимость выражается уравнением Нернста:
где Е – электродный потенциал, В; Е 0 – стандартный электродный потенциал, т.е. потенциал, который возникает на электроде при активности ионов металла соли в растворе, равной 1 моль/дм 3 и температуре 298 K (25 о С); R – универсальная газовая постоянная, 8,314 Дж/(моль ∙ K); Т – температура, K; n — величина заряда иона металла; F – постоянная Фарадея, равная 96500 Кл/моль; – активность ионов металла в растворе.
Для достаточно разбавленных растворов солей активность ионов металла можно заменить их молярной концентрацией.
В этом случае для температуры 298 K при переходе от натурального логарифма к десятичному и подстановке значений констант R и F уравнение Нернста принимает более простой вид:
где – молярная концентрация ионов металла в растворе.
Металлические электроды подразделяются на электроды первого и второго рода.
Электроды первого рода – это электроды, состоящие из металлической пластинки, опущенной в раствор собственной соли. Величина электродного потенциала для них зависит только от активности катионов соли.
Электроды второго рода состоят из малоактивного металла, покрытого слоем труднорастворимой собственной соли и погруженного в раствор какой-либо легкорастворимой соли, содержащей те же анионы, что и у нерастворимой соли. Потенциал такого электрода зависит как от активности ионов металла в растворе, так и от активности общего для двух солей аниона.
В последнем случае его рассчитывают следующим образом:
где – активность аниона легкорастворимой соли; n – величина заряда аниона.
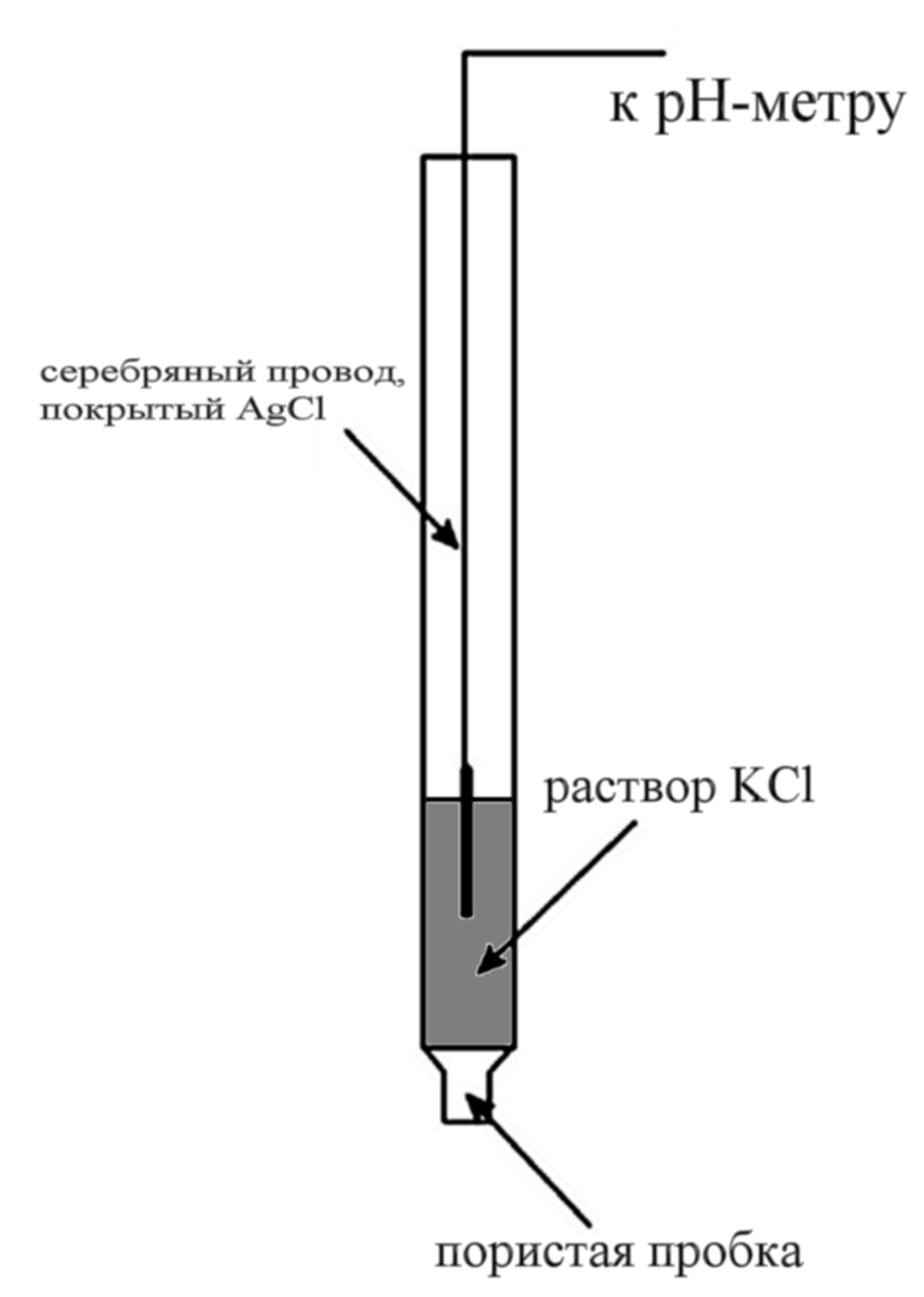
Хлорсеребряный электрод состоит из серебряной проволоки, покрытой малорастворимой в воде солью AgCl и погруженной в раствор хлорида калия (рис. 87).
Рис. 87. Хлорсеребряный электрод:
1 – серебряная проволока; 2 – слой AgС1;
3 – раствор КС1; 4 – микрощель для контакта с внешним раствором
Ионы Ag + образуются в растворе при частичном растворении соли AgCl
Каломельный электрод состоит из металлической ртути, покрытой пастой плохо растворимого хлорида ртути(I) Hg2Cl2 (иначе каломели), контактирующей с водным раствором KCl (рис. 88).
Рис. 88. Каломельный электрод: 1 – ртуть; 2 – паста из каломели;
3 – отросток для соединения каломельного электрода с другими электродами; 4 – платиновая проволока; 5 – раствор хлорида калия
Каломель, растворяясь в Н2О, диссоциирует с образованием ионов Нg2 2+ и Cl – :
В присутствии хлорида калия, содержащего одноименный с каломелью ион Cl – , растворимость Нg2Cl2 и концентрация ионов Нg2 2+ будет уменьшаться в зависимости от количества в растворе добавленной соли KCl и входящих в её состав ионов Cl – .
Потенциал хлорсеребряного и каломельного электродов рассчитывают по уравнению
где – активность ионов Cl – , образующихся при растворении KCl.
Это связано с тем, что легче измерить в растворе активность ионов Cl – , чем активность катионов Ag + или Нg2 2+ , образующихся при растворении плохо растворимой соли.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru