Высшие степени окисления для элементов семейства железа не характерны. Наиболее типичны для них степени окисления +2, +3. Для железа степень окисления +3 заметно устойчивее, чем +2. У Co степени окисления +2 и +3 примерно в равной мере устойчивы, а у Ni более стабильна степень окисления +2. В жестких условиях под действием сильных окислителей железо может проявлять степень окисления +6.
Металлические железо, кобальт, никель имеют близкие значения плотности, температур плавления и кипения, электродные потенциалы.
Кобальт и никель чаще всего встречаются в виде сульфидных минералов: кобальтин CoAsS, петландит (Fe, Ni)S, никелин NiS(As).
Железо по распространенности в природе находится на четвертом месте после кислорода, кремния и алюминия. Основным сырьем для производства железа являются магнетит Fe3O4, гематитFe2O3.
Химической основой получения металлического железа и его сплавов является восстановление оксидов железа в доменных печах при высоких температурах
ОВР с участием железа и его соединений: то, что всегда есть в ЕГЭшном КИМе | Химия ЕГЭ | Умскул
Вначале в доменных печах выплавляют чугун (содержит примеси C, P, S, Si), часть из которого затем превращают в сталь двумя способами: конвертерным и мартеновским. В конвертерном способе через расплавленный чугун, налитый в грушевидный сосуд-конвертер, продувают воздух, который окисляет часть углерода до СО, примесь FeS превращается при этом в Fe2O3 и SO2.
Для получения кобальта и никеля используют пиро- и гидрометаллургические методы.
Чистые металлы можно получить также термическим разложением их карбонилов.
Железо, кобальт и никель представляют собой серебристо-белые металлы с сероватым(Fe), розовым(Co) и желтоватым(Ni) отливом. Чистые металлы пластичны, однако даже незначительные количества примесей повышают их твердость и хрупкость.
Металлическое железо на холоде быстро реагирует с кислотами-неокислителями и образуют аквакатионы. Железо окисляется водой до температуры 873К. Во влажном воздухе уже при обычной температуре железо подвергается коррозии.
Однако очень чистое железо (менее0,01 % примесей) оказывается коррозионно-устойчивым.
Железо горит в атмосфере кислорода, образуя оксид Fe2O3.
Для железа, кобальта, никеля известны оксиды ЭО и Э2О3. Эти оксиды нельзя получить в чистом виде при окислении металлов кислородом.
Оксиды Fe (II), Co (II), Ni (II) – твердые, тугоплавкие вещества, черного(~FeO) или темно- зеленого(~CoO, ~NiO) цвета. С водой они не взаимодействуют, но легко реагируют с кислотами. Оксиды Fe(II), Co(II), Ni(II) проявляют основные свойства.
Гидроксиды Э(OH)2, образующиеся при действии на водные растворы солей железа (II), кобальта(II) и никеля(II) гидроксидов щелочных металлов, представляют собой гелеобразные осадки белого (Э= Fe), розового(Э= Co) и яблочно-зеленого(Э= Ni) цвета, легко разлагающиеся на оксиды ЭО и воду.
В степени окисления +2 рассматриваемые элементы образуют соли почти со всеми известными анионами. Растворимыми в воде солями являются нитраты, сульфаты, галогениды (кромеFeF2), тиоционаты, ацетаты и перхлораты.
В каких продуктах есть ЖЕЛЕЗО, и чем грозит его дефицит?
Оксиды, гидроксиды и соли железа (III), кобальта (III), никеля (III), способы получения и свойства. Соединения железа (VI), ферраты, их свойства. Применение металлов и их соединений.
Э2О3 устойчив только для железа и получается при разложении гидроксида. Оксиды Co(III) иNi(III) неустойчивы и разлагаются с отщеплением кислорода.
Оксид железа (III) Fe2О3 — твердое вещество буро-красного цвета, не взаимодействующее с водой и водными растворами KOH или NaOH, но реагирующее с кислотами. После сильного прокаливания Fe2О3 становится химически инертным оксидом и с кислотами уже не взаимодействует.
Гидроксиды Э(OH)3 получают косвенным путем и их устойчивость в ряду Fe(OH)3 − Co(OH)3 − Ni(OH)3 уменьшается. Если Fe(OH)3 образует соли железа(III), то реакции Co(OH)3 и Ni(OH)3с кислотами сопровождаются их восстановлением до Э(II)
Среди элементов семейства железа в степени окисления +3 сравнительно большое число солей образует только железо. Немногочисленные простые соли кобальта(III) при действии воды полностью разлагаются, а никель(III) простых солей не образует.
Соли железа (III) подвергаются сильному гидролизу с образованием коллоидных растворов. Поэтому водные растворы солей железа(III) окрашены в цвета от желто-бурого до темно-коричневого и имеют сильнокислую реакцию.
В отличие от кобальта и никеля для железа известны соединения, в которых его степень окисления равна +6. Так при окислении бромом Fe(OH)3 в горячем концентрированном растворе щелочи образуются соли железной кислоты H2FeO4 — ферраты.
Ферраты термически нестабильны и при небольшом нагревании (373 — 473 К) превращаются в ферриты.
Ферраты — сильные окислители. При pH < 10 анион FeO4 вступает
во взаимодействие с водой.
Применение: Элементы семейства железа и их соединения широко используются в технике и быту.
Железо и его сплавы составляют основу современной техники.
Никель является одной из важнейших легирующих добавок к сталям.
Железо, кобальт, никель и их соединения широко используются в качестве катализаторов. Губчатое железо с добавками — катализатор синтеза аммиака.
Платиновые металлы. Общая характеристика элементов. Нахождение в природе. Понятие о разделении элементов, гидроксиды платины (II), (IV), их свойства. Оксиды рутения и осмия (VIII).
Шесть платиновых металлов – рутений Ru, осмий Os, родий Rh, иридий Ir, палладий Pd и платина Pt — являются наиболее тяжелыми эле- ментами VIIIВ группы
Все они относятся к числу редких элементов. Содержание их в земной коре (в массовых долях, %) со- ставляет1·10–6 — 5·10–7.
Для платиновых металлов в соединениях характерны степени окисления о 0 до +8, но при этом отмечается тенденция к понижению максимальной степени окисления в горизонтальных рядах, а в вертикальных диадах повышается устойчивость более высокой степени окисления.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Валентность железа. Какая валентность у железа?

Немного истории
Человечество знало об этом химическом элементе и даже владело изделиями из него еще в IV веке до нашей эры. Это были народы Древнего Египта и Шумеры. Именно они первые начали изготавливать украшения, оружие из сплава железа и никеля, которые были найдены при археологических раскопках и тщательно исследованы химиками.
Немного позже, племена арийцев, переселившиеся в Азию, научилось добывать твердое железо из руды. Оно было настолько ценным для людей того времени, что изделия покрывали золотом!
Характеристика железа
Железо (Fe) стоит на четвертом месте по содержанию его в недрах земной коры. Оно занимает место в 7 группе 4 периода и имеет номер 26 в химической таблице элементов Менделеева. Валентность железа имеет прямую зависимость от своего положения в таблице. Но об этом позже.

Готовимся к углубленному изучению химии
Железо – химический элемент четвертого периода и побочной подгруппы VIII группы периодической системы. Атом железа содержит восемь валентных электронов, однако в соединениях железо обычно проявляет степени окисления (+2) и (+3), редко – (+6). Имеются сообщения о получении соединений восьмивалентного железа.

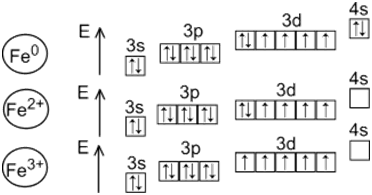
Степень окисления +3 для железа является наиболее устойчивой. Соединения железа(III) могут быть восстановлены только под действием сильных восстановителей, таких как водород в момент выделения, сероводород. Эти реакции проводят в кислой среде :
Fe2(SO4)3+H2S=2FeSO4+S+H2SO4
Железо широко распространено в природе – это самый распространенный металл, после алюминия. Существует гипотеза о том, что внутреннее ядро Земли – целиком состоит из железа с примесью никеля и серы, а возможно и других элементов.
В природе железо встречается в виде руд — оксидов Fe2O3 (гематит, красный железняк) и Fe3O4 (магнетит, магнитный железняк), гидратированного оксида Fe2O3 ⋅ H2O (лимонит, бурый железняк), карбоната FeCO3 (сидерит), дисульфида FeS2 (пирит), редко встречается в виде самородков, попадающих на землю с метеоритами. Такое метеоритное железо было известно людям издревле. Освоение получения железа из железной руды послужило началом железного века.

ПОЛУЧЕНИЕ ЖЕЛЕЗА
В настоящее время железную руду восстанавливают коксом в доменных печах, при этом расплавленное железо частично реагирует с углеродом, образуя карбид железа Fe3C (цементит), а частично растворяет его. При затвердевании расплава образуется чугун. Чугун, используемый для получения стали, называют передельным.
Запомнить! Сталь, в отличие от чугуна, содержит меньшее количество углерода.
При получении стали, лишний углерод, содержащийся в чугуне, необходимо выжечь. Этого добиваются, пропуская над расплавленным чугуном воздух, обогащенный кислородом. Существует и прямой метод получения железа, основанный на восстановлении окатышей магнитного железняка природным газом:
Fe3O4 + CH4 = 3Fe + CO2 + 2H2O
ФИЗИЧЕСКИЕ СВОЙСТВА
Железо – серебристо-белый, ковкий и пластичный тугоплавкий (т. пл. 1535°C, т. кип. 2870°C) металл, при температурах ниже 769°C притягивается магнитом, то есть обладает ферромагнетизмом. Ферромагнитные свойства вызваны наличием в структуре металла отдельных зон – доменов, магнитные моменты которых под действием внешнего магнитного поля ориентируются в одну и ту же сторону.
Железо существует в форме нескольких полиморфных (аллотропных) модификаций. При температурах ниже 9100C устойчиво железо с объемно-центрированной кристаллической решеткой (αα-Fe, немагнитное α-железо существующее при 769–9100C называют β-Fe), в интервале температур 910–14000C – более плотная модификация с кубической гранецентрированной (γγ-Fe), а выше этой температуры и вплоть до температуры плавления вновь становится устойчивой структура с объемно-центрированной ячейкой (δ-Fe).
ХИМИЧЕСКИЕ СВОЙСТВА ЖЕЛЕЗА
Запомнить!
· Степень окисления +2 железо проявляет при взаимодействии со слабыми окислителями: серой, йодом, соляной кислотой, растворами солей.
· Степень окисления +3 железо проявляет при взаимодействии с сильными окислителями: хлором, бромом.
· Смешанную степень окисления железо проявляет при взаимодействии с кислородом, водяным паром.

1) с кислотами. На влажном воздухе окисляется, покрываясь коричневой коркой гидратированного оксида Fe2O3 ⋅ H2O, ржавчины. Железо легко растворяется в разбавленных кислотах:
Fe + 2HCl = FeCl2 + H2
но пассивируется в холодных концентрированных растворах кислот-окислителях – серной и азотной.
2) с солями. Будучи металлом средней химической активности, железо вытесняет другие, менее активные металлы из растворов их солей:
Fe + CuSO4= FeSO4 + Cu
При этом, как и при растворении в кислотах, образуются соли двухвалентного железа.
3) с парами воды. При температуре белого каления железо реагирует с водой. Пропуская перегретый водяной пар через раскаленный на жаровне чугунный пушечный ствол, Лавуазье получил водород:
3Fe + 4H2O = Fe3O4 + 4H2.
4) с кислородом. В кислороде железо сгорает с образованием черyого порошка железной окалины – оксида железа(II, III) Fe3O4,имеющей тот же состав, что и природный минерал магнитный железняк:
3Fe + 2O2 = Fe3O4
Искры, вырывающиеся при заточке стальных ножей или при резке стальных листов ацетилено-кислородным пламенем, также представляют собой раскаленные куски железной окалины.
5) с неметаллами. Степень окисления железа в образующихся соединениях зависит от силы окислителя — неметалла. Так, при взаимодействии с хлором образуется хлорид FeCl3:
2Fe + 3Cl2 = 2FeCl3,
с серой – сульфид FeS:
Fe + S = FeS.
Соединения железа(II)
Запомнить! Оксид и гидроксид железа(II) обладают основными свойствами.
Соединения железа(II) являются сильными восстановителями и на воздухе легко окисляются до соединений трехвалентного железа:
4FeSO4 + O2 + 2H2O = 4Fe(OH)SO4.
Белый осадок гидроксида железа(II) Fe(OH)2, образующийся при действии на соли железа(II) растворов щелочей, на воздухе мгновенно зеленеет, образуя «зеленую ржавчину» – смешанный гидроксид железа(II) и железа(III), который лишь через некоторое время приобретает характерный для Fe2O3 ⋅ H2O ржавый цвет.
Соединения железа(III)
Гидроксид железа(III) выпадает в виде коричневого осадка при действии растворов щелочей, сульфидов, карбонатов на соли железа(III):
2FeCl3 + 3Na2CO3 + 6H2O = 2Fe(OH)3 +3CO2+ 6NaCl
Запомнить! Оксид и гидроксид железа(III) являются слабо амфотерными, с преобладанием основных свойств.
Так, при растворении гидроксида железа(III) в кислотах образуются соли железа(III), а при сплавлении оксида с оксидами активных металлов – ферриты (ферраты(+3)):
2Fe(OH)3 + 2H2SO4 = Fe2(SO4)3 + 3H2O,
Fe2O3 + CaO = CaFe2O4.
В концентрированных щелочах Fe(OH)3 медленно растворяется, образуя гидроксоферраты, например, Na3[Fe(OH)6]:
Fe(OH)3+3NaOHводн.=Na3[Fe(OH)6]
При действии недостатка кислот они разлагаются в образованием осадка гидроксида железа(III):
Na3[Fe(OH)6]+3HClнед.=3NaCl+Fe(OH)3↓+3H2O Na3[Fe(OH)6]+6HClизб.=3NaCl+FeCl3+6H2O
При пропускании углекислого газа они разлагаются на гидроксид железа(III) и карбонат натрия:
2Na3[Fe(OH)6]+3CO2↑=3Na2CO3+2Fe(OH)3↓+3H2O
Запомнить! Соли железа(III) и некоторых слабых кислот, например, сернистой и угольной не могут быть выделены из водных растворов по причине полного необратимого гидролиза:
2FeCl3+3Na2S+6H2O=2Fe(OH)3+3H2S↑+6NaCl
О протекании реакции судят по выделению газа и образованию коричневого осадка гидроксида железа(III).
Окисление Fe(OH)3 бромом в щелочной среде приводит к образованию вишневых растворов ферратов (+6):
2Fe(OH)3 + 3Br2 + 10KOH = 2K2FeO4 + 6KBr + 8H2O.
Запомнить! Ферраты содержат железо в степени окисления (+6), и являются сильными окислителями.
Применение железа
В виде чугуна и стали железо находит широкое применение в народном хозяйстве. Хлорид железа(III) используется при травлении медных плат, а сульфат железа(III) – в качестве хлопьеобразователя (коагулянта) при очистке воды. Ферриты двухвалентных металлов (магния, цинка, кобальта, никеля) со структурой шпинели применяют в радиоэлектронике, вычислительной технике.
Соли железа(III) образуют желто-коричневые растворы, цвет которых объясняется гидролизом, приводящим к образованию коллоидного раствора гидроксида железа(III). Многие из них, например, хлорид FeCl3×6H2O («хлорное железо») сильно гигроскопичны, и при хранении в неплотно закрытых склянках, отсыревают.
Качественные реакции на катионы железа
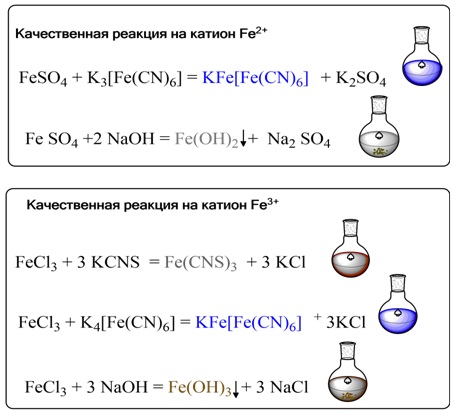
На ионы железа существуют удобные качественные реакции. Если к раствору соли железа(III) прибавить разбавленный раствор роданида калия KCNS, то образуется интенсивно-красное окрашивание, вызванное образованием роданида железа(III):
FeCl3+3KSCN=Fe(SCN)3+3KCl
Другим реагентом на ионы железа(III) служит комплексное соединение гексацианоферрат(II) калия K4[Fe(CN)6], часто называемый также «желтая кровяная соль». Такое странное на первый взгляд название связано с тем, что раньше эту соль получали нагреванием крови с поташом и железными опилками. С солями железа(III) она дает синий коллоидный раствор «берлинской лазури» или «турнбуллева синь»:
K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓+3KCl
Аналогичное синие окрашивание осадка того же состава можно получить при взаимодействии ионов железа(II) с раствором «красной кровяной соли» — гексацианоферрат(III) калия K3[Fe(CN)6]:
K3[Fe(CN)6]+FeCl2=KFe[Fe(CN)6]↓+2KCl
Таким образом, красная кровяная соль служит реактивом на соли двухвалентного железа. При более высоких концентрациях растворов выделяется нерастворимая в воде форма «берлинской лазури» состава Fe4[Fe(CN)6]3.
SHAPE * MERGEFORMAT

УПРАЖНЕНИЯ
1. Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом.
Напишите уравнения описанных реакций.
Решение:
Написаны четыре уравнения описанных реакций :
1) 2Fe + 6H2SO4 → Fe2 (SO4)3 + 3SO2↑ +6H2O
2) Fe2 (SO4)3 + 6NaOH → 2Fe(OH)3 ↓ + 3Na2SO4
3) 2Fe(OH)3 → Fe2O3 + 3H2O
4) Fe 2 O 3 + Fe → 3 FeO
_________________________________________________________________
2. Смесь алюминия и железа обработали избытком соляной кислоты, при этом выделилось 8,96 л газа (н.у.). Это же количество смеси обработали избытком раствора гидроксида натрия, выделилось 6,72 л газа (н.у.). Найти массовую долю железа в исходной смеси.
Источник: himiy88.blogspot.com