В подгруппу платины входит шесть переходных металлов. По числу электронов на 4dЗs-орбиталях (Ru, Rh, Рd) и 5d6s-орбиталях (Оs, Ir, Рt) и по аналогии физико-химических свойств все элементы VI IIБ-группы делятся на три подгруппы: 1) Ru — Оs; 2) Rh — Ir; 3) Рd — Рt. Атомный радиус у всех шести элементов изменяется в небольшом интервале: 134 пм (Ru) — 139 пм (Рt).
В электрохимическом ряду все платиновые металлы стоят после водорода. По значениям электроотрицательности все элементы группы ближе к неметаллам, чем к металлам. Поэтому соединения этих металлов проявляют амфотерность, выраженную в разной степени. Гидроксиды не всех этих элементов растворяются и в кислоте и в щелочи.
Тем не менее, элементы семейства платины образуют не только катионные, но и анионные комплексы. Устойчивые валентные состояния для элементов семейства платины следующие: Ru — IV, VI, VIII; Rh — III, IV; Рd — II, IV; Оs — IV, VI; Ir — III, IV; Рt — II, IV.
Гидроксиды Ru, Rh, Рd, Оs, Ir и Рt в четырехвалентном состоянии существуют в форме МО2•nН2О, где n = 2 (для платины n = 2, 3). Содержание воды зависит от температуры.
Естественные семейства химических элементов. 7 класс.
Гидроксиды Rh, Рd и Рt растворяются в кислотах и щелочах:
В обычных условиях платиновые металлы не взаимодействуют с такими сильными окислителями, как F2, Сl2 и О2. Низкая реакционная способность элементных веществ определяется большой энергией связи в кристаллической решетке. Та же причина определяет высокие температуры плавления и большие значения плотности.
Только платина реагирует без нагревания с окисляющей смесью кислот
или с соляной кислотой в присутствии кислорода
Все металлы платинового семейства, кроме иридия, переходят в четырехвалентное состояние при сплавлении со щелочными окисляющими смесями. Например:
Иридий переходит в трехвалентную форму.
При нагревании платиновые металлы реагируют с NаСl или НСl в токе хлора, что приводит к образованию комплекса. Например:
Платина при нагревании может образовывать цианидный комплекс:
Элементы платинового семейства образуют комплексные соединения с координационными числами 4 и 6. Наиболее изучены цианидные, галогенидные и аммиачные комплексы. Комплексные соединения могут быть катионные, анионные и нейтральные. Катионный комплекс:
Применение соединений платиновых элементов в медицине. Многочисленные исследования показали, что цис-изомер дихлородиамминплатины(II) [Рt(NН3)4]Сl2 оказывает лечебное действие при раковых заболеваниях. Действие этого комплекса основано на том, что в нем происходит постепенное замещение хлорид-ионов хелатирующими лигандами.
Такими лигандами являются аминокислотные остатки в белках. Координация идет за счет взаимодействия металла с атомами азота лиганда. После замещения хлорид-ионов создаются условия для замещения и групп NН3. В результате платина образует четыре связи с новыми лигандами. Это свойство цис-дихлородиамминплатины приводит к образованию устойчивого комплекса с молекулой ДНК.
Как определить платину в домашних условиях │Платина | Лабораторная посуда |
Таким образом, это вещество ингибирует синтез ДНК. Интересно отметить, что транс-изомер дихлородиамминплатины (II) токсичен, но противоопухолевым действием не обладает.
Наряду с цис-дихлор-диамминплатиной (II) противоопухолевой активностью обладают и другие комплексы, содержащие в качестве лигандов амины и хлорид-ионы. Например, цыс-диамминтетрахлорплатина (IV) [Рt(NН3)2Сl4] и цис-дианилиндихлороплатина (II) [Pt(NH2C6H5)2Cl2]:
Сплавы Рt — Ir и Рt — Аu применяются в ортопедической стоматологии, для изготовления шприцов; сплавы Рd—Аu, Рd—Аu—Рt, Рd—Рt—Ir — для изготовления хирургических инструментов, в ортопедической стоматологии используют сплавы Рd—Аu или Рd—Аg,Сu,Ir. Вживляемые в сердце электроды для стимуляции изготовлены из сплава Рt—Ir; Ir—Рt — эталон массы (а раньше и длины). Для дезинфекции питьевой воды применяют О3, его можно получить по реакции:
где Ir — катализатор (порошкообразный иридий).
Оксид осмия (VIII) ОsO4 применяется как фиксатор ткани (липидный стабилизатор) для гистологических исследований в виде 1%-ного раствора в ацетоне. ОsO4 можно использовать и для электронно-микроскопического выявления ферментов. Механизм действия ОsO4 может быть представлен в следующем виде:
Восстановление может идти глубже и будет образовываться Оs2О3 или ОsО. Все эти соединения имеют темно-коричневый или черный цвет, т.е. обеспечивается эффект контрастирования участка клетки или ткани (образуются эфиры холестерина и триглицеридов)
Комплекс [Ru(NН3)4(ОН)Сl]Сl — рутениевый красный также применят для анатомических и гистологических исследований. Его раствор (1:5000) окрашивает в розово-красные тона пектин.
Источник: studfile.net
Платиновые металлы
Пл а тиновые мет а ллы, платиноиды, химические элементы второй и третьей триад VIII группы периодической системы Менделеева. К ним принадлежат: рутений (Ruthenium) Ru, родий (Rhodium) Rh, палладий (Palladium) Pd (лёгкие платиновые металлы, плотность ~12 г/см 3 ); осмий (Osmium) Os, иридий (Iridium) lr, платина (Platinum) Pt (тяжёлые платиновые металлы, плотность ~22 г/см 3 ). Серебристо-белые тугоплавкие металлы; благодаря красивому внешнему виду и высокой химической стойкости платиновые металлы наряду с Ag и Au называют благородными металлами.
Историческая справка. Имеются указания, что самородная платина в древности была известна в Египте, Эфиопии, Греции и Южной Америке. В 16 в. исп. конкистадоры обнаружили в Южной Америке вместе с самородным золотом очень тяжёлый белый тусклый металл, который не удавалось расплавить. Испанцы назвали его платиной — уменьшительным от исп. plata — серебро.
В 1744 исп. морские офицер Антонио де Ульоа привёз образцы Pt в Лондон. Они вызвали живой интерес учёных Европы. Самостоятельным металлом Pt, которую первоначально считали белым золотом, была признана в середине 18 в.
В 1803 английский учёный У. Х. Волластон обнаружил в самородной платине палладий, получивший это название от малой планеты Паллады (открытой в 1802), и родий, названный так по розовато-красному цвету его солей (от греч. rh ó don — роза). В 1804 английский химик Смитсон Теннант в остатке после растворения самородной Pt в царской водке открыл ещё 2 металла. Один из них получил название иридий вследствие разнообразия окраски его солей (от греч. í ris, род. падеж í ridos — радуга), другой был назван осмием по резкому запаху его четырёхокиси (от греч. osm á — запах). В 1844 К. К. Клаус при исследовании остатков от аффинажа (очистки) уральской самородной Pt в Петербургском монетном дворе открыл ещё один платиновый металл — рутений (от позднелат. Ruthenia — Россия).
Физические и химические свойства. Физические и механические свойства платиновых металлов сопоставлены в таблице. В дополнение необходимо указать, что Ru и Os очень тверды и хрупки (возможно вследствие присутствия примесей). Rh и lr обладают меньшими твёрдостью и хрупкостью, а Pd и Pt ковки, поддаются прокатке, волочению, штамповке при комнатной температуре.
Интересна способность некоторых платиновых металлов (Ru, Pd, Pt) поглощать водород. Особенно это свойственно Pd, объём которого поглощает до 900 объёмов H2. При этом Pd сохраняет металлический вид, но растрескивается и становится хрупким. Все платиновые металлы парамагнитны. Магнитная восприимчивость c s × 10 -6 электро-магнитных единиц при 18 °С равна 0,05 у Os; 0,50 у Ru; 5,4 у Pd; у Rh, lr и Pt она несколько более 1,0.
Согласно давно установившейся традиции, платиновые металлы принято помещать в VIII группу периодической системы элементов. В соответствии с этим следовало ожидать, что все платиновые металлы должны иметь высшую степень окисления +8. Однако это наблюдается только у Ru и Os, прочие же платиновые металлы проявляют валентность не выше +6.
Объясняется это тем, что у атомов Ru и Os остаются незаполненными соответственно внутренние подуровни 4f и 5f. Поэтому для атомов Ru и Os возможно возбуждение не только с подуровней 5s и 6s на подуровни 5p и 6p, но и с подуровней 4d и 5d на подуровни 4f и 5f. Вследствие этого в атомах Ru и Os появляется по 8 непарных электронов и валентность +8.
Электронные конфигурации атомов Rh, lr, Pd, Pt такой возможности не допускают. Поэтому в некоторых вариантах таблицы Менделеева эти элементы (а также Со и Ni) выносят за пределы VIII группы. Все платиновые металлы легко образуют комплексные соединения, в которых имеют различные степени окисления и различные координационные числа. Комплексные соединения платиновых металлов, как правило, окрашены и очень прочны.
Химические свойства платиновых металлов имеют много общего. Все они в компактном виде (кроме Os) малоактивны. Однако в виде т. н. черни (мелкодисперсного порошка) платиновые металлы легко адсорбируют S, галогены и др. неметаллы. (Чернь обычно получают восстановлением платиновых металлов из водных растворов их соединений.) Компактные Ru, Rh, Os, lr, будучи сплавлены с Pt, Zn, Pb, Bi, переходят в раствор при действии царской водки, хотя она не действует на эти платиновые металлы, взятые отдельно.
Семейство платиновых металлов можно разделить на 3 диады (двойки), образованные двумя стоящими один под другим лёгким и тяжёлым платиновыми металлами, а именно: Ru, Os; Rh, lr; Pd, Pt.
При нагревании с O2 и сильными окислителями Ru и Os образуют легкоплавкие кристаллы — четырёхокиси (тетроксиды) — оранжевую RuO4 и желтоватую OsO4. Оба соединения летучи, пары их имеют неприятный запах и весьма ядовиты. При действии восстановителей превращаются в низшие окислы RuO2 и OsO2 или в металлы. Со щелочами RuO4 образует рутенаты, например рутенат калия K2RuO по реакции:
При действии хлора K2RuO4 превращается в перрутенат калия:
Четырёхокись OsO4 даёт с KOH комплексное соединение K2[OsO4(OH)2]. С фтором и др. галогенами Ru и Os легко реагируют при нагревании, образуя соединения типа RuF3, RuF4, RuF5, RuF6. Осмий даёт подобные же соединения, кроме OsF3; существование OsF8 не подтверждено. Весьма интересны комплексные соединения Ru с ксеноном Xe [RuF6] (канадский химик Н. Бартлетт, 1962), а также с молекулярным азотом — [(NO)(NH3)4 N2Ru (NH3)4 NO] CI (советский химик Н. М. Синицын, 1962) и [Ru (NH3)5N2] Cl2 (канадский химик А. Аллен, 1965).
На компактные Rh и lr царская водка не действует. При прокаливании в O2 образуются окислы Rh2O3 и Ir2O3, разлагающиеся при высоких температурах.
Pd легко растворяется при нагревании в HNO3 и концентрированной H2SO4 с образованием нитрата Pd (NO3)2 и сульфата PdSO4. На Pt эти кислоты не действуют. Царская водка растворяет Pd и Pt, причём образуются комплексные кислоты — тетрахлоропалладиевая кислота H2[PdCl4] и гексахлороплатиновая — коричнево-красные кристаллы состава H2[PtCl6] × 6H2O Из её солей наибольшее значение для технологии платиновых металлов имеет хлороплатинат аммония (NH4)2[PtCl6] — светло-жёлтые кристаллы, малорастворимые в воде и почти не растворимые в концентрированных растворах NH4CI. При прокаливании они разлагаются по реакции:
При этом Pt получается в мелкораздробленном виде (т. н. платиновая губка, или губчатая платина).
Получение. Разделение платиновых металлов и получение их в чистом виде очень сложно вследствие большого сходства их химических свойств; это требует большой затраты труда, времени, дорогих реактивов. Для получения чистой Pt исходные материалы — самородную платину, платиновые шлихи (тяжёлые остатки от промывки платиноносных песков), лом (негодные для употребления изделия из Pt и её сплавов) обрабатывают царской водкой при подогревании. В раствор переходят: Pt, Pd, частично Rh, lr в виде комплексных соединений H2[PtCl6], H2[PdCl4], Нз [RhCl6] и H2[IrCl6], а также Fe и Cu в виде FeClз и CuCl2. Нерастворимый в царской водке остаток состоит из осмистого иридия, хромистого железняка (FeCrO2), кварца и др. минералов.
Из раствора осаждают Pt в виде (NH4)2[PtCl6] хлористым аммонием. Но чтобы в осадок вместе с Pt не выпал lr в виде аналогичного нерастворимого соединения (NH4)2[lrCl6] (остальные платиновые металлы NH4Cl не осаждает), предварительно восстанавливают Ir (+4) до Ir (+3) (например, прибавлением сахара C12H22O11 по способу И. И. Черняева). Соединение (NH4)3[IrCl6] растворимо и не загрязняет осадка.
Хлороплатинат аммония отфильтровывают, промывают концентрированным раствором NH4CI (в котором осадок практически не растворим), высушивают и прокаливают. Полученную губчатую платину спрессовывают, а затем оплавляют в кислородно-водородном пламени или в электрической печи высокой частоты. Из фильтрата, оставшегося после осаждения (NH4)2[PtCl6], и из осмистого иридия извлекают прочие платиновые металлы путём сложных химических операций. В частности, для перевода в растворимое состояние нерастворимых в царской водке платиновых металлов и осмистого иридия используют спекание с перекисями BaO2 или Na2O2. Применяют также хлорирование — нагревание смеси Pt-концентратов с NaCl и NaOH в струе хлора.
В результате аффинажа получают труднорастворимые комплексные соединения: гексахлорорутенат аммония (NH4)3[RuCl6], дихлорид тетрамминдиоксоосмия [OsO2(NH3)4] Cl2, хлорпентамминдихлорид родия [Rh (NH3)5CI] Cl2, гексахлороиридат аммония (NH4)2[lrCl6] и дихлордиаммин палладия [Pd (NH3)2] Cl2. Прокаливанием перечисленных соединений в атмосфере H2 получают платиновые металлы в виде губки, например
Губчатые платиновые металлы сплавляют в вакуумной электрической печи высокой частоты.
Применяют и др. способы аффинажа, в частности основанные на использовании ионитов.
Основным источником получения платиновых металлов служат сульфидные медно-никелевые руды, месторождения которых находятся в СССР (Норильск, Красноярский край), Канаде (округ Садбери, провинция Онтарио), ЮАР и др. странах. В результате сложной металлургической переработки этих руд благородные металлы переходят в т. н. черновые металлы — нечистые никель и медь. Платиновые металлы собираются почти полностью в черновом Ni, a Ag и Au — в черновой Cu. При последующем электролитическом рафинировании Ag, Au и платиновые металлы осаждаются на дне электролитической ванны в виде шлама, который отправляют на аффинаж.
Источник: xumuk.ru
Семейство платины
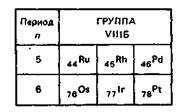
В подгруппу платины входит шесть переходных металлов. По числу электронов на 4dЗs-орбиталях (Ru, Rh, Рd) и 5d6s-орбиталях (Оs, Ir, Рt) и по аналогии физико-химических свойств все элементы VI IIБ-группы делятся на три подгруппы: 1) Ru — Оs; 2) Rh — Ir; 3) Рd — Рt. Атомный радиус у всех шести элементов изменяется в небольшом интервале: 134 пм (Ru) — 139 пм (Рt).
В электрохимическом ряду все платиновые металлы стоят после водорода. По значениям электроотрицательности все элементы группы ближе к неметаллам, чем к металлам. Поэтому соединения этих металлов проявляют амфотерность, выраженную в разной степени. Гидроксиды не всех этих элементов растворяются и в кислоте и в щелочи.
Тем не менее, элементы семейства платины образуют не только катионные, но и анионные комплексы. Устойчивые валентные состояния для элементов семейства платины следующие: Ru — IV, VI, VIII; Rh — III, IV; Рd — II, IV; Оs — IV, VI; Ir — III, IV; Рt — II, IV.
Гидроксиды Ru, Rh, Рd, Оs, Ir и Рt в четырехвалентном состоянии существуют в форме МО2∙nН2О, где n = 2 (для платины n = 2, 3). Содержание воды зависит от температуры.
Гидроксиды Rh, Рd и Рt растворяются в кислотах и щелочах:
В обычных условиях платиновые металлы не взаимодействуют с такими сильными окислителями, как F2, Сl2 и О2. Низкая реакционная способность элементных веществ определяется большой энергией связи в кристаллической решетке. Та же причина определяет высокие температуры плавления и большие значения плотности.
Только платина реагирует без нагревания с окисляющей смесью кислот
или с соляной кислотой в присутствии кислорода
Все металлы платинового семейства, кроме иридия, переходят в четырехвалентное состояние при сплавлении со щелочными окисляющими смесями. Например:
Иридий переходит в трехвалентную форму.
При нагревании платиновые металлы реагируют с NаСl или НСl в токе хлора, что приводит к образованию комплекса. Например:
Платина при нагревании может образовывать цианидный комплекс:
Элементы платинового семейства образуют комплексные соединения с координационными числами 4 и 6. Наиболее изучены цианидные, галогенидные и аммиачные комплексы. Комплексные соединения могут быть катионные, анионные и нейтральные. Катионный комплекс:
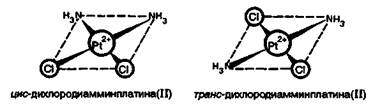
Применение соединений платиновых элементов в медицине. Многочисленные исследования показали, что цис-изомер дихлородиамминплатины(II) [Рt(NН3)4]Сl2 оказывает лечебное действие при раковых заболеваниях. Действие этого комплекса основано на том, что в нем происходит постепенное замещение хлорид-ионов хелатирующими лигандами.
Такими лигандами являются аминокислотные остатки в белках. Координация идет за счет взаимодействия металла с атомами азота лиганда. После замещения хлорид-ионов создаются условия для замещения и групп NН3. В результате платина образует четыре связи с новыми лигандами. Это свойство цис-дихлородиамминплатины приводит к образованию устойчивого комплекса с молекулой ДНК.
Таким образом, это вещество ингибирует синтез ДНК. Интересно отметить, что транс-изомер дихлородиамминплатины (II) токсичен, но противоопухолевым действием не обладает.
Наряду с цис-дихлор-диамминплатиной (II) противоопухолевой активностью обладают и другие комплексы, содержащие в качестве лигандов амины и хлорид-ионы. Например, цыс-диамминтетрахлорплатина (IV) [Рt(NН3)2Сl4] и цис-дианилиндихлороплатина (II) [Pt(NH2C6H5)2Cl2]:

Сплавы Рt — Ir и Рt — Аu применяются в ортопедической стоматологии, для изготовления шприцов; сплавы Рd—Аu, Рd—Аu—Рt, Рd—Рt—Ir — для изготовления хирургических инструментов, в ортопедической стоматологии используют сплавы Рd—Аu или Рd—Аg,Сu,Ir. Вживляемые в сердце электроды для стимуляции изготовлены из сплава Рt—Ir; Ir—Рt — эталон массы (а раньше и длины). Для дезинфекции питьевой воды применяют О3, его можно получить по реакции:
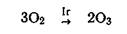
, где Ir — катализатор (порошкообразный иридий).
Оксид осмия (VIII) ОsO4 применяется как фиксатор ткани (липидный стабилизатор) для гистологических исследований в виде 1%-ного раствора в ацетоне. ОsO4 можно использовать и для электронно-микроскопического выявления ферментов. Механизм действия ОsO4 может быть представлен в следующем виде:
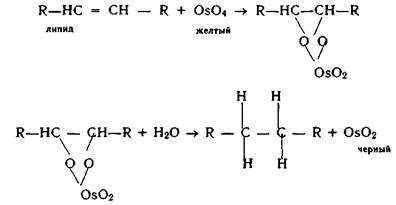
Восстановление может идти глубже и будет образовываться Оs2О3 или ОsО. Все эти соединения имеют темно-коричневый или черный цвет, т.е. обеспечивается эффект контрастирования участка клетки или ткани (образуются эфиры холестерина и триглицеридов)
Комплекс [Ru(NН3)4(ОН)Сl]Сl — рутениевый красный также применят для анатомических и гистологических исследований. Его раствор (1:5000) окрашивает в розово-красные тона пектин.
Источник: studopedia.su