

В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.

Химические свойства фенолов
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
Взаимодействие фенола с бромной водой
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |

Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:

1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |
Качественные реакции на фенол

| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |

2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |

3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.

4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.

Получение фенолов
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.

При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.

2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:

Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:

Суммарное уравнение реакции:

3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:

Получается фенолят натрия, из которого затем выделяют фенол:
Источник: chemege.ru
Качественные реакции на фенол. Получение фенолов: реакции
Карболовая кислота — одно из названий фенола, указывающее на его особое поведение в химических процессах. Это вещество легче, чем бензол вступает в реакции нуклеофильного замещения. Присущие соединению кислотные свойства объясняются подвижностью атома водорода в гидроксильной группе, связанной с кольцом. Изучение строения молекулы и качественные реакции на фенол позволяют отнести вещество к ароматическим соединениям — производным бензола.
Фенол (гидроксибензол)
Особенности строения молекулы
Взаимовлияние бензольного ядра и ОН-группы определяет химические реакции фенола с металлами, галогенами, другими веществами. Наличие атома кислорода, связанного с ароматическим циклом, ведет к перераспределению электронной плотности в молекуле. Связь O—H становится более полярной, что приводит к увеличению подвижности водорода в гидроксильной группе.
Протон может замещаться на атомы металла, что указывает на кислотность фенола. В свою очередь, ОН-группа повышает реакционные свойства бензольного кольца. Увеличивается делокализация электронов и способность к электрофильному замещению в ядре. При этом возрастает подвижность атомов водорода, связанных с углеродом в орто- и параположении (2, 4, 6).
Такой эффект обусловлен наличием донора электронной плотности — гидроксильной группы. Благодаря ее влиянию фенол активнее чем бензол ведет себя в реакциях с некоторыми веществами, а новые заместители ориентируются в орто- и пара-положения.
Кислотные свойства
В гидроксильной группе ароматических спиртов атом кислорода приобретает положительный заряд, ослабляющий его связь с водородом. Высвобождение протона облегчается, поэтому фенол ведет себя как слабая кислота, но более сильная, чем спирты. Качественные реакции на фенол включают испытание лакмусовой бумажкой, которая в присутствии протонов изменяет цвет с синего на розовый.
Наличие атомов галогенов или нитрогрупп, связанных с бензольным кольцом, приводит к росту активности водорода. Эффект наблюдается в молекулах нитропроизводных фенола. Понижают кислотность такие заместители, как аминогруппа и алкил (CH3—, C2H5— и другие). К соединениям, объединяющим в своем составе бензольное кольцо, гидроксильную группу и радикал метил, относится крезол. Его свойства слабее, чем карболовой кислоты.
Реакция фенола с натрием и щелочью

Подобно кислотам фенол взаимодействует с металлами. Например, вступает в реакцию с натрием: 2C6H5—OH + 2Na = 2C6H5—ONa + H2↑. Образуется фенолят натрия, и выделяется газообразный водород. Фенол взаимодействует с растворимыми основаниями. Происходит реакция нейтрализации с образованием соли и воды: C6H5—OH + NaOH = C6H5—ONa + H2O.
Способность отдавать водород в гидроксильной группе у фенола ниже, чем у большинства неорганических и карбоновых кислот. Вытесняет его из солей даже растворенный в воде диоксид углерода (угольная кислота). Уравнение реакции: C6H5—ONa + CO2 + H2O = C6H5—OH + NaHCO3.
Ароматические свойства обусловлены делокализацией электронов в бензольном ядре. Водород из состава кольца замещается на атомы галогенов, нитрогруппу. Подобный процесс в молекуле фенола проходит легче, чем у бензола. Один из примеров — бромирование. На бензол галоген действует в присутствие катализатора, получается бромбензол.
Фенол реагирует с бромной водой при обычных условиях. В результате взаимодействия образуется белый осадок 2,4,6-трибромфенола, появление которого позволяет отличить испытуемое вещество от похожих на него ароматических соединений. Бромирование — качественная реакция на фенол. Уравнение: C6H5—OH + 3Br2 = C6H2Br3 + HBr. Второй продукт реакции — бромоводород.
При взаимодействии фенола с разбавленной азотной кислотой получаются нитропроизводные. Продукт реакции с концентрированной азотной кислотой — 2,4,6-тринитрофенол или пикриновая кислота имеет большое практическое значение.
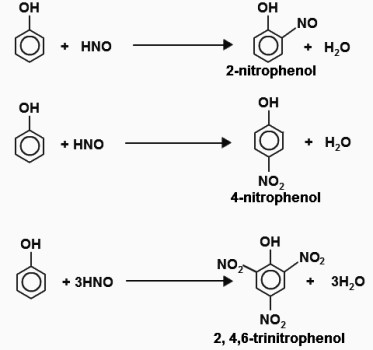
Качественные реакции на фенол. Список
При взаимодействии веществ получаются определенные продукты, которые позволяют установить качественный состав исходных веществ. Ряд цветных реакций указывает на присутствие частиц, функциональных групп, что удобно использовать для химического анализа. Качественные реакции на фенол доказывают наличие в молекуле вещества ароматического кольца и OH-группы:
- В растворе фенола синяя лакмусовая бумажка краснеет.
- Цветные реакции на фенолы также проводят в слабой щелочной среде с солями диазония. Образуются желтые либо оранжевые азокрасители.
- Реагирует с бромной водой коричневого цвета, появляется белый осадок трибромфенола.
- В результате реакции с раствором хлорида железа получается феноксид трехвалентного железа — вещество синей, фиолетовой или зеленой окраски.

Получение фенолов
Производство фенола в промышленности идет в две либо три стадии. На первом этапе из пропилена и бензола в присутствии хлорида алюминия получают кумол (тривиальное название изопропилбензола). Уравнение реакции Фриделя-Крафтса: C6H5—OH + C3H6 = C9H12 (кумол). Бензол и пропилен в соотношении 3:1 пропускают над кислотным катализатором.
Все чаще вместо традиционного катализатора — хлорида алюминия — используются экологически чистые цеолиты. На заключительной стадии проводят окисление кислородом в присутствии серной кислоты: C6H5—C3H7 + O2 = C6H5—OH + C3H6O. Фенолы могут быть получены из угля перегонкой, являются промежуточными соединениями в производстве других органических веществ.
Использование фенолов
Ароматические спирты находят широкое применение в производстве пластмасс, красителей, пестицидов и других веществ. Производство карболовой кислоты из бензола является первым шагом в создании ряда полимеров, в том числе поликарбонатов. Фенол вступает в реакцию с формальдегидом, получаются фенолформальдегидные смолы.

Циклогексанол служит сырьем для выпуска полиамидов. Фенолы применяются в качестве антисептиков и дезинфицирующих средств в дезодорантах, лосьонах. Используются для получения фенацетина, салициловой кислоты и других лекарственных препаратов. Фенолы находят применение в производстве смол, которые используются в электрических изделиях (выключатели, розетки). Они также используются в подготовке азокрасителей, например фениламина (анилина) . Пикриновая кислота, которая является нитропроизводным фенола, применяется для окрашивания тканей, изготовления взрывчатых веществ.
Источник: fb.ru
Реакционная способность фенолов
Фенолы — органические соединения, у которых гидроксильная группа связана с ароматическим ядром. Правилами номенклатуры ИЮПАК допустимо использование тривиального названия «фенол» как названия родоначальной структуры гидроксилпроизводных бензола:

По числу гидроксильных групп фенолы классифицируют на одно-, двух-, трех- и многоатомные.


Трехатомные фенолы:
Реакционные центры фенолов
В молекуле фенола можно выделить ОН-кислотный и нуклеофильные реакционные центры:

Сопряжение неподеленных пар электронов атома кислорода с бензольным кольцом препятствует формированию электрофильного центра на атоме углерода, связанном с гидроксильной группой.
Однако гидроксильная группа за счет сопряжения с бензольным кольцом и положительного мезомерного эффекта способствует появлению эффективных отрицательных зарядов в орто- и пара-положениях бензольного кольца и формированию нуклеофильных реакционных центров (ориентант I рода). Поэтому для фенолов характерны реакции электрофильного замещения.
Кислотные свойства фенолов
Кислотные свойства фенолов (трКа ~ 10) выражены значительно сильнее, чем у спиртов (рКа ~ 16-18), что связано со стабилизацией феноксид-аниона за счет сопряжения. Электроноакцепторные заместители в пара-положении бензольного кольца усиливают кислотные свойства фенолов в большей степени, чем в мета- положении, электронодонорные заместители уменьшают кислотность фенолов, так как затрудняют делокализацию отрицательного заряда в феноксид-ионе.
Кислотные свойства фенолов проявляются в реакциях с водными растворами щелочей и сопровождаются образованием растворимых солей — фенолятов:

Реакция со щелочами может быть использована для идентификации фенолов: фенолы плохо растворяются в воде и образуют эмульсию, тогда как их соли хорошо растворимы в воде.
С ионами тяжелых металлов фенолы образуют прочные комплексы. Эту реакцию используют в качественном анализе для обнаружения фенолов.
Реакция фенола с хлоридом железа (III) приводит к образованию комплекса, окрашенного в фиолетовый цвет, и также является качественной пробой на фенол.

Фенолы, в отличие от галогенопроизводных углеводородов и предельных спиртов, вследствие сопряжения ОН-группы с бензольным кольцом не вступают в реакции 5дг. Ароматическое кольцо отличается высокой реакционной способностью в реакциях S?•:

Окисление фенолов
Окисление фенолов протекает по свободнорадикальному механизму. Например, при окислении гидрохинона в качестве промежуточных продуктов образуются феноксильный радикал и семихинон. Окисление заканчивается образованием устойчивых хинонов:

Феноксильные радикалы стабилизируются за счет /?-тс-сопряжения, и поэтому фенолы могут выполнять роль ингибиторов свободнорадикальных реакций.
В организме подобным образом протекают неферментативные процессы пе- роксидного окисления липидов мембран клеток с участием свободных радикалов ОН, OR или of.
Механизм SR этого процесса включает три стадии (см. п. 6.2).
1- я стадия — инициирование: свободные радикалы образуются при одноэлектронном восстановлении молекулы кислорода (она парамагнитна и имеет два неспаренных электрона) в присутствии ионов металлов переменной валентности (например, Fe 2+ ):

2- я стадия — рост цепи:

3- я стадия — обрыв цепи:

Обрыв цепной реакции происходит в присутствии ингибиторов — антиоксидантов. Образующиеся in vivo пероксидные радикалы избирательно атакуют О-Н-связи в молекулах некоторых природных фенолов (витамин Е, убихинон). В этом случае образуются малоактивные сопряженные радикалы АгО

Поэтому фенолы играют в пероксидном окислении роль антиоксидантов. Рекомбинация радикалов и обрыв цепи окисления может осуществляться и под действием фермента супероксиддисмутазы (СОД).
Хиноны широко распространены в природе, они играют роль стимуляторов роста, антибиотиков, а также участвуют в окислительно-восстановительных процессах (см. п. 8.8).
Источник: studref.com