Альдегидами называются карбонильные соединения, содержащие в своем составе группу  , где углерод связан с углеводородным радикалом; кетоны – карбонильные соединения, имеющие группу
, где углерод связан с углеводородным радикалом; кетоны – карбонильные соединения, имеющие группу  , где углерод связан с двумя углеводородными радикалами. В зависимости от вида радикала бывают предельные, непредельные, циклические, ароматические, гетероциклические карбонильные соединения. По количеству карбонильных групп различают моно-, ди- и поликарбонильные соединения.
, где углерод связан с двумя углеводородными радикалами. В зависимости от вида радикала бывают предельные, непредельные, циклические, ароматические, гетероциклические карбонильные соединения. По количеству карбонильных групп различают моно-, ди- и поликарбонильные соединения.
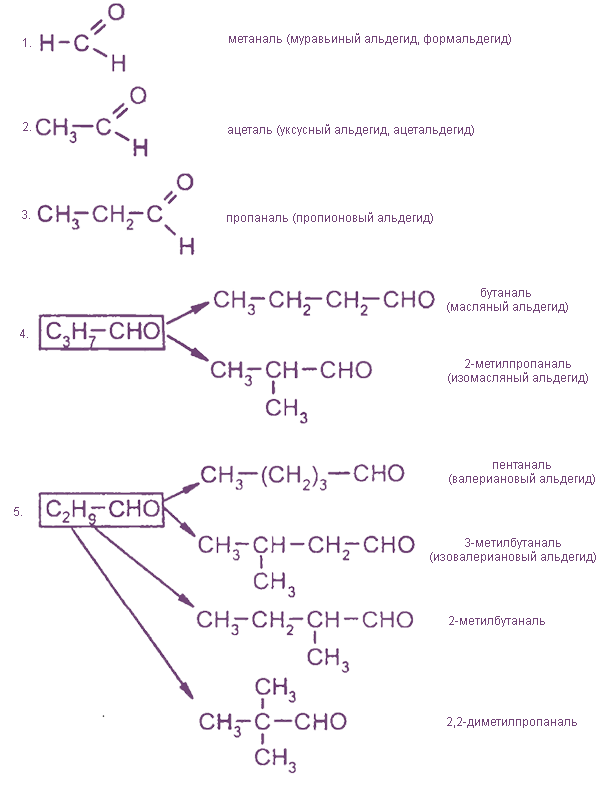
При составлении названия альдегидов к корню слова добавляется суффикс –аль, кетонов – суффикс –он с указанием его локанта.
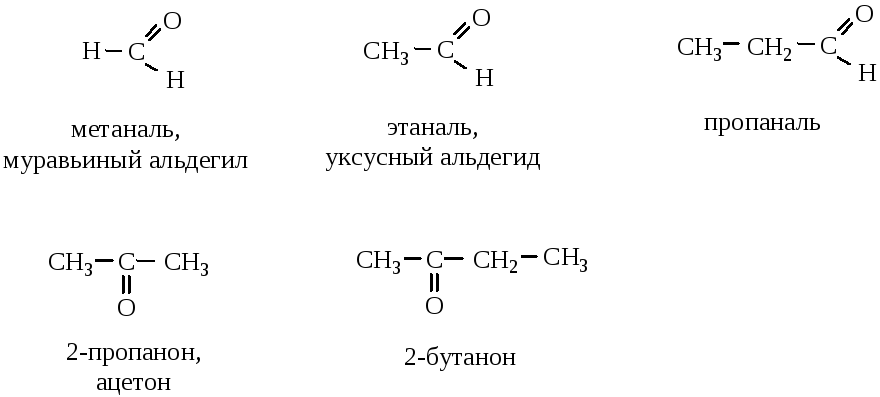
Изомерия оксосоединений определяется строением углеводородных радикалов и положением карбонильной группы.

Альдегиды и кетоны. Химические свойства. Все 23 реакции ЕГЭ.
1) Окисление спиртов (было рассмотрено ранее).
2) Дегидрирование спиртов (было рассмотрено выше).
3) Восстановление галогенангидридов карбоновых кислот по Розенмунду водородом над катализаторами. В качестве катализаторов используют Pd, нанесенный на BaSO4.

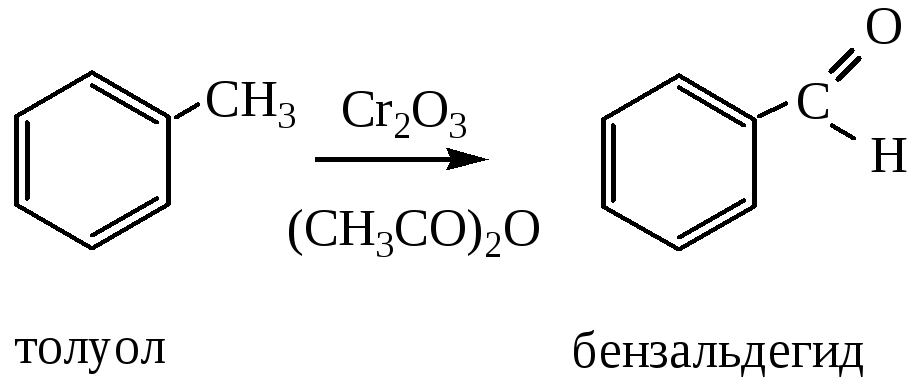
4) Окисление ароматических углеводородов, содержащих метильную группу в боковой цепи. Способ используется для получения ароматических альдегидов.
5) Разложение Ca и Ba солей карбоновых кислот при сухой перегонке. Если хотя бы один кислотный остаток является остатком муравьиной кислоты, то получаются альдегиды, если в состав соли входят остатки других карбоновых кислот – кетоны.

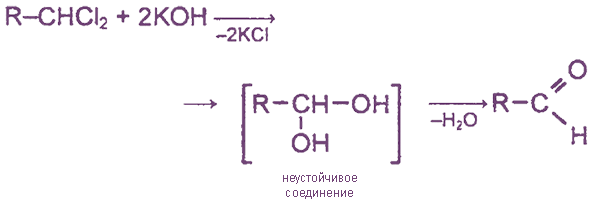
6) Гидролиз геминальных галогенопроизводных происходит при действии водных растворов щелочей. Промежуточный геминальный диол неустойчив по правилу Эрленмейера, в результате чего происходит внутримолекулярная дегидратация с образованием оксосоединений.

7) Реакция Кучерова (присоединение воды к алкинам – рассмотрена ранее).
8) Оксосинтез – присоединение СО и Н2 а алкенам в присутствии Ni или Со при 100-200 о С и р=(100-253)·10 5 Па.
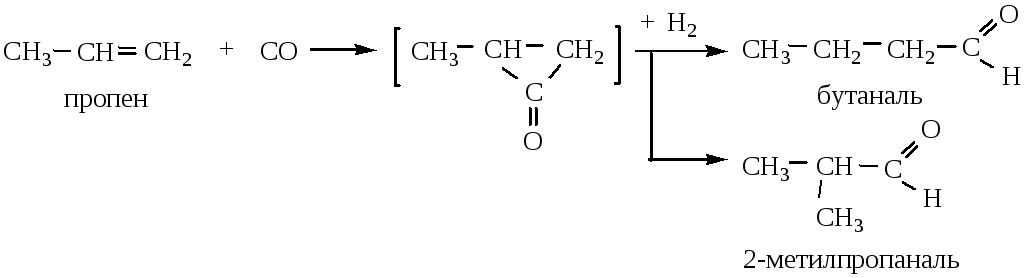
Способ характерен только для получения альдегидов.
9) Получение ароматических кетонов по реакции Фриделя-Крафтса (ацилирование бензола и его гомологов) – рассмотрено ранее.
10) Реакция Гаттермана-Коха – является способом получения ароматических альдегидов.

Абылхалимова А.С. «Альдегиды и кетоны»
Физические свойства
Муравьиный альдегид – газ, все остальные оксосоединения – жидкости или твердые вещества. tкип. альдегидов и кетонов ниже, чем tкип. соответствующих спиртов и карбоновых кислот в связи с отсутствием в молекуле водородных связей. Кетоны – более высококипящие, чем альдегиды.
Соединения с разветвленной цепью углеродных атомов имеют более низкие tкип., чем соединения нормального строения. Низшие оксосоединения обладают резким специфическим запахом, с С10 – приятный запах, применяются в парфюмерии. Альдегиды и некоторые кетоны участвуют в формировании вкуса и аромата хлеба, вина и ряда других пищевых продуктов. Все легче воды, многие хорошо в ней растворимы. В чистом виде высокотоксичные, многие – ядовитые вещества.
ХИМИЧЕСКИЕ СВОЙСТВА АЛЬДЕГИДОВ И КЕТОНОВ
Химические свойства обусловлены наличием карбонильной группы.


Так как атом кислорода более электроотрицателен, π-связь сильно смещена к нему, на атоме кислорода создается повышенная электронная плотность (проявление нуклеофильных свойств), а на атоме углерода – недостаток (проявление электрофильных свойств). Атом углерода карбонильной группы имеет sp 2 -гибридизацию, т.е. часть молекулы, содержащая имеетплоское строение, поэтому она является легко доступной для разнообразных реагентов, и оксосоединения являются очень реакционноспособными веществами (альдегиды более реакционноспособны, чем кетоны). С увеличением углеводородного радикала реакционная способность падает:

Атом кислорода карбонильной группы оттягивает также электронную плотность с соседнего углерода и атома водорода (в α-положении), поэтому атом водорода может отщепляться в виде протона Н + (проявление кислотных свойств):

Альдегиды и кетоны вступают в реакции окисления, восстановления, присоединения, замещения, конденсации и полимеризации.
1.1 реактивом Толленса – “реакция серебряного зеркала”

Выпавшее в осадок серебро покрывает стенки пробирки тонким зеркальным слоем. Реакция используется для изготовления елочных игрушек и зеркал и является качественной реакцией на альдегиды.
1.2 реактивом Феллинга (раствор комплексного соединения Cu(OH)2 c сегнетовой солью – калий-натрий-виннокислый):

Темно-синяя окраска переходит в красно-кирпичный осадок Cu2O. Реакция качественная на альдегиды, кетоны в этих условиях не окисляются.
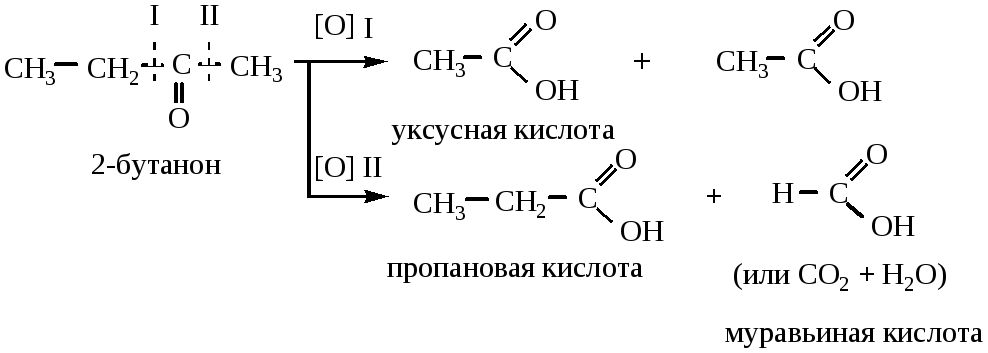
1.3 Кетоны окисляются трудно, с разрывом С–С связей, соседних с карбонильной группой (правило Попова-Вагнера) только сильными окислителями (K2Cr2O7 + H2SO4; KMnO4 конц., t o ) с образованием карбоновых кислот.
2.1 Реакция Канниццаро (для альдегидов, не содержащих водорода в α-положении).
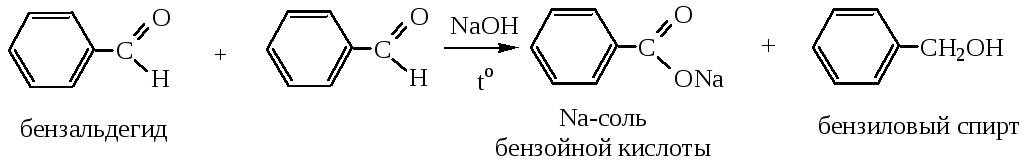
2.2 Реакция Тищенко (для любых альдегидов) – образование сложных эфиров.

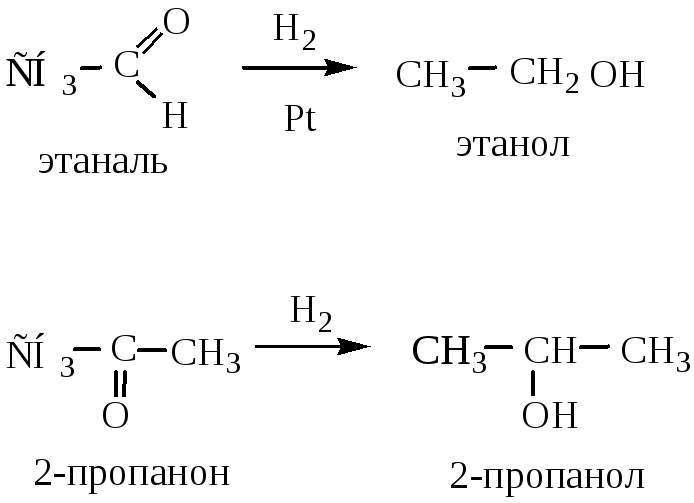
3) Восстановление оксосоединений.
3.1 До спиртов оксосоединения можно восстановить либо водородом в присутствии катализатора (Ni, Pt, Pd), либо LiAlH4. Альдегиды восстанавливаются до первичных спиртов, кетоны – до вторичных:
3.2 Восстановление ароматических альдегидов и кетонов (реакция Клеменсена) амальгамированным цинком в НСlконц. происходит до соответствующих аренов.


4.1 Присоединение синильной кислоты (HCN) идет в присутствии основания как для альдегидов, так и для кетонов.

Реакцию применяют для получения нитрилов α-гидрокси- и α-аминокислот.

4.2 Присоединение гидросульфита натрия (NaHSO3) протекает для альдегидов и метилкетонов . Если оба радикала кетона больше –СН3, то реакция не идет из-за пространственных затруднений.
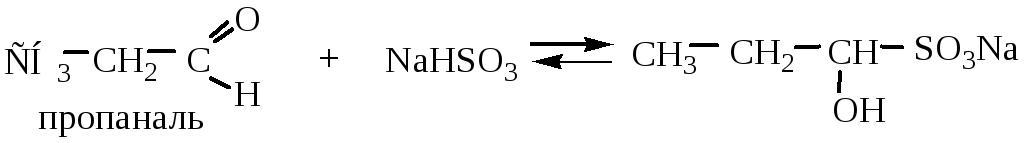
Реакция используется для выделения, очистки и количественного определения карбонильных соединений в веществах, обуславливающих вкус и запах пищевых продуктов, т.к. образующееся гидросульфитное производное выпадает в виде кристаллического осадка. При добавлении кислот или оснований происходит обратная реакция.
4.3 Присоединение спиртов протекает для альдегидов с образованием ацеталей:

Реакция идет при небольшом нагревании в присутствии HClсух.
Кетоны в этих условиях не присоединяют спирты. Ацетали участвуют в процессах биосинтеза сложных органических соединений, и в формировании запаха ряда пищевых продуктов (например, букета вина).
4.4 Присоединение металлорганических соединений:
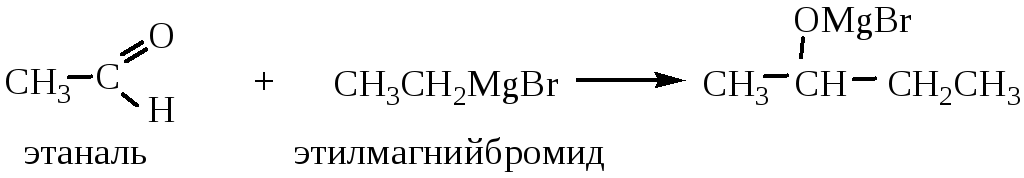
Реакцию используют для получения спиртов (была рассмотрена ранее).

5.1 Действие аммиака на альдегиды приводит к образованию альдиминов, которые затем полимеризуются с образованием альдегидаммиака.

Кетоны в жествких условиях взаимодействуют с NH3 с образованием сложных соединений (в обычных условиях – не взаимодействуют).
5.2 Взаимодействие с гидроксиламином дает альдоксимы и кетоксимы, используемые для идентификации карбонильных соединений:

5.3 Взаимодействие с гидразином и его производными приводит к образованию гидразонов, затем азинов:
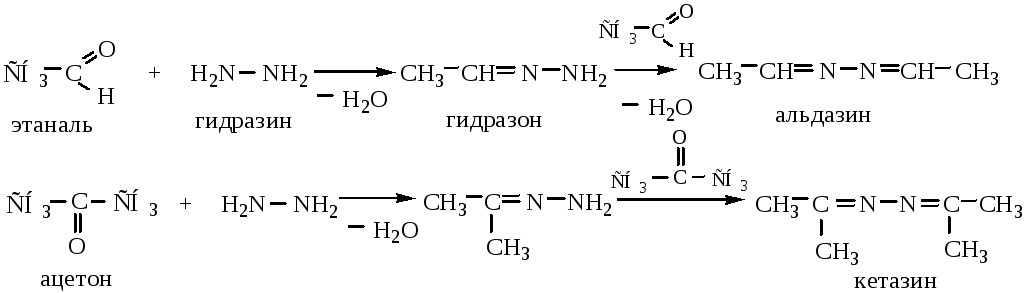
Может быть использован также фенилгидразин (H2NNHC6H5) и его производные.
5.4 Взаимодействие с пентахлоридом фосфора (PCl5) с альдегидами и кетонами приводит к образованию геминальных дигалогенопроизводных:
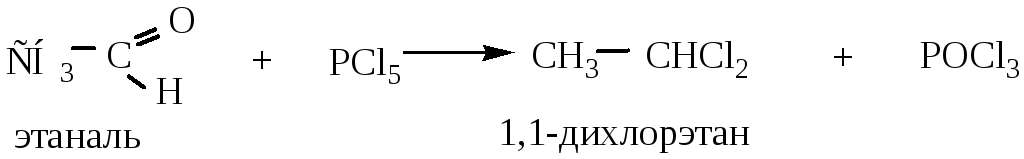
Атомы водорода, находящиеся в α-положении к карбонильной группе, обладают большой подвижностью вследствие снижения электронной плотности у углеродного атома карбонильной группы (эффект сопряжения и индукционный эффект отрицательны), поэтому могут легко замещаться.
6.1 Взаимодействие альдегидов и кетонов с галогенами протекает в присутствии оснований с образованием α-галогенопроизводных:

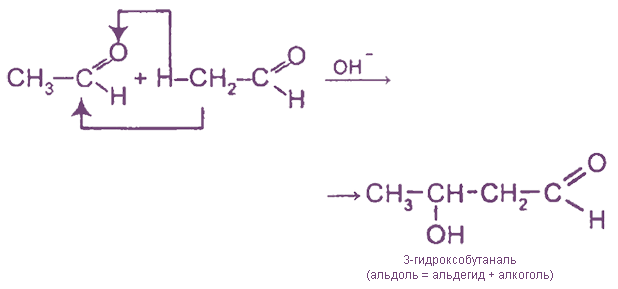
1) Альдольная конденсация может быть рассмотрена как нуклеофильное присоединение одной молекулы карбонильного соединения к другой. При этом первая молекула реагирует за счет карбонильной группы (“карбонильная компонента”), вторая – за счет атома водорода в α-положении (“метиленовая компонента”):
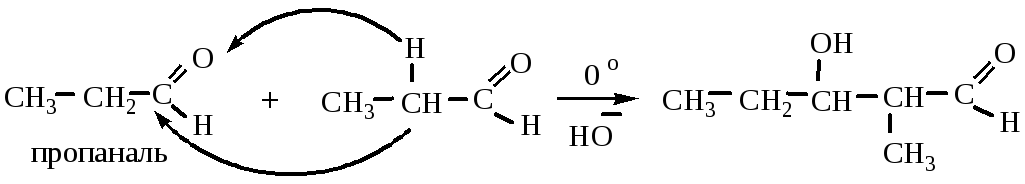
Реакция проводится в щелочной среде при 0 о С по следующему механизму:

2) Кротоновая конденсация протекает при повышенной температуре через стадию альдольной конденсации с дальнейшим отщеплением воды:
Для протекания кротоновой конденсации метиленовая компонента должна содержать не менее двух атомов водорода в α-положении к карбонилу
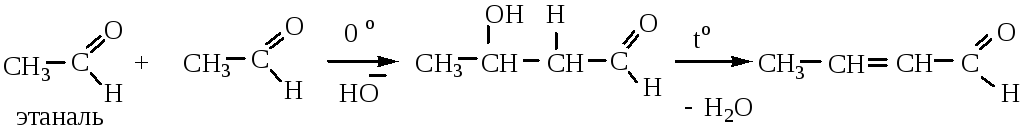
Метиленовая компонента, в данном случае, должна содержать не менее двух атомов водорода в α-положении. Альдольная и кротоновая конденсация протекает как для альдегидов, так и для кетонов.
3) Бензоиновая конденсация протекает при нагревании ароматических альдегидов в присутствии цианидов:

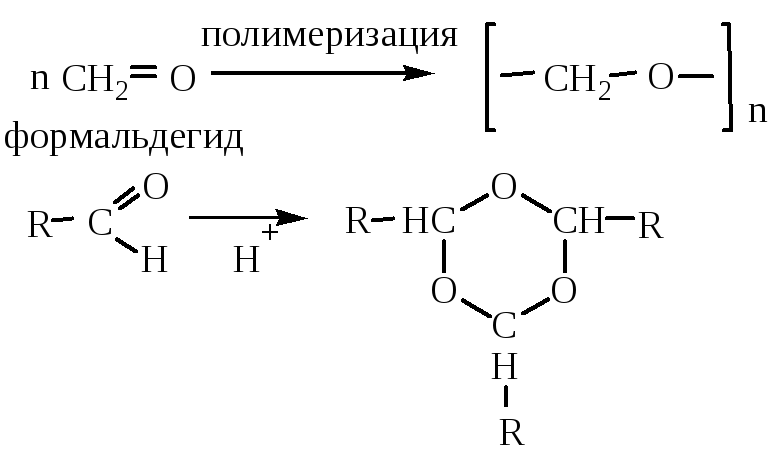
8. Поликонденсация формальдегида с фенолом протекает вначале с образованием фенолоспиртов. Группа –ОН является заместителем I рода, поэтому реакция протекает в о- или п-положение:

Фенолоспирты при нагревании конденсируются с образованием, в зависимости от условий, различных продуктов (новолачных смол):
Источник: studfile.net
Альдегиды и кетоны: свойства и получение

В этом видеоуроке собран материал по основным физическим и химическим свойствам альдегидов и кетонов, способам получения отдельных представителей класса.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет.
Получите невероятные возможности

1. Откройте доступ ко всем видеоурокам комплекта.

2. Раздавайте видеоуроки в личные кабинеты ученикам.

3. Смотрите статистику просмотра видеоуроков учениками.
Получить доступ
Конспект урока «Альдегиды и кетоны: свойства и получение»
Рассмотрим физические свойства альдегидов. При обычных условиях метаналь находится в газообразном состоянии, имеет резкий неприятный запах и ядовит. Остальные альдегиды – жидкости и твёрдые вещества. Низшие альдегиды, как правило, имеют неприятный и резкий запах, высшие альдегиды обладают цветочным запахом.
Температуры кипения альдегидов ниже, чем у спиртов с таким же числом атомов углерода, так как в них отсутствуют межмолекулярные водородные связи.
Простейшие альдегиды хорошо растворяются в воде. Например, уксусный альдегид неограниченно растворим в воде, формальдегид достаточно хорошо растворим в воде. Формалин – это 40 %-ный раствор формальдегида.
Химические свойства альдегидов и кетонов обусловлены строением карбонильной группы. Из-за того, что в карбонильной группе у атома кислорода частичный отрицательный заряд, а у атома углерода – частичный положительный, для альдегидов характерны реакции присоединения.
Для альдегидов и кетонов характерны реакции присоединения водорода. При этом образуются спирты. Так, в реакции этаналя с водородом в присутствии никелевого или платинового катализатора, образуется этанол. Гидрирование альдегидов и кетонов относят к реакциям восстановления.

Кроме этого, альдегиды легко окисляются до соответствующих карбоновых кислот. Если к аммиачному раствору оксида серебра (I) прилить раствор уксусного альдегида и смесь нагреть, то образуется уксусная кислота и внутренняя поверхность пробирки покрывается тонким слоем серебра.

Эту реакцию называют реакцией «серебряного зеркала». Она является качественной для обнаружения альдегидов.
Ещё одной качественной реакцией на альдегиды является реакция со свежеприготовленным гидроксидом меди (II). Так, при окислении уксусного альдегида гидроксидом меди (II) образуется уксусная кислота и осадок красного цвета, представляющий собой оксид меди (I).

Окислить альдегиды можно также K2Cr2O7, KMnO4 или кислородом воздуха в присутствии катализатора. При этом также образуются карбоновые кислоты. Например, при окислении пропионового альдегида кислородом воздуха в присутствии катализатора образуется пропановая кислота.

В промышленных масштабах альдегиды получают из нефти, галогенпроизводных и спиртов.
В лаборатории альдегиды и кетоны получают окислением спиртов. Так, при окислении этанола оксидом меди (II) образуется уксусный альдегид.

При окислении пропанола-2 в тех же условиях образуется ацетон, который является кетоном.

Альдегиды и кетоны можно получить гидратацией алкинов. Так, гидратацией ацетилена в условиях реакции Кучерова образуется уксусный альдегид.
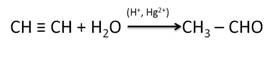
В результате присоединения воды к пропину образуется кетон – ацетон.

Одним из промышленных способов получения альдегидов является окисление алкенов в присутствии солей палладия.

Альдегиды можно получить и в реакции с алкенами – оксосинтез. Так, в реакции этилена с синтез-газом в определённых условиях образуется пропаналь.

Альдегиды и кетоны можно получить в реакции гидролиза дигалогензамещённых алканов. Например, в реакции 1,1-дихлорэтана с водным раствором щёлочи образуется этаналь, в реакции 2,2-дихлорпропана с водным раствором щёлочи образуется ацетон.

Альдегиды и кетоны получают дегидрированием спиртов в присутствии катализатора меди. Так, при дегидрировании первичного спирта этанола образуется этаналь, при дегидрировании вторичного спирта пропанола-2 образуется кетон – ацетон.

Таким образом, реакционная способность альдегидов и кетонов обусловлена строением карбонильной группы. Для альдегидов и кетонов характерны реакции присоединения по месту двойной связи С = О, для альдегидов характерны реакции окисления по месту связи С – Н в альдегидной группе. К основным промышленным способам получения альдегидов и кетонов относятся: окисление спиртов и дегидрирование спиртов.
Источник: videouroki.net
Альдегиды изомерны другому классу соединений — кетонам

Атом углерода альдегидной группы находится в состоянии sp 2 -гибридизации, поэтому все σ-связи в этой группе располагаются в одной плоскости. Облака р-электронов, образующих π-связь, перпендикулярны этой плоскости и легко смещаются к более электроотрицательному атому кислорода. Поэтому двойная связь C=O (в отличие от двойной связи C=C в алкенах) сильно поляризована.
Физические свойства

Химические свойства
Альдегиды — реакционноспособные соединения, вступающие в многочисленные реакции. Наиболее характерны для альдегидов:
а) реакции присоединения
по карбонильной группе; реагенты типа НХ присоединяются следующим образом:
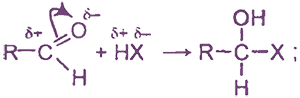
б) реакции окисления
связи C-H альдегидной группы, в результате которых образуются карбоновые кислоты:
1. Гидрирование (образуются первичные спирты
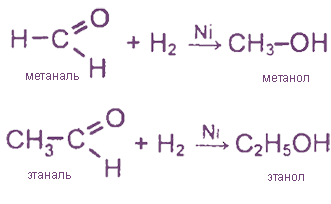
2. Присоединение спиртов (образуются полуацетали и ацетали)
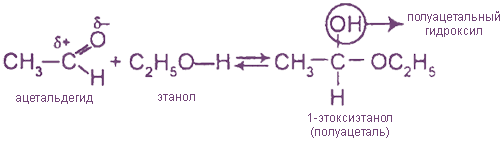
В избытке спирта в присутствии HCl полуацетали превращаются в ацетали:
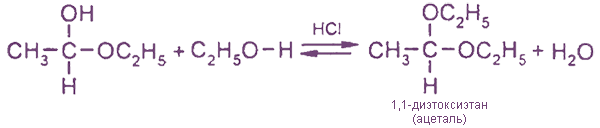
1. Реакция «серебряного зеркала»
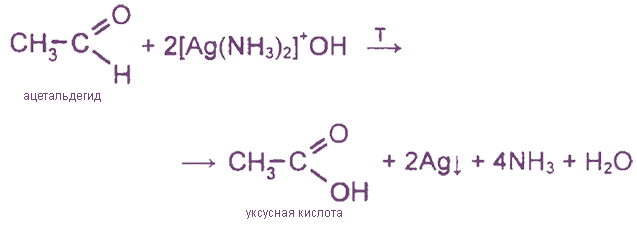
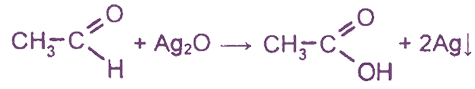
Эта реакция является
качественной реакцией на альдегидную группу
(на стенках реакционного сосуда образуется зеркальный налет металлического серебра).
2. Реакция с гидроксидом меди (II)
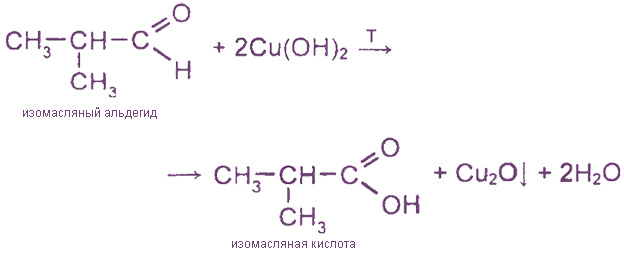
Эта реакция также является
качественной реакцией на альдегидную групп
у (выпадает красный осадок Сu2O).
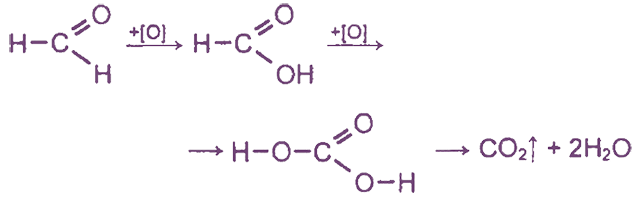
Формальдегид окисляется различными O-содержащими окислителями сначала до муравьиной кислоты и далее — до Н2СO3(СO2 + Н2O):
1. Альдольная конденсация
2. Тримеризация ацетальдегида
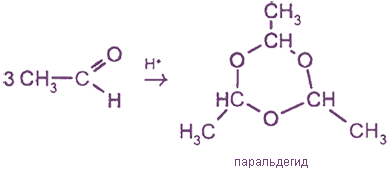
3. Полимеризация формальдегида
При длительном хранении формалина (40%-ный водный раствор формальдегида) в нем происходит полимеризация с образованием белого осадка параформа:
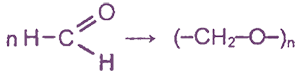
IV. Реакция поликонденсации формальдегида с фенолом
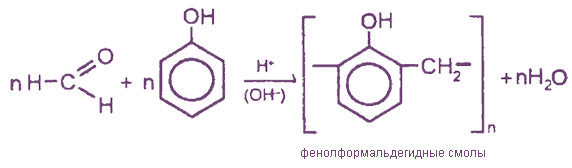
V. Превращение формальдегида в углеводы

VI. Взаимодействие формальдегида с аммиаком
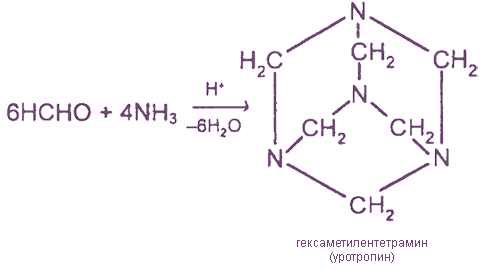
Способы получения
1. Окисление алкенов

2. Каталитическое окисление первичных спиртов

3. Окисление первичных спиртов различными окислителями (КМnО4, K2Cr2О7 и др.)
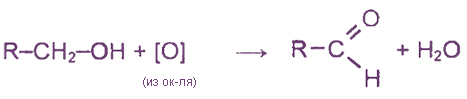
4. Каталитическое дегидрирование первичных спиртов
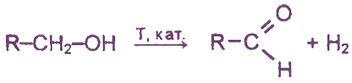
5. Щелочной гидролиз дигалогеналканов, содержащих атомы галогена у первичного атома углерода.
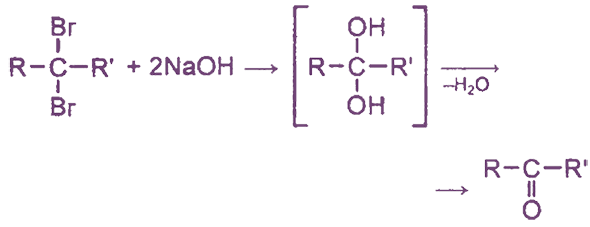
При гидролизе дигалогеналканов, содержащих атомы галогена у вторичного атома углерода, образуются кетоны:
Специфические способы получения формальдегида и ацетальдегида
1. Каталитическое окисление метана

2. Гидратация ацетилена (реакция Кучерова)
Источник: examchemistry.com