4.1.5. Качественные реакции органических соединений.
Постепенное обесцвечивание подкисленного раствора KMnO4. Выпадения бурого осадка MnO2 не наблюдается, поскольку марганец восстанавливается до практически бесцветной соли двухвалентного марганца. Чаще всего в качестве подкислителя изпользуют серную кислоту. На примере с толуолом реакция выглядит следующим образом:
Исчезновение желто-коричневой окраски бромной воды с одновременным выпадением белого осадка трибромфенола:
Разбавленный водный раствор соли железа (III), например,
Исчезновение желто-коричневой окраски бромной воды с одновременным выпадением белого осадка триброманилина:
Одноатомные первичные и вторичные спирты
Черный CuO при нагревании со спиртом изменяет свою окраску на красную в связи с восстановлением до Cu 0 . Первичный спирт при этом превращается в альдегид:
R-CH2-OH + CuO =t o => R-CHO + Cu + H2O,
вторичный — в кетон:
R-C(OH)-R’+ CuO =t o => R-C(O)-R’ + Cu + H2O,
Качественные реакции на белки
В случае метанола появляется легко узнаваемый запах формальдегида (естественно, чтобы он был узнаваемым, нужно до этого быть знакомым с его запахом:-) )
В случае реакции с CuO этилового спирта чувствуется специфический запах ацетальдегида, схожий с ароматом прелых яблок сорта «антоновка»
Растворение голубого осадка Cu(OH)2 с образование ярко-синего раствора комплексного соединения меди. На примере с глицерином уравнение реакции выглядит следующим образом:
Альдегиды,
—CHO
Аммиачный раствор оксида серебра
Так называемая реакция серебряного зеркала. В результате восстановления Ag +1 в металлическое серебро Ag 0 на стенках сосуда образуется зеркало. При небрежном смешении реагентов или в недостаточно чистом сосуде вместо серебряного зеркала может образоваться черный осадок, состоящий из мелкодисперсных частиц металлического серебра. В обоих случаях наблюдаемые явления описываются уравнением в общем виде:
Образование оранжево-красного осадка Cu2O при нагревании в результате реакции:
Карбоновые кислоты,
-COOH
Выделение углекислого газа в результате разложения образующейся нестойкой угольной кислоты H2CO3:
Появление запаха сложного эфира, образующегося в результате реакции:
R-COOH + R’-OH → R-COO-R’ + H2O
Запахи эфиров весьма разнообразны, но общим является ярко выраженная пахучесть, нередко, могут напоминать ароматы различных фруктов.
Муравиная кислота
-СНО
и
-СООН
Окрашивание лакмуса в красный цвет, по причине кислой среды, создаваемой муравьиной кислотой:
HCOOH ↔ HCOO — + H +
Аммиачный раствор оксида серебра
Молекуле муравьиной кислоты, не смотря на ее малый размер удается сочетать в себе помимо карбоксильной группы также и карбонильную, которая позволяет вступать муравьиной кислоте в реакцию серебряного зеркала подобно альдегидам:
Растворимые соли жирных карб. кислот, например, стеарат натрия
Выпадение хлопьевидного белого осадка малорастворимой жирной кислоты:
Выпадение белого осадка нерастворимой кальциевой или магниевой соли жирной кислоты. Ионное уравнение в общем виде:
где R-длинный углеводородный радикал.
На примере, стеарата натрия и хлорида кальция молекулярное уравнение реакции выглядит так:
Окрашивание фенолфталеина в малиновый цвет как в щелочах, ввиду того, что соли жирных кислот гидролизуются по аниону:
Качественные реакции в органической химии
Качественные реакции в органической химии используются для быстрого распознавания класса соединения. Для таких реакций характерно проявление внешних эффектов — изменение цвета раствора, выпадение осадка или выделение газа.
Качественные реакции на алканы
- При горении алканов пламя становится голубым.
- Реакция окисления алканов перманганатом калия на холоде не идет – раствор не меняет цвет.
Качественные реакции на алкены
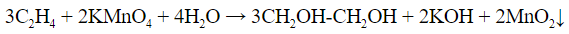
- Реакция Вагнера – обесцвечивание раствора перманганата калия, сопровождается выпадением темно-коричневого осадка диоксида марганца:
- Обесцвечивание бромной воды:

Качественные реакции на алкины
- Реакция Вагнера – раствор перманганата калия обесцвечивается и выпадает осадок черного цвета (диоксид магния):
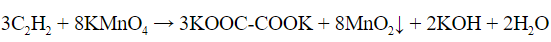
- Обесцвечивание бромной воды:
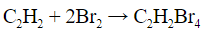
- С реактивом Толленса (гидроксид диамин серебра) только алкины с крайними тройными связями образуют осадок ацетиленида серебра. Алкины с другим расположением тройной связи в реакцию не вступают:
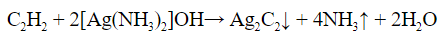
Качественные реакции на альдегиды
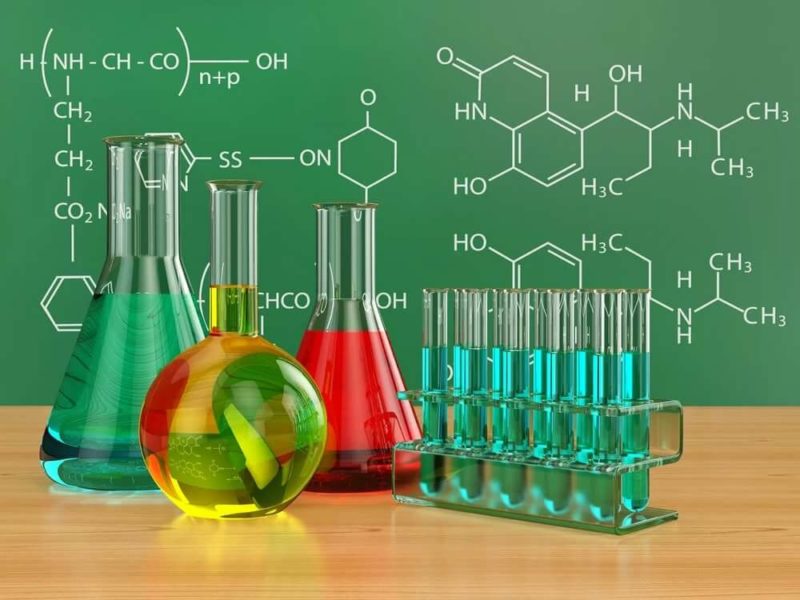
- Реакция серебряного зеркала с реактивом Толленса при нагревании — серебро покрывает зеркальным слоем стенки пробирки. При некачественном проведении эксперимента выпадает черный осадок мелкодисперсного серебра:

- Со свежеприготовленным гидроксидом меди при нагревании альдегиды образуют красно-оранжевый осадок оксида меди (I):
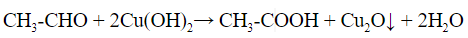
- С реактивом Несслера (щелочной раствор тетраиодомеркурата (II) калия) образуется осадок металлической ртути черного цвета:
- При взаимодействии бесцветных альдегидов с раствором бесцветной фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
Качественные реакции на спирты
Спирты делят на одно- и многоатомные (по количеству ОН-групп) и определяют с помощью разных качественных реакций.
1. Для одноатомных спиртов
1.1 С оксидом меди (II) — над раскаленным оксидом пропускают пары спирта, образуется альдегид, который выявляют пробой с фуксинсернистой кислотой – раствор окрашивается в характерный бледно-фиолетовый цвет:
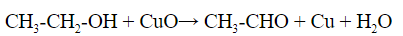
1.2 Йодоформная проба – с йодом и гидроксидом натрия образуется йодоформ, осадок желтого цвета:

1.3. Проба Лукаса для выявления вторичных и третичных спиртов – первичные в реакцию не вступают. При взаимодействии одноатомных спиртов с концентрированным раствором соляной кислоты и хлорида цинка раствор расслаивается и образуется мутный маслянистый слой алкилхлорида:

2. Для многоатомных спиртов на примере глицерина
Голубой осадок гидроксида меди (II) при нормальных условиях растворяется в глицерине с образованием комплексного соединения меди ярко-синего цвета:

Качественные реакции на карбоновые кислоты
1. Фиолетовый раствор лакмуса карбоновые кислоты окрашивают в красный цвет.
2. Разложение под действием серной кислоты на угарный газ и воду. Выделяющийся угарный газ можно поджечь – он горит синим пламенем.
Для муравьиной кислоты:

Аналогично разлагается и многоосновная щавелевая кислота:
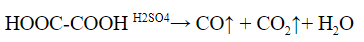
3. Реакция щавелевой кислоты с солями меди (II) – выпадает зелено-голубой кристаллический осадок оксалата меди:
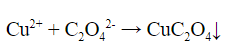
Качественные реакции на амины
- Фиолетовый раствор лакмуса амины окрашивают в синий цвет.
- Образование дыма в результате взаимодействия летучих аминов с газообразным хлороводородом.
- Первичные амины с хлороформом в щелочной среде образуют соединения – изонитрилы с характерным неприятным запахом:
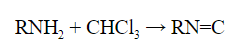
Качественные реакции на анилин
- При действии хлорной извести водный раствор анилина приобретает интенсивный фиолетовый цвет.
- При бромировании образуется белый осадок 2,4,6-триброманилина:

Качественные реакции на фенол
- При взаимодействии с хлоридом железа (III) раствор приобретает фиолетовый цвет:
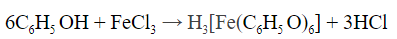
- С бромной водой образует твердый белый осадок 2,4,6-трибромфенола:

- При поликонденсации фенолов с альдегидами в кислой или щелочной среде образуются смолообразные полимеры и вода.
Качественные реакции на алкилхлориды
Проба Бейльштейна – качественная реакция определения хлора в органических соединениях.
Образец алкилхлорида на прокаленной медной проволоке помещают в пламя горелки, которое становится сине-зеленым.
Качественные реакции на углеводы
Углевод содержат альдегидные и гидрокси- группы — характерными будут реакции на спирты и альдегиды.
1. Крахмалсодержащие растворы под действием йода становятся синими.
- при нагревании раствор обесцвечивается;
- охлажденный – восстанавливает синий цвет.
2. Проба Селиванова определяет наличие фруктозы. В присутствии резорцина и соляной кислоты углевод приобретает красно-вишневый цвет.
Качественные реакции на белки
Цветные реакции позволяют выявить наличие белков в растворах.
- Ксанторотеиновая или Мульдера реакция выявляет в белке наличие аминокислот ароматического ряда (триптофана, тирозина и фенилаланина). Раствор обрабатывается концентрированной азотной кислотой – он окрашивается в желтый цвет; после добавления щелочи цвет изменяется на оранжевый.
- Реакция Фоля указывает на наличие аминокислот, содержащих слабосвязанную серу (цистина и цистеина). При кипячении белка со щелочью сера в виде сульфида свинца дает осадок бурого или черного цвета.
- Горение белка сопровождается запахом паленой шерсти. Качественные реакции в органической химии помогают с минимальными затратами определить, к какому классу соединений относится вещество.
Источник: al-shell.ru
Качественные реакции на органические вещества

1. Качественные реакции на органические вещества
2.
Качественная реакция на алкены
Чтобы убедиться в наличии алкена, нужно пропустить его в
раствор перманганата калия (реакция Вагнера). В ходе реакции
раствор обесцветится, выпадает бурый диоксид марганца MnO2
3C2H4 + 2KMnO4 + 4H2O = 3CH2OH-CH2OH + 2KOH +
+ 2MnO2↓
3.
Качественная реакция на алкены
Так же, алкены обесцвечивают бромную воду:
C2H4 + Br2 = C2H4Br2
Бромная
вода
обесцвечивается,
дибромпроизводное.
образуется
4.
Качественная реакция на алкины
Алкины можно выявить и по реакции Вагнера или с
помощью бромной воды:
3C2H2 + 8KMnO4 = 3KOOC-COOK + 8MnO2↓ +
+ 2KOH + 2H2O
C2H2 + 2Br2 = C2H2Br4
5.
Качественная реакция на алкины
Алкины, с тройной связью у крайнего атома
углерода реагируют с аммиачным раствором оксида
серебра (гидроксид диаминсеребра (I)) (реактив
Толленса):
C2H2 + 2[Ag(NH3)2]OH = Ag2C2↓ + 4NH3↑ + 2H2O
Получившийся ацетиленид серебра (I) выпадает в осадок.
6.
Качественная реакция на альдегиды
7.
Качественная реакция на альдегиды
Если опыт проведен грамотно, то выделяющееся серебро
покрывает колбу ровным слоем, создавая эффект зеркала.
Именно поэтому реакция называется реакцией серебряного
зеркала.
Примечание: реакцией серебряного зеркала также можно
выявить метановую (муравьиную) кислоту HCOOH.
При чем тут кислота, если мы говорим про альдегиды? Все
просто: муравьиная кислота — единственная из карбоновых
кислот,
содержащая
одновременно
альдегидную
и
карбоксильную группы.
8.
Качественная реакция на альдегиды
Реакция с гидроксидом меди (II) Cu(OH)2. Для этого к
свежеприготовленному гидроксиду меди (II) добавляют альдегид
и нагревают смесь
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
CH3-CHO + 2Cu(OH)2 = CH3-COOH + Cu2O↓ + 2H2O
Выпадает оксид меди (I) Cu2O — осадок красного цвета
9.
Качественные реакции на спирты
Окисление спирта оксидом меди. Для этого пары спирта
пропускают над раскаленным оксидом меди. Затем
полученный альдегид улавливают фуксинсернистой кислотой,
раствор становится фиолетовым:
CH3-CH2-OH + CuO = CH3-CHO + Cu + H2O
10.
Качественные реакции на спирты
Спирты идентифицируются пробой Лукаса — конц. раствор
соляной кислоты и хлорида цинка. При пропускании
вторичного или третичного спирта в такой раствор образуется
маслянистый осадок соответствующего алкилхлорида:
CH3 – CHOH – CH3 + HCl – ZnCl2→ CH3 – CHCl–CH3↓ +
+H2O
Первичные спирты
в реакцию не вступают.
11.
Качественные реакции
на многоатомные спирты
Наиболее известная качественная реакция на многоатомные
спирты — взаимодействие их с гидроксидом меди (II).
Гидроксид растворяется, образуется хелатный комплекс темносинего цвета.
12.
Качественные реакции на карбоновые
кислоты
При добавлении концентрированной серной кислоты H2SO4 к
раствору муравьиной кислоты образуется угарный газ и вода:
HCOOH + H2SO4→ CO↑ + H2O
Угарный газ можно поджечь. Горит синем пламенем:
2CO + O2 →2CO2
Качественную реакцию на щавелевую H2C2O4(HOOC-COOH)
кислоту. При добавлении к раствору щавелевой кислоты раствор
соли меди (II) выпадет осадок оксалата меди (II):
Cu2+ + C2O42- → CuC2O4↓(голубой осадок)
13.
Качественная реакции на ацетаты
При добавлении раствора треххлористого железа к
раствору соли уксусной кислоты, наблюдают
окрашивание раствора в красно-бурый цвет:
3СН3СООNa + FeCl3 = (СН3СОО)3Fe + 3NaCl
14.
Качественные реакции на фенол
Фенол лучше всего обнаруживает хлорид железа (III) —
образуется фиолетовое окрашивание раствора. Это лучший
метод обнаружения фенола, т.к. реакция очень чувствительна.
3С6Н5ОН + FeCl3 = (С6Н5О)3Fe + 3НСl
образуется фиолетовое окрашивание раствора
15.
Качественные реакции на фенол
Фенол наряду с анилином дает осадок белого цвета со
специфическим запахом при пропускании в водный
раствор брома – 2, 4, 6 — трибромфенол
С6Н5ОН + 2Br2 = С6Н2Br3ОН↓ + НBr
16.
Качественная реакция на белки
Ксантопротеиновая реакция. Данная реакция обнаруживает
ароматические аминокислоты, входящие в белки (на примере
тирозина):
(OH)C6H4CH(NH2)COOH + HNO3 →(OH)C6H3(NO2)CH(NH2)COOH + H2O
— без
нагревания – появляется желтое окрашивание раствора;
При нагревании и добавлении раствора аммиака белок
окрашивается в желтый цвет
.
17.
Качественная реакция на белки
Биуретовая реакция для обнаружения пептидной связи
(CO-NH):
Белок + CuSO4 + NaOH → красно-фиолетовое окрашивание
18.
Качественная реакция на белки
Специфический запах (паленого, жженых перьев) при
горении
Белок + обжиг → запах паленого
19.
Качественная реакция
на стеарат натрия (мыло)
При добавлении к раствору мыла фенолфталеина
наблюдают малиновое
окрашивание, происходит
реакция гидролиза:
С17Н35СООNa + Н2О = С17Н35СООН↓ + NaОН
20.
Качественная реакция
на стеарат натрия (мыло)
При добавлении к раствору мыла
соли хлорида
кальция, наблюдают образование серого осадка:
2С17Н35СООNa + СаСl2 = (С17Н35СОО)2Са↓ + 2NaСl
21.
Качественная реакция
на стеарат натрия (мыло)
При добавлении к раствору мыла концентрированной
неорганической кислоты происходит образование
белого осадка:
С17Н35СООNa + НNО3 = С17Н35СООН↓ + NaNО3
Источник: ppt-online.org
Качественные реакции на органические, неорганические вещества и примеры заданий из ЕГЭ и ГИА по химии
После того как вы поделитесь материалом внизу появится ссылка для скачивания.
Получить код —>
Химия — еще материалы к урокам:
- Тест «Скорость химических реакций» 8 класс
- Тесты «Фотохимия»
- Контрольная работа «Природные источники углеводородов»
- Проверочная работа «Классы веществ»
- Презентация «Mg и Са в организме человека»
- Технологическая карта урока «Металлы» 8 класс
Предметы
 Алгебра
Алгебра Английский язык
Английский язык Биология
Биология География
География Геометрия
Геометрия ИЗО
ИЗО Информатика
Информатика История
История Литература
Литература Математика
Математика Музыка
Музыка МХК
МХК Начальная школа
Начальная школа ОБЖ
ОБЖ Обществознание
Обществознание Окружающий мир
Окружающий мир ОРКСЭ
ОРКСЭ Педагогика
Педагогика Русский язык
Русский язык Технология
Технология Физика
Физика Физкультура
Физкультура Химия
Химия Экология
Экология
Похожие материалы
- 22-02-2019, 17:55 Тест «Неорганические и органические полимеры»
- 22-08-2018, 11:46 Урок химии в 8 классе «Предмет химии. Вещества» ФГОС
- 2-02-2018, 01:08 Контрольная работа «Органические и неорганические вещества клетки» 10
- 1-02-2018, 11:31 Конспект урока «Основания: органические и неорганические» 11 класс
- 5-06-2017, 22:10 Контрольная работа по химии «Углеводы. Азотсодержащие органические
- 19-11-2016, 12:03 Презентация «Качественные реакции в органической химии»
- 25-10-2016, 19:55 Презентация «Предмет органической химии. Органические вещества» 10
- 15-07-2015, 15:57 Презентация «Качественные реакции по органической химии» 10-11 класс
Источник: uchitelya.com